Casos Clínicos
HIPERAMONIEMIA SECUNDARIA A INFECCION URINARIA EN PACIENTE CON MALFORMACION DEL TRACTO URINARIO EN PEDIATRIA: A PROPOSITO DE UN CASO
En general, la hiperamoniemia se asocia con un trastorno del ciclo de la urea; sin embargo, se debe evaluar la técnica de toma y procesamiento de la muestra para hacer un diagnóstico adecuado. Este caso sugiere que los pacientes con vía urinaria dilatada e infectada por un microorganismo productor de ureasa tienen riesgo de presentar hiperamoniemia, situación que puede resolverse con la administración adecuada de antibióticos y la desobstrucción del tracto urinario.
Coautores
Hernán Eiroa* Ana Clara Bernal** Verónica Bindi**
Médico, Hospital de Pediatria S.A.M.I.C. Prof. Dr. Juan P. Garrahan, Ciudad de Buenos Aires, Argentina*
Médica, Hospital de Pediatria S.A.M.I.C. Prof. Dr. Juan P. Garrahan, Ciudad de Buenos Aires, Argentina**
Hernán Eiroa* Ana Clara Bernal** Verónica Bindi**
Médico, Hospital de Pediatria S.A.M.I.C. Prof. Dr. Juan P. Garrahan, Ciudad de Buenos Aires, Argentina*
Médica, Hospital de Pediatria S.A.M.I.C. Prof. Dr. Juan P. Garrahan, Ciudad de Buenos Aires, Argentina**
Clasificación en siicsalud
Artículos originales > Expertos del Mundo >
página /dato/casiic.php/155943
Especialidades





Artículos originales > Expertos del Mundo >
página /dato/casiic.php/155943
Especialidades





Primera edición en siicsalud
24 de octubre, 2017
24 de octubre, 2017
HIPERAMONIEMIA SECUNDARIA A INFECCION URINARIA EN PACIENTE CON MALFORMACION DEL TRACTO URINARIO EN PEDIATRIA: A PROPOSITO DE UN CASO
(especial para SIIC © Derechos reservados)
(especial para SIIC © Derechos reservados)
Introducción
La hiperamoniemia es la acumulación de amonio (NH4) en sangre, debido a un desequilibrio entre su producción y su eliminación. El amonio se produce en diversos tejidos del cuerpo, como el músculo estriado, riñones y cerebro; sin embargo, la mayor parte proviene de la degradación de los aminoácidos y otras sustancias nitrogenadas en el tubo digestivo.1
La hiperamonemia se puede clasificar, según su causa, en hepática y no hepática. Se trata de hiperamonemia de causa hepática cuando hablamos de una enfermedad hepática descompensada. Y de causa no hepática cuando hacemos referencia a enfermedades por defectos en el ciclo de la urea, acidurias orgánicas, por medicamentos, shunts portosistémicos, derivaciones urinarias, infección urinaria, hematológicas, nutrición parenteral, muscular e idiopática.2
Los mecanismos a través de los cuales se produce la hiperamoniemia son: falta de capacidad para metabolizar la carga normal de nitrógeno, saturación de la capacidad de formación de urea hepática, pasaje directo a la circulación sistémica por medio de un cortocircuito portosistémico o a través del sistema venoso directamente.2
Cuando los aminoácidos se metabolizan el grupo amino (NH2) y el grupo carboxilo (COOH) se separan y este último se oxida para obtener dióxido de carbono (CO2) y agua (H2O). Los grupos alfa-amino de los 20 aminoácidos que se encuentran normalmente en las proteínas se eliminan durante la degradación oxidativa de los aminoácidos. Si no se utilizan para la síntesis de nuevos aminoácidos u otros productos nitrogenados, estos grupos amino se canalizan mediante la formación del amonio hacia un único producto excretorio final, la urea.3
Lo primero que suceden son las reacciones de transaminación donde se transfiere un grupo alfa-amino al carbono alfa del alfa-cetoglutarato, dando como resultado glutamato (alfa-cetoglutarato más NH2) y un alfa-cetoácido. El glutamato, que es fundamental para el metabolismo de los grupos amino intracelulares, es sustituido por la L-glutamina para funcionar como transporte. La glutamina es un compuesto neutro, que atraviesa fácilmente membranas celulares.3
El grupo amino da lugar al amonio, que se transforma en urea en el hígado. Esto ocurre normalmente luego de la ingestión de proteínas de la dieta o durante el catabolismo exacerbado (fiebre, ayuno, desnutrición, infecciones, estrés) de proteínas endógenas.1
El ciclo de la urea es el principal mecanismo de detoxificación del amonio; se lleva a cabo en el hígado y da lugar a la formación de urea, la cual se transporta desde la sangre hacia los riñones para su excreción en la orina.1
Caso clínico
Un paciente masculino de 2 años, con diagnóstico previo de riñón en herradura, ureterohidronefrosis derecha e hipospadia subcoronal; ano imperforado y fístula vesicorrectal corregida quirúrgicamente, presentó vómitos y fiebre de 24 horas de evolución, la madre le había administrado metoclopramida como antihemético. Por persistencia del cuadro clínico, la madre realiza una consulta en la guardia del Hospital Garrahan. En ese momento, el paciente presenta una convulsión tónica generalizada, que cede con la administración de 20 mg/kg de fenobarbital. Posteriormente, el paciente presenta alteración de la conciencia (Glasgow 7/15), requiere asistencia respiratoria mecánica e ingresa en la Unidad de Cuidados Intensivos. Se le realiza una tomografía axial computarizada (TAC) de cerebro, que resulta normal. En primer lugar, los médicos tratantes sospechan que el paciente presenta una intoxicación por metoclopramida, le administran difenhidramina y para descartar una causa infecciosa se le toma una muestra para realizar un análisis de sangre y orina, urocultivo, hemocultivos y cultivo de líquido cefalorraquídeo (LCR) y se lo medica empíricamente con ceftriaxona.
El laboratorio informa que se ha hallado hiperleucocitosis con predominio de polimorfonucleares (34 230 leucocitos; 88% neutrófilos), y amonio 465 mg/dl (valor normal de 20 a 120 mg/dl), bilirrubina total < 0.3 mg/dl, bilirrubina directa < 0.2 mg/dl, GOT 24 UI/l, GPT 11 UI/l, FAL 202 UI/l, TP 98%, KPTT 30 segundos, y en el examen orina se encuentran abundantes leucocitos y piocitos. En LCR, glutamina 124.6 Umol/dl (valor normal: 36.3-78.5 Umol/dl).
Se asume el cuadro clínico como encefalopatía por hiperamoniemia. La conducta médica fue hacer ayunar al paciente, colocar un plan de hidratación parenteral con flujo de glucosa de 8 mg/kg/min, realizar un enema con lactulosa y tratamiento con un detoxificante de amonio, benzoato de sodio a 250 mg/kg/dosis (recibió una sola dosis).
El urocultivo resultó positivo para Corynebacterium riegelii, sensible a betalactámicos (piperacilina-tazobactam), y los cultivos restantes no demostraron crecimiento de ningún germen.
Se coloca un catéter Foley y se elimina una gran cantidad de orina.
El paciente respondió satisfactoriamente al tratamiento (Glasgow 15/15), se extubó a las pocas horas de su admisión y el nivel de amonio en sangre disminuyó a 94 mg/dl.
Fue dado de alta diez días más tarde, luego de haber completado el tratamiento antibiótico intravenoso.
El niño presenta antecedente de infecciones urinarias a repetición, con identificación de germen, Escherichia coli, por lo que se encuentra con tratamiento antibiótico profiláctico (cefalexina 15 mg/kg/día).
Presenta un desarrollo madurativo y pondoestatural acorde para la edad, con peso Pz -0.67; talla Pz 0.8, y P/T 86.53%.
Discusión
Como podemos observar se trata de un cuadro de encefalopatía asociado con hiperamoniemia. Los médicos tratantes, luego de haber descartado que se tratara de una intoxicación por metoclopramida, sospecharon que el cuadro era debido a una causa infecciosa. Por este motivo, luego de realizar TAC de cerebro para descartar edema cerebral, se le realizó punción lumbar. El resultado de los niveles aumentados de amonio se obtuvo luego de llevar a cabo la punción lumbar. Cabe destacar que si se hubiera constatado hiperamoniemia al inicio, la punción lumbar está contraindicada.4
Luego de estos resultados se interpretó el cuadro como encefalopatía por hiperamonemia sin hepatopatía, por infección urinaria y retención urinaria.
Los datos que apoyan esta afirmación son los valores elevados de amonio en plasma y de glutamina en LCR (estudio realizado posteriormente, con una muestra de LCR que había sido reservada), debido a hiperamoniemia, lo que condujo a encefalopatía, causa de la alteración del sensorio y la convulsión. El amonio atraviesa la barrera hematoencefálica y mediante la glutamina sintetasa se transforma en glutamina. Por lo tanto, al hallar la glutamina aumentada en LCR demuestra que el tóxico principal, causa de la encefalopatía, fue el amonio.
Se trata de un paciente que presenta una malformación renal, caracterizada por ureterohidronefrosis, con antecedentes de distintas cirugías debido a malformación anorrectal, cirugías complejas con prolongados períodos posoperatorios; se alimenta con una dieta variada, acorde para su edad. Por lo tanto, al presentar anatomía ureterorrenal favorable a la colonización bacteriana; tolerancia al estrés que produce una cirugía sin medidas de prevención para evitar catabolismo y que no presentó aversiones alimentarias, se descarta trastorno del ciclo de la urea. Además, no se detectó compromiso hepático en el hepatograma o en la función hepática, evidenciado por coagulograma normal.
El mecanismo propuesto es la posible formación de amonio por un germen productor de ureasa, puesto de manifiesto por el urocultivo. Se comprobó también la presencia de residuo posmiccional importante, dato que avala la retención urinaria, que en este paciente con malformación del tracto urinario favorece la difusión del amonio.
Por otra parte, el paciente recuperó el nivel de conciencia una vez cateterizada la vía urinaria e instaurado el tratamiento antibiótico.
En la orina, el amonio existe como ion amonio (NH4) o como base libre, amoníaco (NH3). En medio alcalino el amonio se transforma en amoníaco que es soluble en lípidos y es permeable en todas las membranas celulares. La dirección de difusión es determinada por el gradiente existente de presiones de la base libre a través de la membrana celular, que a su vez es una función del pH y la concentración total de amonio en cada lado de la membrana.6
A medida que el amoníaco se difunde, se convierte en amonio, que no puede atravesar la membrana celular, esto sucede en proporción a la concentración de ion hidrógeno (H) del medio; a este proceso se lo llama “trampa de difusión”.6
Este mecanismo potencia la reabsorción a la circulación perivesical y periureteral del amoníaco producido en el tracto urinario dilatado del paciente, donde el pH es alcalino. Esto da como resultado una elevación significativa de amonio en sangre, ya que la mayor parte de la sangre venosa de los uréteres y la vejiga alcanza la circulación periférica y no pasa por el hígado.6
El amoníaco también se produce dentro de la célula tubular renal, en circunstancias normales el 75% difunde a la luz del túbulo, en orina con pH ácido, y el resto difunde a través de capilares peritubulares. Pero cuando el pH de la orina es alcalino, el amoníaco no se puede excretar a la orina y todo el producido por las células tubulares pasa a los capilares peritubulares.6
En la infección del tracto urinario por Corynebacterium riegelii se produce alcalinización de la orina, por hidrólisis de urea en amoníaco por la ureasa bacteriana y, cuando existe una dilatación del tracto urinario, como se observa en este paciente, se producen grandes cantidades de amoníaco. Este microorganismo fue identificado por Funke y colaboradores, en 1998. Fue aislado de mujeres con infecciones del tracto urinario. Se trata de una bacteria no lipófila, débilmente fermentativa y anaerobia facultativa. A semejanza de Corynebacterium urealyticum, muestra una gran actividad ureasa. Es sensible a las cefalosporinas, la gentamicina, fluoroquinolonas, rifampicina y tetraciclinas.7-9
Existen también otras bacterias productoras de ureasa, como Proteus mirabilis, Klebsiella spp., Morganella morganii y Pseudomonas aeruginosa.10,11
Cabe destacar que la hiperamoniemia se puede producir en ausencia de un germen productor de ureasa, en caso de retención de orina por malformación del tracto urinario.12,13
La encefalopatía se produce porque el amonio atraviesa la barrera hematoencefálica rápidamente y se incorpora a la glutamina mediante la enzima glutamina sintetasa, que se localiza principalmente en los astrocitos cerebrales. El exceso de amonio incrementa el contenido de glutamina y aumenta la actividad de la glutamina sintetasa, lo que conduce a aumentar el volumen de astrocitos y a producir edema cerebral citotóxico (Figura 1).14
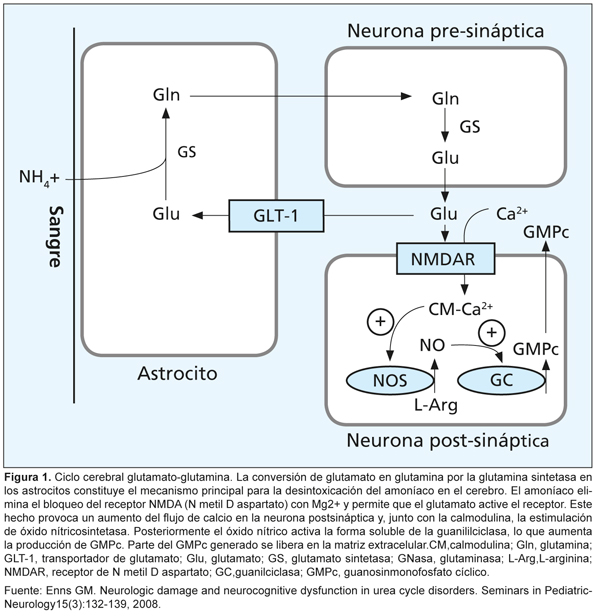
La intoxicación con amonio induce una activación excesiva de los receptores NMDA (N-metil-D-Aspartato) en el cerebro, lo cual incrementa la formación de óxido nítrico. Esta sobreactivación de los receptores NMDA precipita las rutas neurotóxicas que desembocan en degeneración neuronal y muerte celular. La hiperamonemia también activa la calcineurina fosfatasa, que desfosforila la Na/K ATPasa, aumentando el consumo de ATP cerca de 80%, lo que produce déficit energético cerebral.6
En otro orden, la hiperamoniemia reduce la actividad de las enzimas antioxidantes cerebrales (glutatión peroxidasa, superóxido dismutasa, y catalasa), lo cual incrementa la formación de radicales libres en las mitocondrias cerebrales induciendo estrés oxidativo.6
Si bien entre los errores congénitos del metabolismo la hiperamoniemia se asocia con trastorno del ciclo de la urea, en todos los pacientes se debe evaluar la técnica de toma de la muestra, el tiempo transcurrido desde la toma de la muestra hasta el procesamiento y las condiciones de traslado, antes de evaluar otra etiología, para hacer un diagnóstico adecuado.15
Este caso sugiere que los pacientes con vía urinaria dilatada e infectada por un microorganismo productor de ureasa tienen riesgo de presentar hiperamoniemia, situación que puede resolverse con la administración adecuada de antibióticos y desobstrucción del tracto urinario.16
Existen pocos artículos que traten sobre encefalopatía por hiperamonemia secundaria a una infección urinaria,9-13,15 y solo existe un caso de pediatría publicado en la literatura.6
La hiperamoniemia es la acumulación de amonio (NH4) en sangre, debido a un desequilibrio entre su producción y su eliminación. El amonio se produce en diversos tejidos del cuerpo, como el músculo estriado, riñones y cerebro; sin embargo, la mayor parte proviene de la degradación de los aminoácidos y otras sustancias nitrogenadas en el tubo digestivo.1
La hiperamonemia se puede clasificar, según su causa, en hepática y no hepática. Se trata de hiperamonemia de causa hepática cuando hablamos de una enfermedad hepática descompensada. Y de causa no hepática cuando hacemos referencia a enfermedades por defectos en el ciclo de la urea, acidurias orgánicas, por medicamentos, shunts portosistémicos, derivaciones urinarias, infección urinaria, hematológicas, nutrición parenteral, muscular e idiopática.2
Los mecanismos a través de los cuales se produce la hiperamoniemia son: falta de capacidad para metabolizar la carga normal de nitrógeno, saturación de la capacidad de formación de urea hepática, pasaje directo a la circulación sistémica por medio de un cortocircuito portosistémico o a través del sistema venoso directamente.2
Cuando los aminoácidos se metabolizan el grupo amino (NH2) y el grupo carboxilo (COOH) se separan y este último se oxida para obtener dióxido de carbono (CO2) y agua (H2O). Los grupos alfa-amino de los 20 aminoácidos que se encuentran normalmente en las proteínas se eliminan durante la degradación oxidativa de los aminoácidos. Si no se utilizan para la síntesis de nuevos aminoácidos u otros productos nitrogenados, estos grupos amino se canalizan mediante la formación del amonio hacia un único producto excretorio final, la urea.3
Lo primero que suceden son las reacciones de transaminación donde se transfiere un grupo alfa-amino al carbono alfa del alfa-cetoglutarato, dando como resultado glutamato (alfa-cetoglutarato más NH2) y un alfa-cetoácido. El glutamato, que es fundamental para el metabolismo de los grupos amino intracelulares, es sustituido por la L-glutamina para funcionar como transporte. La glutamina es un compuesto neutro, que atraviesa fácilmente membranas celulares.3
El grupo amino da lugar al amonio, que se transforma en urea en el hígado. Esto ocurre normalmente luego de la ingestión de proteínas de la dieta o durante el catabolismo exacerbado (fiebre, ayuno, desnutrición, infecciones, estrés) de proteínas endógenas.1
El ciclo de la urea es el principal mecanismo de detoxificación del amonio; se lleva a cabo en el hígado y da lugar a la formación de urea, la cual se transporta desde la sangre hacia los riñones para su excreción en la orina.1
Caso clínico
Un paciente masculino de 2 años, con diagnóstico previo de riñón en herradura, ureterohidronefrosis derecha e hipospadia subcoronal; ano imperforado y fístula vesicorrectal corregida quirúrgicamente, presentó vómitos y fiebre de 24 horas de evolución, la madre le había administrado metoclopramida como antihemético. Por persistencia del cuadro clínico, la madre realiza una consulta en la guardia del Hospital Garrahan. En ese momento, el paciente presenta una convulsión tónica generalizada, que cede con la administración de 20 mg/kg de fenobarbital. Posteriormente, el paciente presenta alteración de la conciencia (Glasgow 7/15), requiere asistencia respiratoria mecánica e ingresa en la Unidad de Cuidados Intensivos. Se le realiza una tomografía axial computarizada (TAC) de cerebro, que resulta normal. En primer lugar, los médicos tratantes sospechan que el paciente presenta una intoxicación por metoclopramida, le administran difenhidramina y para descartar una causa infecciosa se le toma una muestra para realizar un análisis de sangre y orina, urocultivo, hemocultivos y cultivo de líquido cefalorraquídeo (LCR) y se lo medica empíricamente con ceftriaxona.
El laboratorio informa que se ha hallado hiperleucocitosis con predominio de polimorfonucleares (34 230 leucocitos; 88% neutrófilos), y amonio 465 mg/dl (valor normal de 20 a 120 mg/dl), bilirrubina total < 0.3 mg/dl, bilirrubina directa < 0.2 mg/dl, GOT 24 UI/l, GPT 11 UI/l, FAL 202 UI/l, TP 98%, KPTT 30 segundos, y en el examen orina se encuentran abundantes leucocitos y piocitos. En LCR, glutamina 124.6 Umol/dl (valor normal: 36.3-78.5 Umol/dl).
Se asume el cuadro clínico como encefalopatía por hiperamoniemia. La conducta médica fue hacer ayunar al paciente, colocar un plan de hidratación parenteral con flujo de glucosa de 8 mg/kg/min, realizar un enema con lactulosa y tratamiento con un detoxificante de amonio, benzoato de sodio a 250 mg/kg/dosis (recibió una sola dosis).
El urocultivo resultó positivo para Corynebacterium riegelii, sensible a betalactámicos (piperacilina-tazobactam), y los cultivos restantes no demostraron crecimiento de ningún germen.
Se coloca un catéter Foley y se elimina una gran cantidad de orina.
El paciente respondió satisfactoriamente al tratamiento (Glasgow 15/15), se extubó a las pocas horas de su admisión y el nivel de amonio en sangre disminuyó a 94 mg/dl.
Fue dado de alta diez días más tarde, luego de haber completado el tratamiento antibiótico intravenoso.
El niño presenta antecedente de infecciones urinarias a repetición, con identificación de germen, Escherichia coli, por lo que se encuentra con tratamiento antibiótico profiláctico (cefalexina 15 mg/kg/día).
Presenta un desarrollo madurativo y pondoestatural acorde para la edad, con peso Pz -0.67; talla Pz 0.8, y P/T 86.53%.
Discusión
Como podemos observar se trata de un cuadro de encefalopatía asociado con hiperamoniemia. Los médicos tratantes, luego de haber descartado que se tratara de una intoxicación por metoclopramida, sospecharon que el cuadro era debido a una causa infecciosa. Por este motivo, luego de realizar TAC de cerebro para descartar edema cerebral, se le realizó punción lumbar. El resultado de los niveles aumentados de amonio se obtuvo luego de llevar a cabo la punción lumbar. Cabe destacar que si se hubiera constatado hiperamoniemia al inicio, la punción lumbar está contraindicada.4
Luego de estos resultados se interpretó el cuadro como encefalopatía por hiperamonemia sin hepatopatía, por infección urinaria y retención urinaria.
Los datos que apoyan esta afirmación son los valores elevados de amonio en plasma y de glutamina en LCR (estudio realizado posteriormente, con una muestra de LCR que había sido reservada), debido a hiperamoniemia, lo que condujo a encefalopatía, causa de la alteración del sensorio y la convulsión. El amonio atraviesa la barrera hematoencefálica y mediante la glutamina sintetasa se transforma en glutamina. Por lo tanto, al hallar la glutamina aumentada en LCR demuestra que el tóxico principal, causa de la encefalopatía, fue el amonio.
Se trata de un paciente que presenta una malformación renal, caracterizada por ureterohidronefrosis, con antecedentes de distintas cirugías debido a malformación anorrectal, cirugías complejas con prolongados períodos posoperatorios; se alimenta con una dieta variada, acorde para su edad. Por lo tanto, al presentar anatomía ureterorrenal favorable a la colonización bacteriana; tolerancia al estrés que produce una cirugía sin medidas de prevención para evitar catabolismo y que no presentó aversiones alimentarias, se descarta trastorno del ciclo de la urea. Además, no se detectó compromiso hepático en el hepatograma o en la función hepática, evidenciado por coagulograma normal.
El mecanismo propuesto es la posible formación de amonio por un germen productor de ureasa, puesto de manifiesto por el urocultivo. Se comprobó también la presencia de residuo posmiccional importante, dato que avala la retención urinaria, que en este paciente con malformación del tracto urinario favorece la difusión del amonio.
Por otra parte, el paciente recuperó el nivel de conciencia una vez cateterizada la vía urinaria e instaurado el tratamiento antibiótico.
En la orina, el amonio existe como ion amonio (NH4) o como base libre, amoníaco (NH3). En medio alcalino el amonio se transforma en amoníaco que es soluble en lípidos y es permeable en todas las membranas celulares. La dirección de difusión es determinada por el gradiente existente de presiones de la base libre a través de la membrana celular, que a su vez es una función del pH y la concentración total de amonio en cada lado de la membrana.6
A medida que el amoníaco se difunde, se convierte en amonio, que no puede atravesar la membrana celular, esto sucede en proporción a la concentración de ion hidrógeno (H) del medio; a este proceso se lo llama “trampa de difusión”.6
Este mecanismo potencia la reabsorción a la circulación perivesical y periureteral del amoníaco producido en el tracto urinario dilatado del paciente, donde el pH es alcalino. Esto da como resultado una elevación significativa de amonio en sangre, ya que la mayor parte de la sangre venosa de los uréteres y la vejiga alcanza la circulación periférica y no pasa por el hígado.6
El amoníaco también se produce dentro de la célula tubular renal, en circunstancias normales el 75% difunde a la luz del túbulo, en orina con pH ácido, y el resto difunde a través de capilares peritubulares. Pero cuando el pH de la orina es alcalino, el amoníaco no se puede excretar a la orina y todo el producido por las células tubulares pasa a los capilares peritubulares.6
En la infección del tracto urinario por Corynebacterium riegelii se produce alcalinización de la orina, por hidrólisis de urea en amoníaco por la ureasa bacteriana y, cuando existe una dilatación del tracto urinario, como se observa en este paciente, se producen grandes cantidades de amoníaco. Este microorganismo fue identificado por Funke y colaboradores, en 1998. Fue aislado de mujeres con infecciones del tracto urinario. Se trata de una bacteria no lipófila, débilmente fermentativa y anaerobia facultativa. A semejanza de Corynebacterium urealyticum, muestra una gran actividad ureasa. Es sensible a las cefalosporinas, la gentamicina, fluoroquinolonas, rifampicina y tetraciclinas.7-9
Existen también otras bacterias productoras de ureasa, como Proteus mirabilis, Klebsiella spp., Morganella morganii y Pseudomonas aeruginosa.10,11
Cabe destacar que la hiperamoniemia se puede producir en ausencia de un germen productor de ureasa, en caso de retención de orina por malformación del tracto urinario.12,13
La encefalopatía se produce porque el amonio atraviesa la barrera hematoencefálica rápidamente y se incorpora a la glutamina mediante la enzima glutamina sintetasa, que se localiza principalmente en los astrocitos cerebrales. El exceso de amonio incrementa el contenido de glutamina y aumenta la actividad de la glutamina sintetasa, lo que conduce a aumentar el volumen de astrocitos y a producir edema cerebral citotóxico (Figura 1).14

La intoxicación con amonio induce una activación excesiva de los receptores NMDA (N-metil-D-Aspartato) en el cerebro, lo cual incrementa la formación de óxido nítrico. Esta sobreactivación de los receptores NMDA precipita las rutas neurotóxicas que desembocan en degeneración neuronal y muerte celular. La hiperamonemia también activa la calcineurina fosfatasa, que desfosforila la Na/K ATPasa, aumentando el consumo de ATP cerca de 80%, lo que produce déficit energético cerebral.6
En otro orden, la hiperamoniemia reduce la actividad de las enzimas antioxidantes cerebrales (glutatión peroxidasa, superóxido dismutasa, y catalasa), lo cual incrementa la formación de radicales libres en las mitocondrias cerebrales induciendo estrés oxidativo.6
Si bien entre los errores congénitos del metabolismo la hiperamoniemia se asocia con trastorno del ciclo de la urea, en todos los pacientes se debe evaluar la técnica de toma de la muestra, el tiempo transcurrido desde la toma de la muestra hasta el procesamiento y las condiciones de traslado, antes de evaluar otra etiología, para hacer un diagnóstico adecuado.15
Este caso sugiere que los pacientes con vía urinaria dilatada e infectada por un microorganismo productor de ureasa tienen riesgo de presentar hiperamoniemia, situación que puede resolverse con la administración adecuada de antibióticos y desobstrucción del tracto urinario.16
Existen pocos artículos que traten sobre encefalopatía por hiperamonemia secundaria a una infección urinaria,9-13,15 y solo existe un caso de pediatría publicado en la literatura.6
Mariana Vanesa Leguizamón, C1249ABN, Ciudad de Buenos Aire, Argentina,
e-mail: marianaleguizamon84@gmail.com
1. Arnold Almaraz K, Olivares Sandoval Z, Revilla Estivill NF, Ibarra González I, Belmont Martínez L, Vela Amieva M. Tratamiento de la hiperamonemia en pediatría. Acta Pediatr Mex 26(6):313-324, 2005.
2. Brusilow SW, Horwich AL. Urea cycle enzymes. En: Scriver C, Beaudet A, Sly W, Valle D, et al. The metabolic and molecular bases of inherited disease. 8th ed. New York: McGraw-Hill; 2001.
3. Lehninger AL. Principios de bioquímica. 2da edición. España: Editorial Omega; 1995. Pp. 1296.
4. Verdú A, Cazorla MR. Punción lumbar y medición de presión del líquido cefalorraquídeo. An Pediatr Contin 2:45-50, 2004.
5. Summar M, Tuchman M. Proceedings of a consensus conference for the management of patients with urea cycle disorders. Suplement to The Journal Pediatrics 138(1):6-10, 2001.
6. Samtoy B, DeBeukelaer M, from the Department of Pediatrics, Medical University of South Carolina, Charleston. Ammonia encephalopathy secondary to urinary tract infection with Proteus mirabilis. Pediatrics 65(2): 294-297, 1980.
7. Jiménez Pérez M, Ibarra González I, Fernández Lainez C, Ruiz García M, Vela Amieva M. Hiperamonemia en la edad pediátrica. Estudio de 72 casos. Acta Pediatr Mex 34:268-274, 2013.
8. Mandell G, Bennet J, Dolin R. Enfermedades infecciosas, principios y práctica. 7a Edición. España: Elsevier; 2012. Pp. 2705.
9. Albersen M, Joniau S, Van Poppel H, Cuyle PJ, Knockaert DC, Meersseman W. Urea-splitting urinary tract infection contributing to hyperammonemic encephalopathy. Nat Clin Pract Urol 4(8):455-458, 2007.
10. Funke G, Lawson PA, Collins MD. Corynebacterium riegelii sp. nov., an unusual species isolated from female patients with urinary tract infections. J Clin Microbiol 36(3):624-627, 1998.
11. De Jonghe B, Janier V, Abderrahim N, Hillion D, Lacherade JC, Outin H. Urinary tract infection and coma. The Lancet 360 (9338):996, 2002.
12. Miyauchi R, Matsuda Y, Tokuda Y. Urinary tract infection as a cause of hyperammonemic encephalopathy. General Medicine 16(2):95-98, 2015.
13. Cordano C, Traverso E, Calabró V, Borzone C, Stara S, Marchese R, et al. Recurring hyperammonemic encephalopathy induced by bacteria usually not producing urease. BMC Res Notes 7:324, 2014.
14. Enns GM. Neurologic damage and neurocognitive dysfunction in urea cycle disorders. Semin Pediatr Neurol 15(3):132-139, 2008.
15. López LG, Pons MR, Visus FS, Serra JD, Pardo MM. Manejo de las alteraciones del metabolismo de los aminoácidos. En: Protocolos de gastroenterología, hepatología y nutrición. 2a ed. Ed. Ergon; 2010. Pp. 365-370.
16. Kenzaka T, Kato K, Kitao A, Kosami K, Minami K, Yahata S, et al. Hyperammonemia in urinary tract infections. PlosOne doi:10.1371/journal.pone.0136220 August 20, 2015. Disponible en http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0136220.
Está expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC.
ua91218





























