Bibliografía del artículo
Bibliografía del artículo
1. Lung B, Baron G, Vahanian A, et al. A prospective survey of patients with valvular heart disease in Europe: The Euro Heart Survey on Valvular Heart Disease. Eur Heart J 24: 1231-1243, 2003.
2. Stewart DF, Siscovick D,Otto CM, et al. Clinical factors associated with calcific aortic valve disease. Cardiovascular Health Study. J Am Coll Cardiol 29:630-634, 1997.
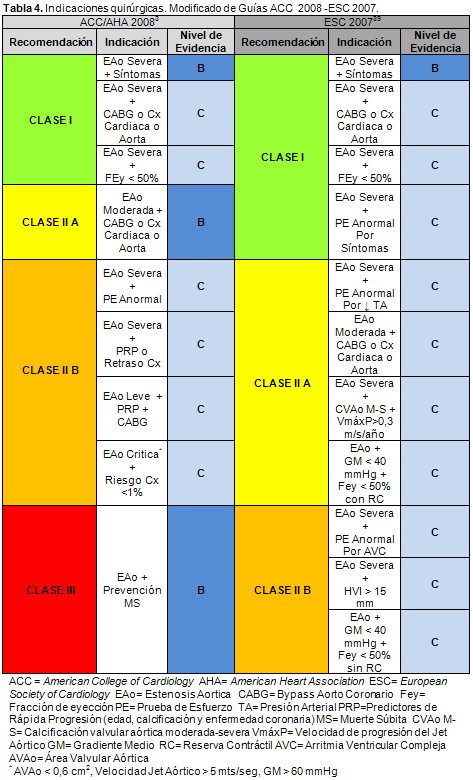
3. Nishimura RA, Carabello RA, Faxon DP, Freed MD, et al. 2008 Focused Update Incorporated Into the ACC/AHA 2006 Guidelines for the Management of Patients With Valvular Heart Disease. J Am Coll Cardiol 52:e1-142, 2008.
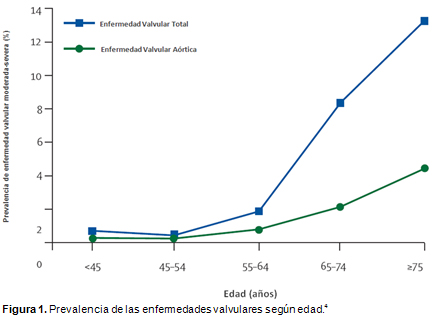
4. Nkomo VT, Gardin JM, Enriquez-Sarano M, et al. Burden of valvular heart diseases: a population-based study. Lancet 368: 1005-11, 2006.
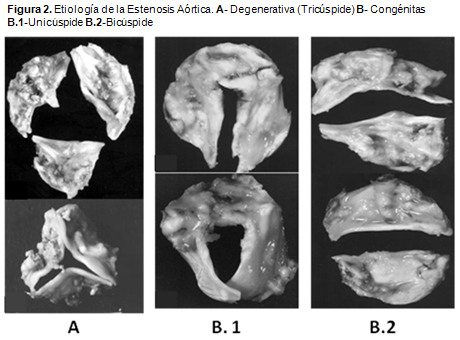
5. Otto CM, Kuusisto J, Reichenbach DD, Gown AM, O'Brien KD. Characterization of the early lesion of 'degenerative' valvular aortic stenosis: histological and immunohistochemical studies. Circulation 90:844-53, 1994.
6. Jashari R, Van Hoeck B, Goffin Y, Vanderkelen A. The incidence of congenital bicuspid or bileaflet and quadricuspid or quadrileaflet arterial valves in 3,861 donor hearts in the European Homograft Bank. J Heart Valve Dis 18:337-44, 2009.
7. World Heart Federation. Disponible en www.world-heart-federation.org/cardiovascular-health/global-facts-map/.
8. Rizvi SF, Khan MA, Kundi A, Marsh DR, Samad A, Pasha O. Status of rheumatic heart disease in rural Pakistan. Heart 90:394-9, 2004.
9. Villavicencio M, Turner E, Naranjo L. Resultados del reemplazo valvular aórtico con prótesis mecánica en el Instituto Nacional del Tórax. Rev Méd Chile 133:1161-1172, 2005.
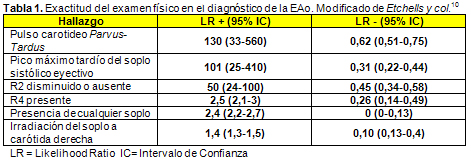
10. Etchells E, Bell C, Kenneth R. Does this patient have an abnormal systolic murmur? JAMA 277:564-571, 1997.
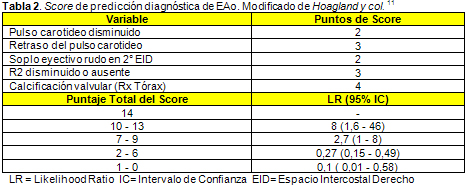
11. Hoagland PM, Cook EF, Wynne J, Goldman L. Value of noninvasive testing in adults with suspected aortic stenosis. Am J Med 80:1041-1050, 1986.
12. Shah RG, Novaro GM, Blandon RJ, Whiteman MS, Asher CR, Kirsch J. Aortic valve area: meta-analysis of diagnostic performance of multi-detector computed tomography for aortic valve area measurements as compared to transthoracic echocardiography. Int J Cardiovasc Imaging 25:601-9, 2009.
13. Lancellotti P, Moonen M, Magne J, O'Connor K, Cosyns B, Attena E, Donal E, Pierard L. Prognostic effect of long-axis left ventricular dysfunction and B-type natriuretic peptide levels in asymptomatic aortic stenosis. Am J Cardiol 105:383-8, 2010.
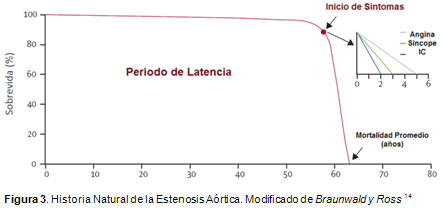
14. Ross J Jr, Braunwald E. Aortic stenosis. Circulation 38:61-67, 1968.
15. Horstkotte D, Loogen F. The natural history of aortic valve stenosis. Eur Heart J 9:57-64, 1988.
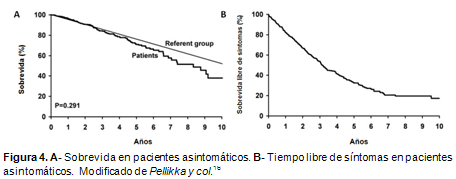
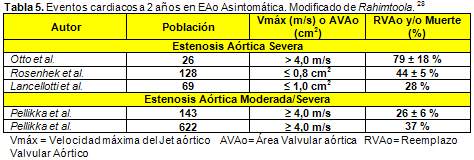
16. Pellikka PA, Sarano ME, Nishimura RA, et al. Outcome of 622 adults with asymptomatic, hemodynamically signifi cant aortic stenosis during prolonged follow-up. Circulation 111:3290-95, 2005.
17. Carabello B, Paulus W. Aortic stenosis. Lancet 373:956-66, 2009.
18. Pellikka P, Nishimura R, Bailey K, Tajik A. The natural history of adults with asymptomatic, hemodynamically significant aortic stenosis. J Am Coll Cardiol 15:1012-1017, 1990.
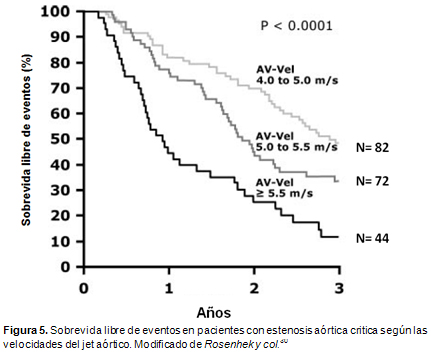
19. Rosenhek R, Binder T, Porenta G, Lang I, Christ G, Schemper M, Maurer G, Baumgartner H. Predictors of outcome in severe, asymptomatic aortic stenosis. N Engl J Med 343:611-617, 2000.
20. Otto CM, Pearlman AS, Gardner CL. Hemodynamic progression of aortic stenosis in adults assessed by Doppler echocardiography. J Am Coll Cardiol 13:545-50, 1989.
21. Roger VL, Tajik AJ, Bailey KR, Oh JK, Taylor CL, Seward JB. Progression of aortic stenosis in adults: new appraisal using Doppler echocardiography. Am Heart J 119:331-8, 1990.
22. Rosenhek R, Klaar U, Schemper M, et al. Mild and moderate aortic stenosis. Natural history and risk stratification by echocardiography. Eur Heart J 25:199 -205, 2004.
23. Cosmi JE, Kort S, Tunick PA, et al. The risk of the development of aortic stenosis in patients with benign aortic valve thickening. Arch Intern Med 162:2345-7, 2002.
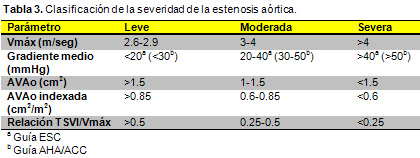
24. Vahanian A, Baumgartner H, Bax J, Butchart E, Dion R, Filippatos G et al. Guidelines on the management of valvular heart disease: The Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology. Eur Heart J 28:230-68, 2007.
25. Baumgartner H, Hung J, Bermejo J, Chambers J, Evangelista A, Griffin B et al. Echocardiographic Assessment of Valve Stenosis: EAE / ASE Recommendations for Clinical Practice. J Am Soc Echocardiogr 22:1-23, 2008.
26. Schwarz F, Baumann P, Manthey J, et al. The effect of aortic valve replacement on survival. Circulation 66:1105-10, 1982.
27. Amato MCM, Moffa PJ, Werner KE, Rahires JAF. Treatment decision in asymptomatic aortic valve stenosis: role of exercise testing. Heart 86:381-386, 2001.
28. Rahimtoola SH. Valvular heart disease: a perspective on the asymptomatic patient with severe valvular aortic stenosis. Eur Heart J 29:1783-1790, 2008.
29. Dal-Bianco JP, Khandheria BK, Sengupta P, et al. Managment of asymptomatic severe aortic stenosis. J Am Coll Cardiol 52:1279-92, 2008.
30. Rosenhek R, Zilberszac R, Schemper M, et al. Natural history of very severe aortic stenosis. Circulation 121:151-156, 2010.
31. Das P, Rimington H, Chambers J. Exercise testing to stratify risk in aortic stenosis. Eur Heart J 26:1309-13, 2005.
32. Rafique AM, Biner S, Forrester J, et al. Meta-Analysis of Prognostic Value of Stress Testing in Patients With Asymptomatic Severe Aortic Stenosis. Am J Cardiol 104:972-977, 2009.
33. Clavel MA, Fuchs C, Burwash IG, et al. Predictors of outcomes in low-flow, low-gradient aortic stenosis: results of the multicenter TOPAS Study. Circulation 118:S234-42, 2008.
34. Rossebø AB, Pedersen TR, Boman K, et al. SEAS Investigators. Intensive lipid lowering with simvastatin and ezetimibe in aortic stenosis. N Engl J Med 359:1343-56, 2008.
35. Chan KL, Teo K, Dumesnil JG, et al. ASTRONOMER Investigators. Effect of lipid lowering with rosuvastatin on progression of aortic stenosis: results of the aortic stenosis progression observation: measuring effects of rosuvastatin (ASTRONOMER) trial. Circulation 121:306-14, 2010.
36. Consenso de Valvulopatías - Actualización 2006. Rev Argent Cardiol 75:41-56, 2007.
37. Routledge HC, Townend JN. ACE inhibition in aortic stenosis: dangerous medicine or golden opportunity. J Hum Hypertens 15:659-67, 2001.
38. Nishimura RA, Carabello BA, Faxon DP, et al. ACC/AHA 2008 Guideline update on valvular heart disease: Focused update on infective endocarditis. J Am Coll Cardiol 52:676-685, 2008.
39. Guidelines on the prevention, diagnosis, and treatment of infective endocarditis (new version 2009).The Task Force on the Prevention, Diagnosis, and Treatment of Infective Endocarditis of the European Society of Cardiology (ESC). Eur Heart J 30:2369-2413, 2009.
40. Nashef SA, Roques F, Michel P, Gauducheau E, Lemeshow S, Salamon R. European system for cardiac operative risk evaluation (EuroSCORE). Eur J Cardiothorac Surg 16:9-13, 1999.
41. Roques F, Michel P, Goldstone AR, Nashef SA. The logistic EuroSCORE. Eur Heart J 24:882-3, 2003.Disponible en http://euroscore.org/calc.html.
42. O'Brien S, Shahian D, Anderson R, et al. The Society of Thoracic Surgeons 2008 Cardiac Surgery Risk Models: Part 2-Isolated Valve Surgery. Ann Thorac Surg 88:S23-42, 2009. Disponible en http://209.220.160.181/STSWebRiskCalc261/.
43. Parsonnet V, Dean D, Bernstein, AD. A method of uniform stratification of risk for evaluating the results of surgery in acquired adult heart disease. Circulation 701(Suppl):13-112, 1999.
44. Wendt D, Osswald BR, Kayser K, et al. Society of Thoracic Surgeons score is superior to the EuroSCORE determining mortality in high risk patients undergoing isolated aortic valve replacement. Ann Thora Surg 88:468-74, 2009.
45. Cannegieter SC, Rosendaal FR, Briet E. Thromboembolic and bleeding complications in patients with mechanical heart valve prostheses. Circulation 89:635-41, 1994.
46. Allín JG. Registros Internacionales. Principales resultados en Cirugía Cardíaca. Libro de Recuperación Cardiovascular CONAREC 2010 (en prensa).
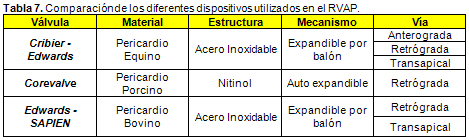
47. Cribier A, Savin T, Berland J, et al. Percutaneous transluminal balloon valvuloplasty of adult aortic stenosis: report of 92 cases. J Am Coll Cardiol 9:381-6, 1987.
48. McKay RG. The Mansfield Scientific Aortic Valvuloplasty Registry: overview of acute hemodynamic results and procedural complications. J Am Coll Cardiol 17:485-91, 1991.
49. Percutaneous balloon aortic valvuloplasty. Acute and 30-day follow-up results in 674 patients from the NHLBI Balloon Valvuloplasty Registry. Circulation 84:2383-2397, 1991.
50. Otto CM, Mickel MC, Kennedy JW, et al. Three-year outcome after balloon aortic valvuloplasty. Insights into prognosis of valvular aortic stenosis. Circulation 89:642-650, 1994.
51. Safian RD, Berman AD, Diver DJ, et al. Balloon aortic valvuloplasty in 170 consecutive patients. N Engl J Med 319:125-130, 1988.
52. Bonhoeffer P, Boudjemline Y, Saliba Z, et al. Percutaneous replacement of pulmonary valve in a right-ventricle to pulmonary-artery prosthetic conduit with valve dysfunction. Lancet 356:1403-5, 2000.
53. Cribier A, Eltchaninoff H, Bash A, et al. Percutaneous transcatheter implantation of an aortic valve prosthesis for calcific aortic stenosis: first human case description. Circulation 106:3006-8, 2002.
54. Cribier A, Eltchaninoff H, Tron C, et al. Treatment of calcific aortic stenosis with the percutaneous heart valve: mid-term follow-up from the initial feasibility studies: the French experience. J Am Coll Cardiol 47:1214-1223, 2006.
55. Walther T, Falk V, Kempfert J, et al. Transapical minimally invasive aortic valve implantation; the initial 50 patients. Eur J Cardiothorac Surg 33:983-988, 2008.
56. Piazza N, Grube E, Gerckens U, et al. Procedural and 30 días outcomes following transcatheter aortic valve implantation using the third generation (18Fr) CoreValve reValving System: results from the multicentre, expanded evaluation registry 1-year following CE mark approval. EuroIntervention 4:242-249, 2008.
57. Laborde JC. Transcatheter aortic valve implantation with the CoreValve ReValving Device. Paper presented at Transcatheter Cardiovascular Therapeutics, October 12, Washington, DC, 2008.
58. Transcatheter valve implantation for patients with aortic stenosis: a position statement from the European Association of Cardio-Thoracic Surgery (EACTS) and the European Society of Cardiology (ESC), in collaboration with the European Association of Percutaneous Cardiovascular Interventions (EAPCI) Eur Heart J 29:1463-70, 2008.
59. Zajarias A, Eltchaninoff H, Cribier A. Successful coronary intervention after percutaneous aortic valve replacement. Catheter Cardiovasc Interv 69:522-4, 2007.
60. Brabandt H, Neyt M. Safety of percutaneous aortic valve insertion. A systematic review. BMC Cardiovascular Disorders 9:45, 2009.




 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: