Bibliografía del artículo
Bibliografía del artículo
1. Nickenig G, Wassmann S, Böhm M. Regulation of the angiotensin AT1 receptor by hypercholesterolaemia. Diabetes Obes Metab 2:223-2228, 2000.
2. Tsikouris JP, Cox DC. Pharmacologic blockade of the renin angiotensin system: vascular benefits beyond commonly understood pharmacologic actions. Pharmacotherapy 23:1141-52, 2003.
3. Kon V, Jabs K. Angiotensin in atherosclerosis. Curr Opin Nephrol Hypertens 13:291-297, 2004.
4. Rajagopalan S, Kurz S, Münzel T y col. Angiotensin II-mediatedhypertension in the rat increases vascular superoxide production via membrane NADH/NADPH oxidase activation. J Clin Invest 97:1916-1923, 1996.
5. Menschikowski M, Hagelgans A, Siegert G. Secretory phospholipase A2 of group IIA: is it an offensive or a defensive player during atherosclerosis and other inflammatory diseases? Prostaglandins Other Lipid Mediat 79:1-33, 2006.
6. Luchtefeld M, Bandlow N, Tietge UJ y col. Angiotensin II type 1-receptor antagonism prevents type IIA secretory phospholipase A2-dependent lipid peroxidation. Atherosclerosis 194:62-70, 2007.
7. Divchev D, Schieffer B. The secretory phospholipase A2 group IIA: a missing link between inflammation, activated renin-angiotensin system, and atherogenesis? Vasc Health Risk Manag 4(3):597-604, 2008.
8. Velloso LA, Folli F, Sun XJ y col. Cross-talk between the insulin and angiotensin signaling systems. Proc Natl Acad Sci USA 93:12490-12495, 1996.
9. Griendling KK, Minieri CA, Ollerenshaw JD y cols Angiotensin II stimulates
NADH and NADPH oxidase activity in cultured vascular smooth muscle cells. Circ Res 74:1141-1148, 1994.
10. Schmidt AM, Yan SD, Wautier JL y col. Activation of receptor for advanced glycation end products: a mechanism for chronic vascular dysfunction in diabetic vasculopathy and atherosclerosis. Circ Res 84:489-497, 1999.
11. Furuhashi M, Ura N, Higashiura K y col. Blockade of the renin-angiotensin system increases adiponectin concentrations in patients with essential hypertension. Hypertension 42:76-81, 2003.
12. DiBona GF. Neural control of renal function: role of renal alpha adrenoceptors. J Cardiovasc Pharmacol 7(Suppl.8):S18-S23, 1985.
13. DiBona GF. Neural control of renal function: cardiovascular implications. Hypertension 13:539-548, 1989.
14. Hausberg M, Kosch M, Harmelink P et al. Sympathetic nerve activity in end-stage renal disease. Circulation 106:1974-1979, 2002.
15. Converse Jr RL, Jacobsen TN, Toto RD et al. Sympathetic overactivity in patients with chronic renal failure. N Engl J Med 327:1912-1918, 1992.
16. Klein IH, Ligtenberg G, Neumann J et al. Sympathetic nerve activity is inappropriately increased in chronic renal disease. J Am Soc Nephrol 14:3239-3244, 2003.
17. Desir GV. Regulation of blood pressure and cardiovascular function by renalase. Kidney International 76:366-370, 2009.
18. Guoyong L, Jianchao X, Peili W y col. Catecholamines regulate the activity, secretion, and synthesis of renalase. Circulation 117:1277-1282, 2008.
19. Jianchao X, Guoyong L, Peili W y col. Renalase is a novel, soluble monoamine oxidase that regulates cardiac function and blood pressure. The Journal of Clinical Investigation 115:1275-1280, 2005.
20. Wong ND, Hsu JC, Detrano RC y col. Coronary artery calcium evaluation by electron beam computed tomography and its relation to new cardiovascular events. Am J Cardiol 86:495-498, 2000.
21. Kramer H, Toto R, Peshock R y col. Association between chronic kidney disease and coronary artery calcification: the Dallas Heart Study. J Am Soc Nephrol 16:507-513, 2005.
22. Xiang W, Kong J, Chen S y col. Cardiac hypertrophy in vitamin D receptor knockout mice: role of the systemic and cardiac renin-angiotensin systems. Am J Physiol Endocrinol Metab 288:125-132, 2005.
23. Melamed ML, Michos ED, Post W, Astor B. 25-hydroxyvitamin D levels and the risk of mortality in the general population. Arch Int Med 168:1629-1637, 2008.
24. Gouni-Berthold I, Krone W, Berthold HK. Vitamin D and cardiovascular disease. Curr Vasc Pharmacol 7:414-422, 2009.
25. Swales JD, Thurston T. Plasma renin and angiotensin II measurement in hypertensiva and normal subjects: correlation of basal and stimulated states. J Clin Endocrinil Metab 45:159-163, 1977.
26. Taal MW, Brenner BM. Renoprotective benefits of RAS inhibition: from ACEI to angiotensin II antagonists. Kidney Int 57:1803-1817, 2000.
27. Yamamoto N, Yasue H, Mizuno Y y col. Aldosterone is produced from ventricles in patients with essential hypertension. Hypertension 39:958-962, 2002.
28. Dzau VJ. Theodore Cooper Lecture: Tissue angiotensin and pathobiology of vascular disease: a unifying hypothesis. Hypertension 37:1047-1052, 2001.
29. Vaughan DE. AT (1) receptor blockade and atherosclerosis: hopeful insights into vascular protection. Circulation 101:1496-1497, 2000.
30. Ruilope LM, Salvetti A, Jamerson K y col. Renal function and intensive lowering of blood pressure in hypertensive participants of the hypertension optimal treatment (HOT) study. J Am Soc Nephrol 12:218-225, 2001.
31. Mann JF, Gerstein HC, Pogue J, Bosch J, Yusuf S. Renal insufficiency as a predictor of cardiovascular outcomes and the impact of ramipril: the HOPE randomized trial. Ann Intern Med 134:629-636, 2001.
32. De Leeuw PW, Ruilope LM, Palmer CR y col. Clinical significance of renal function in hypertensive patients at high risk: results from the INSIGHT trial. Arch Intern Med 164:2459-2464, 2004.
33. Anavekar NS, McMurray JJ, Velazquez EJ y col. Relation between renal dysfunction and cardiovascular outcomes after myocardial infarction. N Engl J Med 351:1285-1295, 2004.
34. Go AS, Chertow GM, Fan D y col. Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization. N Engl J Med 351:1296-1305, 2004.
35. Diamond GA, Forrester JS. Analysis of probability as an aid in the clinical diagnosis of coronary-artery disease. N Engl J Med 300:1350-1358, 1979.
36. Brown WV. Risk factors for vascular disease in patients with diabetes. Diabetes Obes Metab 2(Suppl.2):S11-S18, 2000.
37. Yusuf S, Reddy S, Ounpuu S, Anand S. Global burden of cardiovascular diseases: part I: general considerations, the epidemiologic transition, risk factors, and impact of urbanization. Circulation 104:2746-2753, 2001.
38. Drouet L. Atherothrombosis as a systemic disease. Cerebrovasc Dis 13(Suppl.1):1-6, 2002.
39.Women's Health Study. Women's high CRP levels can predict hypertension. Healthcare Benchmarks Qual Improv 11:20-21, 2004.
40. Lakoski SG, Herrington DM, Siscovick DM y col. C-reactive protein concentration an incident hypertension in young adults. Arch Intern Med 166:345-349, 2006.
41. Piskorz D, Bonelli JM, Citta L, Citta N y col. Heart rate variability and left ventricle hypertrophy. J Hypertension 22(Suppl.1):154S, 2004.
42. Schroeder EB, Liao D, Chambless LE y col. Hypertension, blood pressure, and heart rate variability: the Atherosclerosis Risk in Communities (ARIC) study. Hypertension 42:1106-1111, 2003.
43. Zoccali C, Mallamaci F, Tripepi G y col. Norepinephrine and concentric hypertrophy in patients with end-stage renal disease. Hypertension 40:41-46, 2002.
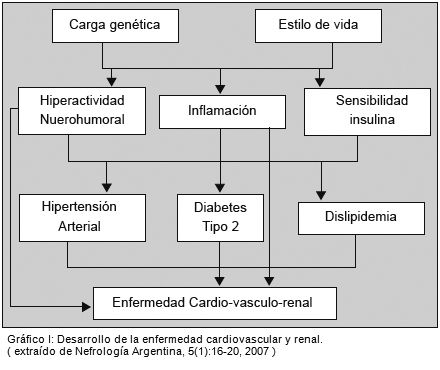
44. Piskorz D. Rol del riñón en el desarrollo de la cardiopatía isquémica. Nefrología Argentina 5:16-20, 2007.





 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: