Bibliografía del artículo
Bibliografía del artículo
1. Zhurbenko R, Rodríguez Martínez C. Bases nutritivas para el cultivo de los microorganismos: Parte 1 – Procesos tecnológicos. Salud(i)Ciencia 16(4):420-5, 2008.
2. Guadix A, Guadix EM, Páez-Dueñas MP, González-Tello P, Camacho F. Procesos tecnológicos y métodos de control en la hidrólisis de proteínas. Ars Pharmaceutica 41(1):79-89, 2000.
3. Parrado J, Millan F, Hernández Pinzo I, Bautista J, Machado A. Characterization of enzymatic sunflower protein hydrolysates. J Agric Food Chem 41(11):1821-5, 1993.
4. Kurbanoglu EB, Kurbanoglu NI. A new process for the utilization as peptone of ram horn waste. J Biosci Bioeng 94(3):202-6, 2002.
5. Zhurbenko R. Metodología para el aprovechamiento de los subproductos de la industria alimenticia y otras proteínas en la evaluación de la calidad sanitaria de los alimentos [Tesis doctoral]. Universidad de La Habana, La Habana, 2005.
6. Martone CB, Pérez Borla O, Sánchez JJ. Fishery by-product as a nutrient source for bacteria and archaea growth media. Bioresour Technol 96(3):383-7, 2005.
7. Bhaskar N, Modi VK, Govindaraju K, Radha C, Lalitha RG. Utilization of meat industry by products: protein hydrolysate from sheep visceral mass. Bioresour Technol 98(2):388-94, 2007.
8. Morris HJ, Almarales A, Carrillo O, Bermúdez RC. Utilization of Chlorella vulgaris cell biomasa for the production of enzymatic protein hydrolysates. Bioresour Technol 99(16):7723-9, 2008.
9. Boucaud-Maitre Y, Carraz M, Cloppet H. Peptone bacteriologique obteniu par digestion papainique de residus de placenta humain. Ann Pharm Fr 39(1):65-76, 1981.
10. Meat peptones, Hydrolysates and Extract. Organotechnie. France. [Citado el 12 de agosto del 2009]. Disponible en: http://www.organotechnie.com.meatpept.htm.
11. Pork Heart Infusion – A1504. Solabia. France. [Citado el 12 de agosto del 2009]. Disponible en: http://www.solabia.fr/solabia/content/NT00004442.pdf.
12. Barnes EM. Bacterial growth on heart digest media in relation to the trypsin preparation used. [Citado el 12 de agosto del 2009]. Disponible en: http://www3.interscience.wiley.com/cgi-bin/fulltext/119888887/PDFSTART.
13. Rodríguez C, Zhurbenko R, Barroetabeña F, Varela A. Utilization of beef heart for the obtainment of peptone for bacteriology. Proceedings of the International Congress of Meat Science and Technology, Ago-Sep 27-1; La Habana, Cuba, 1990.
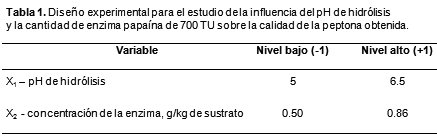
14. López Planes R. Diseño estadístico de experimentos. Coedición de la Universidad Autónoma de Yucatán y la Universidad de La Habana, pp. 1-50, 1994.
15. USP 27-NF-22. The United States Pharmacopeia. Twenty Seventh Revision. The National Formulary Twenty seventh edition en CD-ROM User Guide. Reagents. Pancreatic Digest of Casein [monografía en CD-ROM]. United Pharmacopoeial Convention, Inc. Rockville: Staff Liaison; 2004.
16. Morris Quevedo HJ, Almarales Arceo A, Romero Viamonte K, Vidal Colás M. Validación de un método potenciométrico para la determinación de nitrógeno amínico en hidrolizados proteicos de microalgas. Rev Cubana Farm 36(1):56-61, 2002.
17. Tecator. Determination of Kjeldahl nitrogen content with Kjeltec System 1026. Application Note, Sweden, 1987.
18. Runova VF, Bendas LG, Maksimova GA, Preobrazhenskaya EI, Raskin BM, Mielnikov VA. Mietodicheskie ukazania po primienieniyu fiziko-khimicheskikh mietodov kontrolia pitatielnikh sried. Moscú (URSS): Ministierstvo Zdravokhranienia SSSR, pp. 5-10, 1977.
19. Davies MG, Thomas AJ. An investigation of hydrolytic techniques for the amino acid analysis of foodstuffs. J Sci Food Agric 24:1525-40, 1973.
20. ISO 6490/1. International Standard. Animal feeding stuffs – Determination of magnesium content – Part 1: Atomic absorption spectrometric method. Geneva (Switzerland): ISO; 1985.
21. ISO 6490/2. International Standard. Animal feeding stuffs – Determination of calcium content – Part 2: Atomic absorption spectrometric method. Geneva (Switzerland): ISO; 1985.
22. Milner BA, Whiteside PJ. Introduction to atomic absorption spectrophotometry. scientific & analytical equipment. Philips. Third Edition. Pye Unicam Ltd., Reino Unido, pp. 38-9, 1984.
23. Standard Operating Procedure. No. 313. National Center For Toxicological Research Division of Chemistry, Analysis for Minerals in Animal Feed; 1994.
24. AOAC. Official Methods of Analysis. 16th Ed. Methode 27.1.54. Vol. II. Washington, D.C. (USA): Association of Official Analytical Chemists; 1995.
25. Sigma-Aldrich. Biochemiclas and Reagents for like Science Research. St. Louis: Sigma-Aldrich, p. 1534, 2000.
26. Rodríguez Martínez C, Zhurbenko R, Quesada Muñiz VJ, Lobaina Rodríguez T, Tsoraeva A, Díaz Pérez M, Durán Vila A, Varela Llanes AE. Manual de Medios de Cultivo. Tercera Edición. Habana (Cuba): ISBN 959-7160-25-0, BioCen, p. 265, 2004.
27. Sonnenwirth AC, Jarret L. Gradwohl métodos y diagnósticos del laboratorio clínico. Tomo 3. Habana (Cuba): Editorial Científico-Técnica, pp. 1233-7, 1983.
28. ISO 6887-1. Microbiology of food and animal feeding stuffs – Preparation of test samples, initial suspension and decimal dilutions for microbiological examination - Part 1: General rules for the preparation of the initial suspension and decimal dilutions. Geneva (Switzerland): ISO; 1999.
29. Camacho F, González-Tello P, Guadix EM. Influence of enzymes, ph and temperature on the kinetics of whey protein hydrolysis. Food Sci Techn Inter 4:79-84, 1998.
30. Constituents of the muscle fibers. Section from the book "Experimental Cookery From The Chemical And Physical Standpoint", by Belle Lowe. [Citado el 26 de agosto del 2009]. Disponible en: http://chestofbooks.com/food/science/Experimental-Cookery/Constituents-Of-The-Muscle-Fibers.html
31. bioMérieux. Bacteriology. France: bioMérieux; p. 13-5, 1983.
32. BBL. Manual of BBL products and laboratory procedures. USA: Becton Dickinson Microbiology Systems; 1988.
33. Organotechnie. Culture media constituentes. Ed. 1. France: La Courneuve; 1994.
34. Scharlau. Handbook of microbiological culture media. International Edition, 2000.
35. Constantino. Raw materials for the pharmaceutical industry. Torino (Italy): Società per L´Industria di Prodotti Biochimici; 1990.
36. Mourey Valdés L, Gurria Rafols M, Vidrio Sandre E, Bravo Brash J, Bañales MD. Manual de normas técnicas sanitarias de agentes de diagnóstico. Secretaría de Salud, Subsecretaría de regulación y fomento sanitario. México: Dirección General de Insumos para la Salud, 1990.
37. Panreac. Manual Básico de Microbiología. 3ra Edición. Cultimed, pp. II-1, III-1 – III-9, 2000.
38. Bridson, E. The development manufacture and control of microbiological culture media. Unipath Ltd., p. 181, 1994.
39. Oxoid. Manual. England: Unipath Limited, Basingstoke, Hampshire, RG24 OPW; pp. 277-91, 1995.
40. In vitro cultivation of micro-organisms. Butterworth-Heinemann Ltd. p. 28, 1992.
41. Columbia broth (7127). PI Rev NEW. [Citado el 12 de agosto del 2009]. Disponible en: http://www.jsunitech.com/product/culture/manual/Columbia%20Broth.pdf.
42. ISO/TS 11133-1. Microbiology of food and animal feeding stuffs - Guidelines on preparation and production of culture media - Part 1: General guidelines on quality assurance for the preparation of culture media in the laboratory. Geneva (Switzerland): ISO, 2000.




 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: Patrocinio y reconocimiento
Patrocinio y reconocimiento