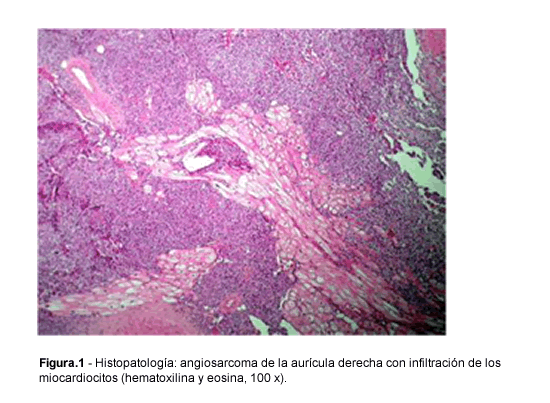
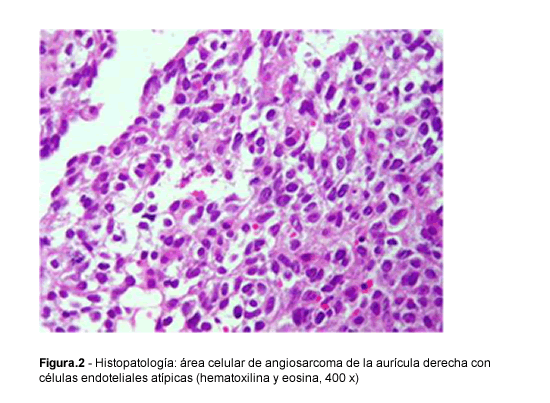
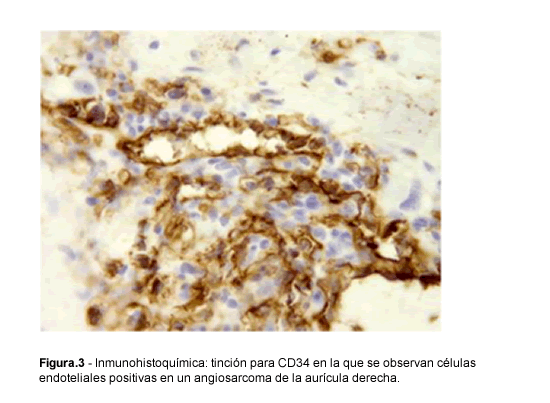
Bibliografía del artículo
Bibliografía del artículo
1. Sabatine MS, Colucci WS, Schoen FJ. Primary tumors of the heart. En: Zipes DP, Libby P, Bonow RO, Braunwald E, editores. Braunwald’s heart disease 7a ed. Filadelfia, EE.UU.: Elsevier Saunders; 2005. Pp. 1741-1755.
2. Silverman NA. Primary cardiac tumors. Ann Surg 191:127-138, 1980.
3. Rettmarr K, Stierle U, Sheikhzadeh A y col. Primary angiosarcoma of the heart. Report of a case and review of the literature. Jpn Heart J 34:667-683, 1993.
4. Burke AP, Cowan D, Virmani R. Primary sarcomas of the heart. Cancer 69:387-395, 1992.
5. Tazelaar HD, Locke TJ, Mc Gregor LG. Pathology of surgically excised primary cardiac tumors. Mayo Clin Proc 67:957-965, 1992.
6. Burke AP, Virmani R. Tumors and tumor-like conditions of the heart. En: Silver MD, Gottlieb AI, Schoen FJ, editores. Cardiovascular pathology. Filadelfia, EE.UU.: Churchill Livingstone; 2001. Pp. 583-565.
7. Putnam JB, Sweeny MS, Colon R, Lanza LA, Frazier OH, Cooley DA. Primary cardiac sarcomas. Ann Thor Surg 51:906-910, 1991.
8. Piazza N, Chughtai T, Toledano K y col. Primary cardiac tumors. Eighteen years of surgical experience on 21 patients. Can J Cardiol 20:1443-1448, 2004.
9. Dennig K, Lehmann G, Richter T. An angiosarcoma in the left atrium. N Engl J Med 342:443-444, 2000.
10. Gong Y, Hong T, Chen M, Huo Y. A right heart angiosarcoma with rapidly progressing hemorrhagic pericardial effusion. Intern Med 50:455-458, 2011.
11. Janigan DT, Husain A, Robinson NA. Cardiac angiosarcoma-a review and a case report. Cancer 57:852-859, 1986.
12. Fayete J, Martin E, Piperno-Neumann S y col. Angiosarcomas, a heterogenous group of sarcomas with specific behavior depending on primary site: a retrospective review of 161 cases. Ann Oncol 18:2030-2036, 2007.
13. Young RJ, Brown NJ, Reed MW, Hughes D, Woll PJ. Angiosarcoma. Lancet Oncol 4:66-74, 2011.
14. Crespo MG, Pulpon LA, Pradas G y col. Heart transplantation for cardiac angiosarcoma: should its indication be questioned? J Heart Lung Transplant 12:527-530, 1993.
15. Kurian KC, Weisshaar D, Parekh H, Berry GJ, Reitz B. Primary cardiac angiosarcoma: case report and review of the literature. Cardiovascular Pathology 15:110-112, 2006.
16. Donsbeck AV, Ranchere D, Coindre JM, Le Gall F, Cordier JF, Loire R. Primary cardiac sarcomas: an immunohistochemical and grading study with long-term follow-up of 24 cases. Histopathology 34:295-304, 1999.
17. Amonkar GP, Desanpande JR. Images in Cardiovascular Pathology-cardiac angiosarcoma. Cardiovascular Pathology 15:57-58, 2006.
18. Burke A, Virmani R. Tumors of the heart and great vessels. En: Atlas of tumor pathology. Washington DC, EE.UU.: Armed Forces Institute of Pathology; 1996. Pp. 136-140. (3rd series; fasc 16).
19. Adem C, Ambry MC, Tazeler HD, Meyers JL. Metastatic angiosarcoma masquerading as diffuse pulmonary hemorrhage. Arch Pathol Lab Med 125:1562-1565, 2001.
20. Zu Y, Perle MA, Yan Z, Liu J, Kumar A, Waisman J. Chromosomal abnormalities and p53 gene mutation in a cardiac angiosarcoma. Appl Immunohistochem Mol Morphol 9:24-28, 2001.
21. Naka M, Tomita Y, Nakanishi H, et al. Mutations of p53 tumor-supressor gene in angiosarcoma. Int J Cancer 71:952-955, 1997.
22. García JM, González R, Silva JM y col. Mutational status of K-ras and TP53 genes in primary sarcomas of the heart. Brit J Cancer 82:1183-1185, 2000.
23. Shanmugan G. Primary cardiac tumors. Europ J Cardio-Thor Surg 29:925-932, 2006.
24. Grebenc ML, Rosado de Christensen ML, Green CE, Galfin KR. Primary cardiac and pericardial neoplasms: radiologic-pathologic correlation. Radiographics 20:1073-1103, 2000.
25. Murinello A, Mendonça P, Abreu A y col. Cardiac angiosarcoma-a review. Portuguese J Cardiol 26(5):577-584, 2007.
26. Yamamoto T, Umeda T, Nishioka K. Immunohistological distribution of stem cell factor and kit receptor in angiosarcoma. Acta Derm Venereol 80:443-445, 2000.
27. Hsieh P-L, Lee D, Chiou K-R y col. Echocardiographic features of primary cardiac sarcomas. Echocardiography 19:215-220, 2002.
28. Araoz PA, Eklund HE, Wech TJ, Breen JF. CT and MR imaging of primary cardiac malignancies. Radiographics 19:1421-1434, 1999.
29. Qingyi M, Hong L, Lima J, Wenjing T, Yuanyu Q, Shengan L. Echocardiographic and pathologic characteristics of primary cardiac tumors: a study of 149 patients. Int J Cardiol 84:69-75, 2002.
30. Freeman WK, Reeder GS. Cardiac neoplasias and thrombi. En: Freeman WK, Seward JB y col., editores. Transesophageal echocardiography. New York, EE.UU.: Little Brown; 1994. Pp. 339-384.
31. Kim EE, Wallace S, Abello Ry col. Malignant cardiac fibrous histiocytoma and angiosarcoma: MR features. J Comput Assist Tomogr 13:627-632, 1989.
32. Yahata S, Endo T, Houma H, et al. Sunray appearance on enhanced magnetic resonance image of cardiac angiosarcoma with pericardial obliteration. Am Heart J 127:468-471, 1994.
33. Herman MA, Shankerman RA, Edwards WD, Shub C, Schaff HV. Primary cardiac angiosarcoma: a clinicopathologic study of six cases. J Thorac Cardiovascul Surg 103:655-664, 1992.
34. Scheld HH, Nestle HW, King D. Resection of a heart tumour using autotransplantation. Thorac Cardiovasc Surg 36:40-43, 1988.
35. Kallenbach K, Haverich A. Explantation of the heart for resection of primary cardiac tumors can be avoided by partial ex situ heart surgery. Thorac Cardiovasc Surg 51:293-294, 2003.
36. Kodali D, Seetharamansk K. Sarcoma, Article ID 39130 (online). 1-3, 2006.
37. Nobuyukik K, Shiro F, Masaki K, Yukibiro T. Angiosarcoma arising from the right atrium: remarkable response to concurrent chemoradiotherapy with carboplatin and paclitaxel. J Thorac Oncology 6:970, 2011.
38. Pigot C, Welker M, Khosla P, Higgins RS. Improved outcome with multimodality therapy in primary cardiac angiosarcoma. Nature Clinical Practice Oncology 5:112-115, 2008.
39. Kakizaki S, Tagari H, Hosaka Y. Cardiac angiosarcoma responding to multidisciplinary treatment. Int J Cardiol 62:273-275, 1997.
40. Armitage JM, Kormos RL, Griffith BP, Fricker FJ, Hardesty RL. Heart transplantation in patients with malignant disease. J Heart Transplant 9:627-629, 1990.
41. Frota-Filho JD, Lucchese FA, Leães P, Valente LA, Vieira MS, Blacher C. Primary cardiac angiosarcoma. A therapeutical dilemma. Arq Bras Cardiol 78:589-591, 2002.
42. Gowdamarajan A, Michler RE. Therapy for primary cardiac tumours: is there a role for heart transplantation? Curr Opin Cardiol 15:121-125, 2000.
43. Uberfuhr P, Meiser B, Fuchs Ay col. Heart transplantation: an approach to treating primary cardiac sarcoma? J Heart Lung Transplant 21:1135-1139, 2002.
44. Reardon MJ. Cardiac angiosarcoma. Amschwand Sarcoma Cancer Foundation. Disponible en: www.sarcomacancer.org/index.php?page=dr-michael-j-reardon-on-cardiac-angiosarcoma. Consultado Feb 25, 2013.





 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: