Bibliografía del artículo
Bibliografía del artículo
1. Wild S, Roglic G, Green A, et al. Global prevalence of diabetes estimates for the year 2000 and projections for 2030. Diabetes Care 27(5):1047-1053, 2004.
2. Martínez-Castelao A. et al. Repercusiones clínicas y sociales de la epidemia de diabetes mellitus. Nefrología 28:245-248, 2008.
3. Martínez Castelao A, Gorriz Teruel JL, De Alvaro Moreno F y Navarro González JF. Epidemiología de la diabetes mellitus y la nefropatía diabética. Repercusiones sociales de la pandemia. NefroPlus 1(1), 2008.
4. Adler AI, Stevens RJ, Manley SE, Bilous RW, Cull CA, Holman RR. Development and progression of nephropathy in type 2 diabetes: the United Kingdom Prospective Diabetes Study (UKPDS 64). Kidney Int 63:225-232, 2003.
5. Finne P, Reunanen A, Stenman S, Groop PH, Gronhagen-Riska C. Incidence of end-stage renal disease in patients with type 1 diabetes. JAMA 294:1782-1787, 2005.
6. Santamaría B, Sanz A, Justo P, Catalán M., Sánchez-Niño MD, Benito A, Lorz C, Marrón B, Ortiz A. et al. Peritoneal defence-lessons learned which apply to diabetes complications. Nephrol Dial Trasplant 21(Supl 2):ii12-15, 2006.
7. Portoles J. El tratamiento con diálisis peritoneal sigue siendo un reto 25 años después. Nefrología 30(6):599-603, 2010.
8. Coronel F, Tornero F, Macía M, et al. Peritoneal clearances, protein losses and ultrafiltration in diabetic patients after four years in CAPD. Adv Perit Dial 7:35-38, 1991.
9. Honda K, Hamada C, Nakayama M, Miyazaki M, Sherif AM, Harada T, et al. Impact of uremia, diabetes, and peritoneal dialysis itself on the pathogenesis of peritoneal sclerosis: a quantitative study of peritoneal membrane morphology. Clin J Am Soc Nephrol 3(3):720-728, 2008.
10. Coronel F, Hortal, Naranjo P, et al. Captopril, proteinuria and peritoneal protein leackage in diabetic patients. Nephron 51:443, 1989.
1 . Coronel F, Berni A, Cigarran S, et al. Angiotensin II receptor blocker (Irbesartan) effects on peritoneal membrane functions. Adv Perit Dial 20:27-30, 2004.
2. Chung SH, Noh H, Ha H, et al. Optimal use of peritoneal dialysis in patients with diabetes. Perit Dial Int 29(Suppl 2):S132-134, Feb 2009.
3. Remón C, Quirós P, Portolés J, Marrón B. Critical analysis of survival studies on dialysis. Nefrologia 30(Supl Ext 1):8-14, 2010.
4. Weinhandl ED, Foley RN, Gilbertson DT, Arneson TJ, Snyder JJ, Collins AJ. Propensity-matched mortality comparison of incident hemodialysis and peritoneal dialysis patients. J Am Soc Nephrol 21(3):499-506, 2010.
5. Korevaar JC, Feith GW, Dekker FW, Van Manen JG, Boeschoten EW, Bossuyt PM et al. Effect of starting with hemodialysis compared with peritoneal dialysis in patients new on dialysis treatment a randomized controlled trial: Kidney Int 64(6):2222-2228, 2003.
6. Passadakis PS, Oreopoulos DG. Elderly diabetic patients in peritoneal dialysis. Adv Perit Dial 25:140-146, 2009.
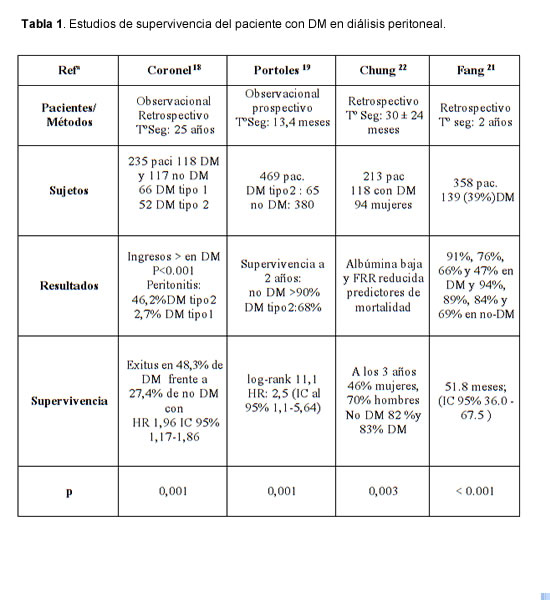
7. Passadakis PS, Thodis E, Vargemezis V, Oreopoulos D. Long term survival with peritoneal dialysis in ESRD due to diabetes. Clin Nephrol 56: 257-270, 2001.
8. Coronel F, Cigarran S, Herrero JA. Morbidity and mortality in diabetic patients on peritoneal dialysis. Twenty five years of experience at a single centre. Nefrología 30(6):326-332, 2010.
9. Portoles J, Corchete E, Lopez Sanchez P, Coronel F, et al. Patients on peritoneal dialysis with type 2 diabetes present poorer progress than nondiabetics at the expense of their cardiovascular comorbidity. Nefrología 29(4):336-342, 2009.
20. Vonesh EF, Snyder JJ, Foley RN, Collins AJ. Mortality studies comparing peritoneal dialysis and hemodialysis: what do they tell us? Kidney Int (103):S3-11, 2006.
21. Fang W, Kothari J, Khandelwal M, Naimark D, Jassal SV, Bargman J, Oreopoulos DG. Patient and technique survival of diabetics on peritoneal dialysis: one-center's experience and review of the literature. Clin Nephrol 69(3):193-200, 2008.
22. Chung SH, Han DC, Noh H, Jeon JS, Kwon SH, Lindholm B, Lee HB. Risk factors for mortality in diabetic peritoneal dialysis patients. Nephrol Dial Transplant 25(11):3742-3748, 2010.
23. www.usrds.org. Consultado Sept, 2010.
24. Yee-Moon A, Wai-Kei C, Wang M, Hiu-Shuen I, Lui S, Sanderson JE. Is valvular calcification a part of the missing link between residual kidney function and cardiac hypertrophy in peritoneal dialysis patients? Clin J Am Soc Nephrol 4:1629-1636, 2009.
25. Mendelssohn DC, Pierratos A. Reformulating the integrated care concept of the new millennium. Perit Dial Int 22(1):5-8, Ene-Feb 2002.
26. Coronel F, Cigarran S, Herrero JA. Early initiation of peritoneal dialysis in diabetic patients. Scand J Urol Nephrol 43:148-153, 2009.
27. Huang CC. Treatment targets for diabetic patients on peritoneal dialysis: any evidence? Perit. Dial. Int 27(Suppl 2):S176-179, Jun 2007.




 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: