Bibliografía del artículo
Bibliografía del artículo
1. Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics 2012. CA Cncer J Clin 65:87-108, 2015.
2. Ferlay J, Soerjomataram I, Dikshit RM, Eser Rm, Mathers C, Rebelo M, Parkin DM, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in Globocan 2012. Int J Cancer 136(5):359-386, 2015.
3. Bray F, Piñeros M. Cancer patterns, trends and projections in Latin America and the Caribbean: a global context. Salud Publica Mex 58:104-117, 2016.
4. Gutiérrez Delgado C, Armas Texta D, Reynoso Noverón N, Meneses García A, Mohar Betancourt A. Estimating the indirect costs associated with the expected number of cancer cases in Mexico by 2020. Salud Publica Mex 58:228-236, 2016.
5. Hanly PA, Sharp L. The cost of lost productivity due to premature cancer-related mortality: an economic measure of the cancer burden. BMC Cancer 14:224, 2014.
6. Hanly P, Soerjomataram I, Sharp L. Measuring the societal burden of cancer: the cost of lost productivity due to premature cancer-related mortality in Europe. Int J Cancer 136:E136-45, 2015.
7. Gao G, Liang X, Jiang J, Zhou X, Huang R, Chu Z, et al. A systematic review and meta-analysis of immunochemotherapy with rituximab for B-cell non-Hodgkin's lymphoma. Acta Oncol (Madr) 49:3-12, 2010.
8. Salles G, Barrett M, Foà R, Maurer J, O'Brien S, Valente N, Wenger M, Maloney DG. Rituximab in B-cell hematologic malignancies: a review of 20 years of clinical experiencie. Adv Ther 34(10):2232-2273, 2017.
9. Pento JT. Monoclonal antibodies for the treatment of Cancer. Anticancer Res 37(11):5935-5939, 2017.
10. Prasad V, Kaestner V. Nivolumab and pembrolizumab: Monoclonal antibodies against programmed cell death-1 (PD-1) that are interchangeable. Semin Oncol 44(2):132-135, 2017.
11. D'Agostino M, Boccadoro M, Smith EL. Novel immunotherapies for multiple myeloma. Curr Hematol Malig Rep 12(4):344-357, 2017.
12. Patrignani P, Patrono C. Aspirin and cancer. J Am Coll Cardiol 68(9):967-976, 2016.
13. Ghosh N, Tucker N, Zahurak M, Wozney J, Borrello I, Huff CA. Clarthromycin overcomes resistance to lenalidomide and dexamerhasone in multiple myeloma. Am J Hematol 89(8):E116-E120, 2014.
14. Safwat S, Ishak RA, Hathout RM, Mortada ND. Statins anticancer targeted delivery systems: re-purposing and old molecule. J Pharm Pharmacol 69(6):613-624, 2017.
15. Enriquez-Navas PM1, Wojtkowiak JW1, Gatenby RA2. Application od evolutionary principles to cancer therapy. Cancer Res 75(22):4675-4680, 2015.
16. Romero R, Erez O, Hüttemann M, Maymon E, Panaitescu B, Conde-Agudelo A, Pacora P, Yoon BH, Grossman LI. Metformin, the aspirin of the 21st century: its role in gestational diabetes mellitus, prevention of preeclampsia and cancer, and the promotion of longevity. Am J Obstet Gynecol 217(3):282-302, 2017.
17. Grant PJ. Beneficial effects of metformin on haemstasis and vascular function in man. Diabetes Metab 29(4):6S44-52, 2003.
18. Wang YW, He SJ, Feng X, Cheng J, Luo YT, Tian L, Huang Q. Metformin: a review of its potential indications.Drug Des Devel Ther 11:2421-2429, 2017.
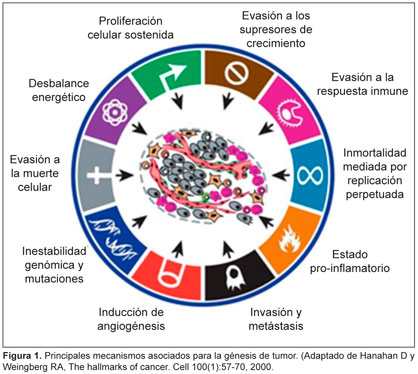
19. Fouad YA, Aanei C. Revisiting the hallmarks of cancer. Am J Cancer Res 7(5):1016-1036, 2017.
20. Horne SD, Pollick SA, Heng HHQ. Evolutionary mechanism unifies the hallmarks of cancer. Int J Cancer 136:2012-21, 2015.
21. Sonnenschein C, Soto AM. The aging of the 2000 and 2011 hallmarks of cancer reviews: a critique. J Biosci 38:651-63, 2013.
22. Hanahan D, Weinberg RA. The hallmarks of cancer. Cell 100:57-70, 2000.
23. Turley SJ, Cremasco V, Astarita JL. Immunological hallmarks of stromal cells in the tumour microenviroment. Nat Rev Immunol 15(11):669-682, 2015.
24. Raffaghello L, Dazzi F Classification and biology of tumour associated stromal cells. Immunol Lett 168(2):175-182, 2015.
25. Kharaishvili G, Simkova D, Bouchalova K, Gachechiladze M, Narsia N, Bouchal J. The role of cancer-associated fibroblasts, solid stress and other microenvironmental factors in tumor progression and therapy resistance. Cancer Cell Int 14:41, 2014.
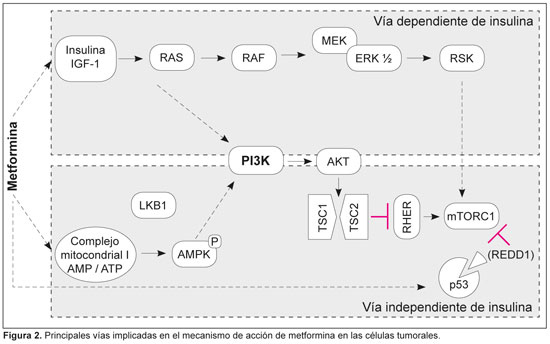
26. Potter M, Newport E, Morten KJ. The Warburg effect: 80 years on. Biochem Soc Trans 44:1499-505, 2016.
27. Rena G, Hardie DG, Pearson ER. The mechanism of action of metformin. Diabetologia 60(9):1577-1585, 2017.
28. Krentz AJ, Bailey CJ. Oral antidiabetic agents: current role in type 2 diabetes mellitus. Drugs 65:385-411, 2005.
29. Zolk O. Disposition of metformin: Variability due to polymorphisms of organic cation transporters. Ann Med 44:119-29, 2012.
30. Klip A, Leiter LA. Cellular mechanism of action of metformin. Diabetes Care 13:696-704, 1990.
31. Florez JC. Pharmacogenetics in type 2 diabetes: precision medicine or discovery tool? Diabetologia 60(5):800-807, 2017.
32. Bullon P, Marin-Aguilar F, Roman-Malo L. AMPK/mitochondria in metabolic diseases. EXS 107:129-152, 2016.
33. Guigas B, Viollet B. Targeting AMPK: from ancient drugs to new small-molecule activators. EXS 107:327-350, 2016.
34. Towler MC, Hardie DG. AMP-activated protein kinase in metabolic control and insulin signaling. Circ Res 100(3):328-41, 2007.
35. Lantier L, Fentz J, Mounier R, Leclerc J, Treebak JT, Pehmøller C, et al. AMPK controls exercise endurance, mitochondrial oxidative capacity, and skeletal muscle integrity. FASEB J 28(7):3211-24, 2014.
36. Hur KY, Lee MS. New mechanisms of metformin action: Focusing on mitochondria and the gut. J Diabetes Investig 6(6):600-9, 2015.
37. Kim J, You YJ. Regulation of organelle function by metformin. IUBMB Life 69(7):459-469, 2017.
38. Hardie DG, Lin SC. AMP-activated protein kinase - not just an energy sensor. F1000 Res 6:1724, 2017.
39. Jiang ZZ, Hu MW, Ma XS , Schatten H, Fan HY, Wang ZB, Sun QY. LKB1 acts as a critical gatekeeper of ovarian primordial follicle pool. Oncotarget 7(5):5738-5753, 2016.
40. Gadducci A, Biglia N, Tana R, Cosio S, Gallo M. Metformin use and gynecological cancers: A novel treatment option emerging from drug repositioning. Crit Rev Oncol Hematol 105:73-83, 2016.
41. Lei Y, Yi Y, Liu Y, Liu X, Keller ET, Qian CN, et al. Metformin targets multiple signaling pathways in cancer. Chin J Cancer 36(1):17, 2017.
42. Gong J, Robbins LA, Lugea A, Waldron RT, Jeon CY, Pandol SJ. Diabetes, pancreatic cancer, and metformin therapy. Front Physiol 5:426, 2014.
43. Gong Y, Zhang B, Liao Y, Tang Y, Mai C, Chen T, Tang H. Serum insulin-like growth factor axis and the risk of pancreatic cancer: systematic review and meta-analysis. Nutrients 9(4)pii: E394, 2017.
44. Wang Z, Xiao X, Ge R, Li J, Johnson CW, Rassoulian C, Olumi AF. Metformin inhibits the proliferation of benign prostatic epithelial cells. PLoS One 12(3):e0173335, 2017.
45. Xie J, Bartels CM, Barton SW, Gu D. Targeting hedgehog signaling in cancer: research and clinical developments. Onco Targets Ther 6:1425-1435, 2013.
46. Kieran MW. Targeted treatment for sonic hedgehog-dependent medulloblastoma. Neuro Oncol 16(8):1037-1047, 2014.
47. Katoh Y, Katoh M. Hedgehog target genes: mechanisms of carcinogenesis induced by aberrant hedgehog signaling activation. Curr Mol Med 9(7):873-86, 2009.
48. MacDonald BT, Tamai K, He X. Wnt/beta-catenin signaling: components, mechanisms, and diseases. Dev Cell 17(1):9-26, 2009.
49. Fan C, Wang Y, Liu Z, Sun Y, Wang X, Wei G, et al. Metformin exerts anticancer effects through the inhibition of the Sonic hedgehog signaling pathway in breast cancer. Int J Mol Med 36(1):204-214, 2015.
50. Song Z, Wei B, Lu C, Huang X, Li P, Chen L. Metformin suppresses the expression of Sonic hedgehog in gastric cancer cells. Mol Med Rep 15(4):1909-1915, 2017.
51. Porta C, Paglino C, Mosca A. Targeting PI3K/Akt/mTOR signaling in cancer. Front Oncol 4:64, 2014.
52. Chauhan A, Semwal DK, Mishra SP, Goyal S, Marathe R, Semwal RB. Combination of mTOR and MAPK inhibitors. A potential way to treat renal cell carcinoma. Med Sci (Basel) 4(4)pii: E16, 2016.
53. Moschetta M, Reale A, Marasco C, Vacca A, Carratù MR. Therapeutic targeting of the mTOR-signalling pathway in cancer: benefits and limitations. Br J Pharmacol 171(16):3801-3813, 2014.
54. Chae YK, Arya A, Malecek MK, Shin DS, Carneiro B, Chandra S, et al. Repurposing metformin for cancer treatment: current clinical studies. Oncotarget 7(26):40767-40780, 2016.
55. Ben Sahra I, Regazzetti C, Robert G, Laurent K, Le Marchand-Brustel Y, Auberger P, et al. Metformin, independent of AMPK, induces mTOR inhibition and cell-cycle arrest through REDD1. Cancer Res 71(13):4366-72, 2011.
56. Altieri DC. Survivin, versatile modulation of cell division and apoptosis in cancer. Oncogene 22:8581-9, 2003.
57. Han G, Gong H, Wang Y, Guo S, Liu K. AMPK/mTOR-mediated inhibition of survivin partly contributes to metformin-induced apoptosis in human gastric cancer cell. Cancer Biol Ther 16:77-87, 2015.
58. Li X, Li B, Ni Z, Zhou P, Wang B, He J, et al. Metformin synergizes with BCL-XL/BCL-2 inhibitor ABT-263 to induce apoptosis specifically in p53-defective cancer cells. Mol Cancer Ther 16(9):1806-1818, 2017.
59. Zinzi L, Contino M, Cantore M, Capparelli E, Leopoldo M, Colabufo NA. ABC transporters in CSCs membranes as a novel target for treating tumor relapse. Front Pharmacol 5:163, 2014.
60. Begicevic RR, Falasca M. ABC Transporters in cancer stem cells: beyond chemoresistance. Int J Mol Sci 18(11)pii: E2362, 2017.
61. Ween MP, Armstrong MA, Oehler MK, Ricciardelli C. The role of ABC transporters in ovarian cancer progression and chemoresistance. Crit Rev Oncol Hematol 96(2):220-56, 2015.
62. Chen Z, Shi T, Zhang L, Zhu P, Deng M, Huang C, et al. Mammalian drug efflux transporters of the ATP binding cassette (ABC) family in multidrug resistance: A review of the past decade. Cancer Lett 370:153-64, 2016.
63. Limtrakul P, Chearwae W, Shukla S, Phisalphong C, Ambudkar SV. Modulation of function of three ABC drug transporters, P-glycoprotein (ABCB1), mitoxantrone resistance protein (ABCG2) and multidrug resistance protein 1 (ABCC1) by tetrahydrocurcumin, a major metabolite of curcumin. Mol Cell Biochem 296:85-95, 2007.
64. Qu C, Zhang W, Zheng G, Zhang Z, Yin J, He Z. Metformin reverses multidrug resistance and epithelial-mesenchymal transition (EMT) via activating AMP-activated protein kinase (AMPK) in human breast cancer cells. Mol Cell Biochem 386(1-2):63-71, 2014.
65. Ling S, Tian Y, Zhang H, Jia K, Feng T, et al. Metformin reverses multidrug resistance in human hepatocellular carcinoma Bel 7402/5 fluorouracil cells. Mol Med Rep 10(6):2891-7, 2014.
66. Kim HG, Hien TT, Han EH, Hwang YP, Choi JH, Kang KW, et al. Metformin inhibits P-glycoprotein expression via the NF?B pathway and CRE transcriptional activity through AMPKactivation. Br J Pharmacol 162(5):1096-108, 2011.
67. Abbasi MM, Valizadeh H, Hamishehkar H, Zakeri-Milani P. Inhibition of P-glycoprotein expression and function by anti-diabetic drugs gliclazide, metformin, and pioglitazone in vitro and in situ. Res Pharm Sci 11(3):177-86, 2016.
68. Singhal A, Jie L, Kumar P, Hong GS, Leow MK-S, Paleja B, et al. Metformin as adjunct antituberculosis therapy. Sci Transl Med 6:263ra159, 2014.
69. Vashisht R, Brahmachari SK. Metformin as a potential combination therapy with existing front-line antibiotics for tuberculosis. J Transl Med !3:83, 2015.
70. Lu DY, Huang CC, Huang PH, Chung CM, Lin SJ, Chen JW, et al. Metformin use in patients with type 2 diabetes mellitus is associated with reduced risk of deep vein thrombosis: a non-randomized, pair-matched cohort study. BMC Cardiovasc Disord 14:187, 2014.
71. Lin TC, Hwang DK, Hsu CC, Peng CH, Wang ML, Chiou SH, Chen SJ. Protective effect of metformin against retinal vein occlusions in diabetes mellitus - A nationwide population-based study. PLoS One 12(11):e0188136, 2017.




 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: