




 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a:Introducción
La fibrilación ventricular (FV) (la causa más común de muerte súbita) es considerada una causa mayor de mortalidad en el mundo occidental (1). La FV es una arritmia caótica relacionada principalmente con el mecanismo de reentrada (9): disminuye los niveles de coordinación entre los diferentes segmentos del corazón y evita así que éste pueda mantener su acción de bomba. Existen varias vías para enfrentar a esta arritmia mortal, tales como: estudios básicos en curso para el entendimiento de los mecanismos básicos (2); nuevas mejoras en el desfibrilador implantado (3); tecnología de punta para bajar la demanda de energía para la desfibrilación, con o sin interacciones medicamentosas (4,5); mejoras en los procedimientos y en el uso de nuevas sustancias en la resucitación cardiopulmonar (6,7); y, más recientemente, desfibriladores automáticos externos para su utilización en centros públicos (8). La desfibrilación temprana es considerada el factor determinante más importante en la supervivencia de las víctimas de paro cardíaco debido a FV (10).Es sabido que la adrenalina es un arritmogénico durante la isquemia (11). Durante una FV prolongada puede hasta ser tóxica debido al incremento del consumo de energía del tejido y por la facilitación de la sobrecarga de calcio que lleva a reducir el éxito de la desfibrilación (12,13). No obstante, también se conoce a la adrenalina por mejorar el resultado de la desfibrilación tras la resucitación cardiopulmonar y por reducir la demanda de energía de la desfibrilación en modelos animales (14,15). Su efecto benéfico durante la resucitación se relaciona principalmente con el aumento de la intensidad de contracción y de la presión de perfusión (7).Nosotros pensamos que la adrenalina posee un factor benéfico adicional durante la resucitación, que se asocia con la modulación de parámetros electrofisiológicos. Este factor se demuestra comparando la mejoría en las propiedades pasivas de la conducción vs. el deterioro durante la isquemia global (IG). Es posible que durante la IG exista una pequeña ventana electrofisiológica donde se encuentre suficiente energía disponible y donde las elevadas cantidades de AMPc por la ruptura del ATP mejoren de manera conjunta la conexión eléctrica entre las células (16). El resultado de este efecto de la adrenalina puede contribuir a una contracción más coordinada, que genera mayor presión de perfusión con actividad eléctrica más estable luego del tratamiento de desfibrilación. Más detalles que apoyan esta teoría se encuentran a disposición en la referencia número 17.
Métodos
Utilizamos corazones aislados de gatos adultos anestesiados de ambos sexos (n = 19, 3.5-4.5 kg), perfundidos con solución modificada de Krebs-Henseleit. El buffer HEPES reemplazó la necesidad de NaH2PO4 y NaHCO3. Se colocaron balones en las cavidades del ventrículo derecho (VD) e izquierdo (VI) y se inflaron para producir presiones de fin de diástole fisiológicas de aproximadamente 8-10 mm Hg, respectivamente. Los parámetros electrofisiológicos incluían el umbral de excitabilidad diastólico, el período refractario ventricular y el tiempo de conducción epicárdico medido longitudinal y transversalmente respecto de la orientación de la fibra, todos registrados en ciclos de 200 ms de longitud. Las propiedades pasivas de conducción (resistencia celular eléctrica externa e interna) se determinaron indirectamente a través de la valoración de la resistencia global del tejido (ri, ohm) en el VI (18,19). Dos trazados electrocardiográficos de cada ventrículo se utilizaron para analizar las arritmias inducidas eléctricamente. La duración de la arritmia para cada análisis fue generalmente de 30 seg y no menor de 20 seg. Se utilizaron análisis espectrales de entropía máxima para calcular la densidad de funciones (espectro de poder) de las señales. Basados en los resultados de estos análisis, se aplicaron dos medidas para determinar el grado de organización de la arritmia: 1. Entropía normalizada, con valores entre 0 y 1, donde valores más bajos indican un grado más alto de organización; 2. Espectro de picos dominantes, donde una banda de frecuencia más angosta indica actividad más organizada. La así denominada frecuencia de picos dominantes también se midió para detectar indirectamente los cambios en la velocidad de la arritmia (17,20,21).Se examinaron dos concentraciones de adrenalina (1x10–7, 1x10–6 M; Teva Ltd, Israel) y se utilizaron dos series de corazones aislados debido a la relativa gran cantidad de pruebas realizadas. La primera serie incluía: 1) perfusión normal sin tratamiento (control); 2) IG; 3) adrenalina (1x10–7 M) durante la perfusión continua y 4) adrenalina (1x10–7 M) durante la IG. En esta serie se midieron los parámetros electrofisiológicos durante el ritmo conservado y durante la arritmia. La segunda serie incluía: 1) control; 2) adrenalina (1x10–6 M) durante la perfusión y 3) adrenalina (1x10–6 M) durante la IG, donde sólo se midieron los parámetros respecto a la arritmia. En ambas series, la IG se indujo por 60 seg. Debido a la corta duración del efecto de la adrenalina, éste se mantuvo mediante una bomba especial durante la IG. De acuerdo con ambas series, se aplicó perfusión continua de las concentraciones utilizadas, disueltas en solución salina no oxigenada, y se l a envió a la raíz aórtica a una tasa de flujo constante del 20% del valor de flujo normal, medido en el control en un ciclo de 200 ms.
Resultados
Las altas concentraciones de adrenalina (1x10–6 M) durante la IG causaron la terminación espontánea de las taquiarritmias inducidas en 4/9 corazones, y en 3/9 con adrenalina durante la perfusión comparados con el grupo control (perfusión continua sin drogas) y con los otros tratamientos (tabla 1).
| TABLA 1. | Frecuencia de episodios transitorios de taquiarritmias inducidas en distintos tratamientos. |

| Adr, adrenalina; per,durante la perfusión |
En ambos casos, altas concentraciones de adrenalina también causaron que algunos de los episodios inducidos se transformaran en taquicardias monomorfas y polimorfas (tabla 2).
| TABLA 2. | Tipo dearritmia inducida en varios tratamientos en ambos ventrículos. |
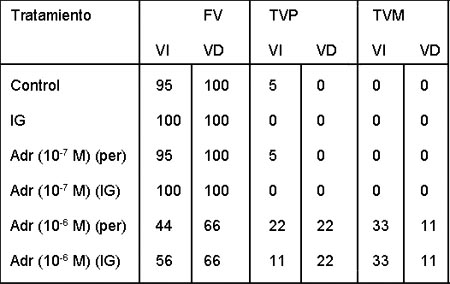
| Adr, adrenalina; per,durante la perfusión; FV, fibrilación ventricular; TVP, taquicardia ventricularpolimórfica; TVM, taquicardia ventricular monomórfica. |
La figura 1 muestra trazados electrocardiográficos de arritmias inducidas en ambos ventrículos, así como el resultado de su análisis espectral de entropía máxima en corazones sin tratar durante la perfusión continua y durante el uso de altas concentraciones de adrenalina (1x10–6 M) bajo IG.
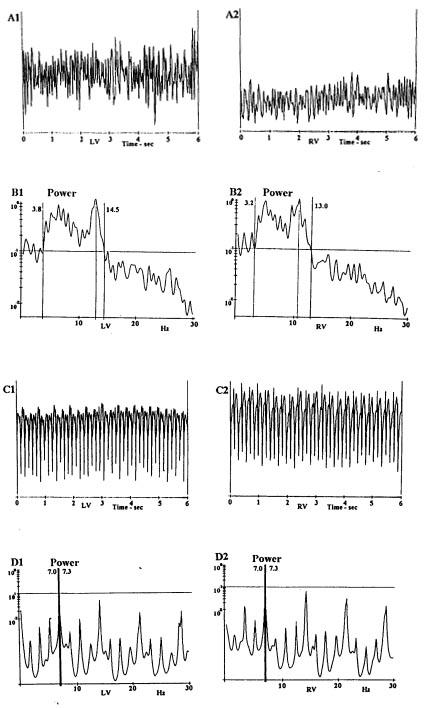
Figura 1. Electrocardiogramas y su transformación por análisis de máxima entropía, obtenidos de los ventrículos izquierdo (VI) y derecho (VD) en el grupo control (corazones no tratados durante la perfusión continua) y en los tratados con adrenalina (1x10 –6 M) durante la isquemia global (IG). Los electrocardiogramas en el control muestran fibrilación ventricular (FV) (paneles A1, A2 ) y su transformación (paneles B1, B2 ) exhibe un espectro relativamente amplio de picos dominantes. Seguido del tratamiento con adrenalina bajo IG, se indujo en ambos ventrículos una taquicardia ventricular monomórfica (paneles C1, C2 ). En consecuencia, la gama de picos dominantes es mucho más angosta y se pueden observar armonías repetitivas en los picos dominantes (paneles D1, D2 ).
Se obtuvo una actividad considerablemente más organizada asemejando a una taquicardia ventricular monomórfica con adrenalina bajo IG. En general, las altas concentraciones de adrenalina (1x10–6 M) durante la IG causaron que el grado de organización de la arritmia sea moderadamente mayor y menos extenso durante la perfusión, donde no hubo cambios con otros tratamientos (figura 2).

Figura 2. Grado de organización de la arritmia: A Entropía normalizada, B Espectro de picos dominantes y C Frecuencia de picos dominantes (velocidad de la arritmia), en el grupo control (corazones sin tratar durante la perfusión continua) y con altas concentraciones de adrenalina (1x10–6 M) durante la perfusión continua y la IG. La entropía normalizada fue notablemente menor en el VI con adrenalina durante la perfusión continua con relación al control (1) (p < 0.01), y en ambos ventrículos, VD (1) (p<0.01) y VI (2) (p<0.05) con adrenalina durante la IG. No se detectaron diferencias significativas entre los tres grupos en el espectro de picos dominantes. La frecuencia de los picos dominantes decreció sólo en los VD y VI con adrenalina (1x10–6 M) durante la IG (1) (p < 0.05).
Adr, adrenalina.
La IG sola causó una velocidad de arritmia menor (~16.3%, p < 0.05), levemente menor que con altas cantidades de adrenalina con IG (~20.1%, p < 0.05). No se encontró efecto alguno de la adrenalina sobre la velocidad de la arritmia durante la perfusión. Las bajas cantidades de adrenalina (1x10–7 M) durante la IG elevaron notablemente (~4 veces, p < 0.001) el umbral diastólico de excitabilidad en comparación con el grupo control, mientras que el efecto de la IG sola no alcanzó niveles de importancia (~2 veces, p < 0.07) (figura 3A). Las bajas concentraciones de adrenalina no afectaron el período refractario ventricular durante la perfusión continua o IG en comparación con el control (figura 3B).

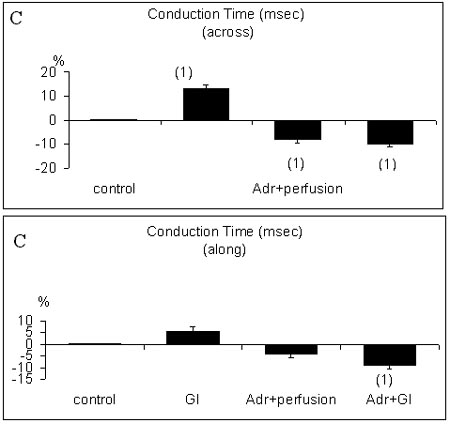
Figura 3. Efectos de la IG (sin tratamiento) y de bajas concentraciones de adrenalina (1x10–7 M) durante la perfusión continua y durante la IG con relación al grupo control (perfusión continua sin tratamiento) sobre los parámetros electrofisiológicos medidos en un ciclo de 200 ms de extensión. A Umbral diastólico. La IG no aumentó el umbral en relación con el control (1) (p < 0.07) que fue menor comparado con la adrenalina durante la IG (2) (p < 0.05). La adrenalina durante la IG incrementó de manera significativa el umbral en comparación al control (3) (p < 0.001). B Período refractario. El período refractario del ventrículo no se afectó de manera importante con el uso de adrenalina bajo perfusión continua o bajo IG. C Tiempo de conducción. El tiempo de conducción a lo ancho de la orientación de la fibra se prolongó significantemente por la IG y se acortó con la adrenalina durante la perfusión continua y durante la IG (1) (p < 0.02). No hubo cambios importantes a lo largo de la orientación de la fibra por la IG sola y por la adrenalina durante la perfusión continua, pero se redujo notoriamente con el uso de adrenalina durante la IG (1) (p < 0.05).
Adr, adrenalina.
Previamente se encontró que la IG sola prolongaba levemente la refractariedad en el mismo modelo (22). Las bajas concentraciones de adrenalina (1x10–7 M) durante condiciones no isquémicas así como de IG redujeron el tiempo de conducción de forma importante en sentido transversal a la orientación de la fibra, lo que fue mucho más pronunciado bajo el uso de adrenalina más IG (figura 3C). La adrenalina más la IG también causó una reducción notable del tiempo de conducción a lo largo de la orientación de la fibra. La IG aislada causó el efecto opuesto, o sea, una prolongación significativa del tiempo de conducción. El cambio relativo de la resistencia de todo el tejido luego de mantener la arritmia un minuto se muestra en la figura 4.
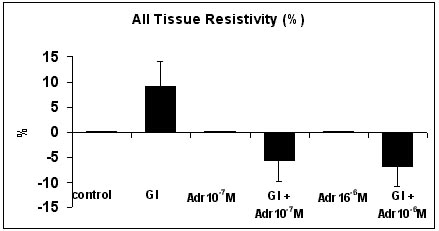
Figura 4. Efecto de los distintos tratamientos en la resistividad global del tejido durante 1 minuto de arritmia provocada. Este parámetro aumento por medio de la IG, no cambió con la adrenalina durante la perfusión y se redujo con la adrenalina durante la IG, reduciéndose aún más con las concentraciones más elevadas de adrenalina durante la IG.(1) p<0.01 tratados vs. control.
Adr, adrenalina.
Los resultados principales demostraron incremento en los valores con IG sola y el efecto opuesto con adrenalina durante la IG, esto es reducción en este valor comparado con el control. Con una concentración de adrenalina más elevada el efecto era aún más pronunciado.
Discusión
Se sabe que la adrenalina es arritmogénica durante la isquemia y posee efectos tóxicos durante la fibrilación prolongada que se relacionan con el consumo de energía aumentado y la sobrecarga de calcio (11-13). Sin embargo, la adrenalina también ha demostrado un efecto benéfico durante la resucitación, junto con incremento en la presión de perfusión y reducción en la demanda de energía para la desfibrilación combinada con la actividad beta adrenérgica (14,15). Los hallazgos de este estudio indican la existencia de un potencial efecto benéfico adicional de la adrenalina relacionado con la modulación de parámetros electrofisiológicos durante la IG de corta duración. Se indica que existe una ventana durante las condiciones de isquemia global donde la adrenalina podría mejorar algunas de las propiedades electrofisiológicas en comparación no solo con la IG aislada, sino también con el grupo control o con la adrenalina bajo condiciones no isquémicas. Su efecto principal parece relacionarse con una mejoría en las propiedades pasivas de conducción y quizá también con la supresión de sus propiedades activas. Es sabido que ambos cambios (mejora de las propiedades pasivas y supresión de las activas) reducen el factor de seguridad para la actividad de reentrada y mejoran la estructura de la arritmia (23). La elevación de los niveles de adrenalina y de AMPc debido a la ruptura del ATP y la activación de la proteinquinasa A, que fosforila las proteínas de unión, pueden proveer posibles mediadores para el cambio de las propiedades pasivas, ya que se encontró que ambas mejoran la conexión eléctrica entre las células y la conductividad (16,24). El papel exacto de la supresión de los canales de sodio por la adrenalina durante la IG todavía no está enteramente aclarado. Su mecanismo podría relacionarse con el bloqueo del canal de sodio rápido residual (25).
Conclusión
Durante la IG existe una ventana electrofisiológica en la cual el efecto benéfico de la adrenalina está aumentado, de modo que puede dar lugar a mayor éxito en la desfibrilación y la resucitación. Se necesitan más estudios para entender los mecanismos involucrados y para examinar las formas de ampliar esta ventana fisiológica.Algunas presunciones en cuanto a los posibles futuros estudios. Una manera posible de prolongar esta ventana fisiológica puede ser con el uso de agentes de corta acción para bloquear los canales internos y externos de calcio, preparados para trabajar con distintas concentraciones de adrenalina. El magnesio podría ser un potencial candidato, ya que la combinación de este último con la adrenalina ha mejorado la resucitación luego de un largo período sin déficit neurológico (26).