




 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a:En la actualidad se emplea un gran número de sistemas de prueba en animales, plantas, bacterias etc. para detectar daño genético inducido o inherente. Por ello, se consideran como herramientas útiles en los estudios de toxicología ambiental (1-3). Uno de los métodos más utilizados para detectar actividad genotóxica de los agentes químicos y físicos es la prueba de mutación rosa en los pelos estaminales de Tradescantia (clon 4430) (4). Esta prueba está basada en el hecho de que las células de los pelos estaminales son heterocigotas para el color (Aa). El alelo dominante (A) es responsable del color azul y el recesivo (a) del color rosa. Cualquier mutación en el alelo dominante dará por resultado la expresión del alelo recesivo (células rosa) (5,6). Este sistema es muy sensible y empleado en estudios ambientales in situ. El protocolo en Tradescantia incluye la recolección de datos durante 9 días después del tratamiento, usualmente del día 7 al15 (5,6). La frecuencia de mutación de los pelos estaminales se expresa como el número de eventos rosa del total de pelos (frecuentemente en mil pelos) o por el número de divisiones celulares de los pelos (104 divisiones celulares en pelos).
Una de las más recientes pruebas para detectar daño genético es la prueba del cometa, la cual permite cuantificar bajos niveles de ADN dañado en las células individuales, además de ser muy simple y requerir de pocas células (7,8). Esta técnica detecta rupturas y otros tipos de alteraciones al ADN y ha sido extensamente empleada en células animales (7-10); además, es más eficiente que otros sistemas para detectar mutagenicidad (11). Sin embargo, ha sido menos empleada en plantas aunque el número de trabajos va en aumento (12-29). Koppen y Verschaeve (12) fueron los primeros que informaron la aplicación de la prueba del cometa en las células de plantas, particularmente en Vicia faba. En adición a las plantas del tabaco y Vicia faba la prueba del cometa se ha aplicado a Vitis vinifera (30), Arabidopsis Tatiana, Agropyron repens, Bellis perennis, Chenopodium rubrus, Convolvulus arvensis, Lamium albun, Plantago media, Poa annua, Taraxacum officinale, Urtica dioico (23), Calamagrostis epigejos (24), Agave tequilana weber 25 Impatients balsamina (31).
Poli et al. (19) aplicaron la prueba del cometa y obtuvieron buenos resultados en las células de plantas (Allium cepa y Impatiens balsamina). Los primeros hallazgos en leucocitos humanos confirmaron la sensibilidad, aplicabilidad y peculiaridad de este ensayo para evaluar la genotoxicidad de muestras ambientales. Los núcleos de Vicia faba fueron utilizados para valorar la capacidad de reparación después de la inducción de daño genético con rayos X (15). Todos los sistemas reportados en plantas y que emplean la prueba del cometa mencionan la necesidad de romper la pared celular así como el usos de un gradiente de centrifugación para separar los núcleos. La extracción de los núcleos en los pelos estaminales de Tradescantia puede verse facilitada porque las células y sus núcleos son muy grandes y fáciles de obtener. A estas células no es necesario sumergirlas en nitrógeno líquido o centrifugarlas en un gradiente de densidad para separar los núcleos.
Este trabajo se elaboró con dos objetivos principales: estandarizar la metodología en los núcleos celulares de los pelos estaminales de Tradescantia para usarla en el monitoreo de genotóxicos ambientales y comparar los resultados con los obtenidos con la prueba de mutación rosa en Tradescantia .
Material y métodos
Mutágenos
Los mutágenos usados en este experimento fueron: hidrazida málica (MH) 1, 5 y 10 mM; etil metano sulfonato (EMS) 15, 30 y 45 mM y N-nitroso dietilamina (NDEA) 1, 5 y 10 mM. Como sustancia experimental a estudiar (contaminante ambiental) se empleó el herbicida glifosato en las siguientes diluciones a partir de la forma comercial: 10-4, 10-5, 10-6 y 10-7
Plantas
En este experimento se utilizó el clon 4430 de Tradescantia (híbrido T. subacaulis X T. hirsutiflora), el cual es altamente sensible a mutágenos.Para incrementar la eficiencia del ensayo de mutación rosa en Tradescantia , el número de eventos mutacionales se calculó como sigue: eventos rosa/ número total de pelos por flor y expresado en términos de eventos rosa por 1000 pelos.
Tratamiento y conteo en Tradescantia
Las plantas crecieron bajo condiciones controladas a una temperatura de 22 °C durante el día y 16-18 °C durante la noche. Para cada tratamiento, se sumergieron 30 inforescencias por 3 horas en 250 ml de la solución a probar. Después del tratamiento, los cortes se lavaron vigorosamente por 30 minutos y se colocaron en una solución nutriente de Hoagland\'s. Como control negativo se utilizaron plantas no tratadas sumergidas en la solución de Hoagland´s. Para cada tratamiento se observaron de 5-10 flores (es decir, 1 500 a 3 000 pelos estaminales) dependiendo del número de flores disponibles.Los pelos estaminales se observaron diariamente desde el día 7 al 15 después de la aplicación de los mutágenos, período en el cual la mutación rosa es evidente. Los eventos mutacionales y el número de pelos se observaron en un microscopio de disección. La frecuencia de las células rosa se estableció de acuerdo con la metodología de Underbrink et al. (5). Los valores medios de la mutación rosa se calcularon con un intervalo de confianza de 95% ( p < 0.05).
Obtención de núcleos
Los núcleos de las células estaminales se separaron como sigue: se colocaron 24 estambres, obtenidos 14 días después del tratamiento (de acuerdo con la prueba de mutación rosa, éste es el período donde se registra la más alta frecuencia de mutación), en un mortero frío al cual se le agregaron 440 µl de amortiguador Honda (0.44 M sucrosa, 2.5% Ficoll (tipe 400), 5% Dextran T-40, 25 mM Tris-HCl (pH 8.5), 10 mM MgCl2, 10 mM β-mercaptoetanol, y 2.5% Triton X-100). Después de la homogenización, la mezcla se filtro en una malla de nylon (80 μ m). Los núcleos se separaron por centrifugación a 3 000 rpm (4 °C) por 3 minutos. Para romper la pared celular y separar los núcleos no hubo la necesidad de congelar en nitrógeno líquido ni utilizar un gradiente de centrifugación. Esta parte es diferente al método empleado por Koppen y Verschaeve (12). y representa un interesante simplificación del protocolo original. Los núcleos fueron lavados tres veces en 5 ml de solución salina (0.9% NaCl) y resuspendidos en 200 µ0l de nueva solución salina y guardados a –20 °C hasta el momento de la electroforesis. El resto de la metodología se realizó de acuerdo con Singh et al. (7).
Prueba del cometa alcalino
Se utilizó la técnica básica del cometa alcalino de Singh et al. (7) Sobre el portaobjetos se colocaron 0.5 ml de agarosa de solidificación normal (NMP) al 1% y se permitió que solidificara para luego removerla. Inmediatamente después, 300 µl de agarosa NMP 0.6% se colocaron en el portaobjetos y se permitió la solidificación. Enseguida 100 µl de agarosa al 0.5% de bajo punto de solidificación (LMP) se mezclaron con 10 µl de la suspensión nuclear y también se colocaron en el portaobjetos. Una tercera capa de agarosa de 100 µl de LMP 0.5% se añadió hasta cubrir la capa que contenía la suspensión nuclear. Los portaobjetos se trataron durante 3 horas a 25 °C con varias concentraciones de NDEA, EMS, MH y glifosato y después del tratamiento se guardaron a 4 °C para evitar la reparación del daño inducido por estas sustancias.Para lograr la lisis nuclear y permitir el desenvolvimiento del ADN, los portaobjetos se sumergieron en un amortiguador de lisis (2.5 M NaCl, 100 mM Na2EDTA, 10 mM Tris-HCl, 1% lauril sarcosinato de sodio, 1% Triton X-100, y 10% DMSO, pH 10) por una hora a 4 °C, y después de la lisis los portaobjetos se colocaron en un sistema de electroforesis horizontal con un amortiguador de alto pH (30 mM NaOH, 1 mM Na2EDTA, pH 13) por 45 minutos para permitir la separación de las cadenas del ADN antes de la electroforesis. Este paso se optimizó encontrándose que un tiempo de 45 minutos fue el óptimo. Se llevó a cabo la electroforesis por 15 minutos a 9 voltios y 200 mA. Todos los pasos descritos se llevaron a cabo bajo luz amarilla para evitar daño adicional al ADN. Después de la electroforesis se lavaron con cuidado los portaobjetos y se sumergieron por 5 minutos en un amortiguador de neutralización (0.4 M Tris-HCl, pH 7.5) para remover el álcali. Los geles se tiñeron con bromuro de etidio (100 µl a 20 µg/ml) por 10 minutos y luego se lavaron tres veces con agua destilada; finalmente, se colocó un portaobjetos.Se utilizó un microscopio de fluorescencia equipado con un filtro de excitación de 515-560 nm. Los núcleos se fotografiaron a una magnificación de 10X y 40X usando una película de color ASA 400 de 35. La migración se determinó midiendo la longitud de la cola a partir del centro del núcleo. Se midió un número variable de núcleos seleccionados al azar de cada grupo experimental (7).
Análisis estadístico
El efecto de la dosis del químico sobre la migración de la cola de ADN se analizó a un nivel de significación de 0.05. Las diferencias entre los valores de los testigos y los valores de cada concentración de los compuestos probados en ambas pruebas se investigaron con la prueba de la t de Student (12).
Resultados
Tradescantia
Se calculó la frecuencia de mutación rosa obtenida de los días 7 al 15 después del tratamiento con EMS, MH y NDEA en duplicados y los resultados se presentan en la tabla I.
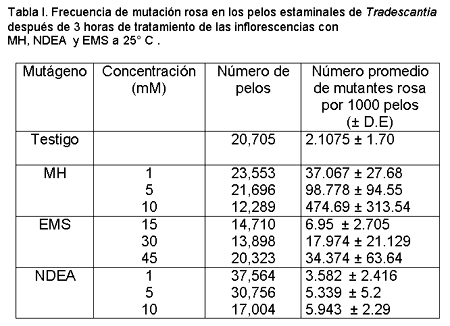
El número de pelos observados fue diferente en cada tratamiento dependiendo del número de flores disponible. La frecuencia de mutación del grupo control fue de 2.1075 ± 1.70 (DE). Los tres mutágenos mostraron un incremento en su frecuencia de mutación cuando se compararon con el grupo control. Para EMS e HM se observó una relación lineal entre la dosis y la frecuencia. NDEA 10 mM indujo un frecuencia de mutación similar a la concentración de 5 mM. La MH indujo la más alta frecuencia de mutación rosa de todas las concentraciones.
Prueba del cometa
La metodología reportada por Singh et al. (7) resultó efectiva para los núcleos celulares de los pelos estaminales de Tradescantia . Optimizamos la técnica hasta hacerla reproducible y se observó que las condiciones de aislamiento y congelamiento de los núcleos aquí empleados no afectaron la integridad del ADN.En la tabla II se presenta la media de la longitud de la cola de los núcleos estaminales de Tradescantia expuestos a diferentes mutágenos. Se emplearon dos portaobjetos por cada una de las concentraciones de los mutágenos; sin embargo, el número de núcleos fue diferente. Los portaobjetos expuestos a MH 10 mM, NDEA 5 y 10 mM presentan un bajo número de núcleos debido posiblemente al elevado daño en el ADN y ello provocó gran longitud de la cola haciendo imposible las mediciones.

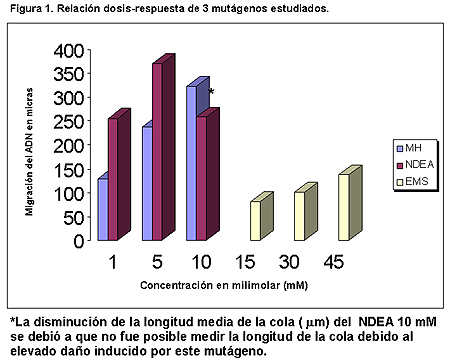
Se calculó la media y la desviación estándar de cada grupo y se observó un incremento significativo (p 0.0001) en la longitud de la cola en los núcleos celulares de los pelos estaminales expuestos a cada uno de los mutágenos (tabla II). Los tres mutágenos presentaron clara actividad mutagénica relacionada con la longitud de la cola y la concentración. La mayores concentraciones ocasionaron una alta heterogeneidad en la migración del ADN.Tanto la prueba de mutación rosa en Tradescantia como la prueba del cometa en los núcleos estaminales de la misma planta detectan actividad mutagénica dependiente del mutágeno estudiado (tablas I y II). Con la prueba de mutación rosa NDEA se observó la más baja actividad mutagénica, pero en cambio, presentó alta actividad mutagénica cuando se utilizó la prueba del cometa en los núcleos celulares de los pelos estaminales de Tradescantia . Se observó una relación directa entre los tres mutágenos, la dosis y la longitud de las colas (figura 1). Es evidente que NDEA es el más potente mutágenos seguido por MH y EMS.
Nuevos resultados
El glifosato, un herbicida ampliamente utilizado, resulto ser un contaminante ambiental. Los resultados de la evaluación de la actividad genotóxica del glifosato con las dos pruebas mencionadas se presentan en las tablas III y IV. No fue posible evaluar con certeza la actividad genotóxica del glifosato con la prueba de mutación rosa en los pelos estaminales de Tradescantia porque induce la aclaración de las células (tabla III). En cambio se observó alta genotoxicidad del glifosato con la prueba del cometa en los núcleos de los pelos estaminales de la misma planta (tabla IV). La media de migración de la cola fue de 53.60, un valor estadísticamente significativo ( p< 0.01) al compararlo con los presentados por el glifosato. Al parecer, la genotoxicidad está en función de la concentración: bajas diluciones (altas concentraciones) inducen mayores migraciones


Discusión
La prueba de mutación rosa en los pelos estaminales de Tradescantia ha sido ampliamente utilizada para detectar la actividad mutagénica (2,4-6, 32,33). En este estudio se emplearon tres mutágenos de referencia: MH, NDEA y EMS en concentraciones bien establecidas. Los datos se compararon y fueron similares a otros estudios (2,12-14,33,34). Con esta simple y eficiente prueba los resultados experimentales pueden obtenerse en pocos días (6). En algunas ocasiones es necesario obtener información en el menor tiempo posible; sin embargo, el protocolo en Tradescantia incluye la recolección de datos durante 9 días, generalmente del día 7 al 15 después de la aplicación del mutágeno. En cambio, la prueba del cometa produce resultados en pocas horas y requiere muy pequeño número de células (7,35,36). Esta prueba se ha empleado en una gran variedad de células de mamíferos y en peces (7,10,37-39). Aunque frecuentemente se considera que 20 núcleos son suficientes para tener resultados confiables, es mejor utilizar de 50 a 100 células o núcleos. Recientemente la prueba del cometa se empleó en núcleos de diferentes plantas y demostró ser confiable y eficiente (12-29). Gichner y Muhlfeldova (23) realizaron la prueba del cometa en diez diferentes plantas, demostrando lo dicho anteriormente: la prueba del cometa puede ser empleada en cualquier planta (12,25). Al parecer, también se puede emplear la prueba del cometa para estudiar plantas mutantes expuestas a genotóxicos (22). En estos reportes la metodología incluye la necesidad de romper la pared celular y aislar los núcleos mediante centrifugación en un gradiente de densidad. La prueba del cometa en los núcleos de los pelos estaminales de Tradescantia resulta más sencilla que otros métodos en tejidos de otras plantas porque basta realizar un "aplastado" y después los núcleos son filtrados y separados. No es necesario el uso de nitrógeno líquidos ni la centrifugación con un gradiente de densidad. Los pasos siguientes son los mismos que empleo Singh et al. (7). Los núcleos de Tradescantia son más grandes que los de otras plantas y pueden ser fácilmente observados y medidos a 10X. Debido a que el tamaño del núcleo es muy heterogéneo (las células cercanas al tallo del estambre son más grandes que las células terminales del pelo estaminal) el análisis estadístico presentó alta desviación estándar que pueden ser disminuidas mediante el conteo de un alto número de células.
La prueba del cometa en los núcleos de los pelos estaminales Tradescantia puede ser usada de dos formas: (a) con núcleos de plantas no tratadas para inducir daño genético in vitro y (b) con núcleos de plantas tratadas (in vivo). Utilizamos la segunda opción para poder aplicar condiciones experimentales similares en ambos ensayos y lograr una buena comparación. Aunque la prueba del cometa in vivo lleva más tiempo que la prueba in vitro , aún así es más corta que la clásica prueba de mutación rosa en Tradescantia . En este caso los núcleos obtenidos entre los días 10 al 14 presentaron un fuerte efecto mutagénico. Cuando comparamos los dos sistemas es muy importante tener una clara idea de lo que cada sistema mide; la prueba de mutación rosa mide mutaciones, mientras que la prueba del cometa al pH usado evalúa clastogenicidad. Una alta migración de la cola puede ser comparada con una alta frecuencia de mutación rosa.
El efecto mutagénico de los tres mutágenos (EMS, MH y NDEA) fue evidente en ambos casos especialmente con la prueba del cometa (p 0.0001). Estos resultados son similares a otros reportados con Tradescantia y la prueba del cometa, a iguales o casi iguales concentraciones, ambos en mamíferos y células de plantas (14,16,17, 33,34,40).
Se observaron algunas dificultades con las más altas concentraciones de MH (10 mM) y NDEA ( 5 y 10 mM) debido, probablemente, a un daño extremo en el ADN. En estas condiciones, la longitud de la cola no pudo ser medida apropiadamente. Aunque se ha informado que NDEA es un mutágeno potente, su efecto mutagénico no fue muy claro con la prueba de mutación rosa en Tradescantia con 1,5 y 10 mM; sin embargo, cuando nosotros aplicamos las mismas concentraciones en la prueba del cometa en los pelos estaminales de Tradescantia, se observó gran daño genético (la alta dispersión del ADN hizo difícil la medición de la longitud de la cola y como consecuencia pocas células se incluyeron en el análisis estadístico) ( tabla II). Por otro lado, el daño genético inducido por HM 10 mM fue más evidente con la prueba de mutación rosa.
En la figura 1 se presenta una relación directa entre la longitud de la cola y la dosis de los tres mutágenos y, como se observa, pocos núcleos tratados con 10 mM NDEA se midieron por la alta difusión del DNA dañado. La prueba del cometa en los núcleos de Tradescantia es tan sensible como la prueba del cometa en las células de mamíferos, por ello, puede ser un monitor útil de agentes genotóxicos peligrosos para cualquier organismo, no solo para los humanos. Los resultados de estudios en células de plantas pueden extrapolarse a los sistemas animales y muchos mutágenos fueron primero detectados en vegetales, por ello, su importancia (41). Este trabajo junto con otros demuestran que es posible efectuar la prueba del cometa en cualquier célula y se puede emplear en plantas de las que se sospeche contacto con mutágenos (raíces expuestas a pesticidas, plantas silvestres expuestas a contaminantes, etc.). La prueba del cometa en los núcleos de Tradescantia puede ser una útil y económica herramienta cuando agentes genotóxicos se emplean en interiores (fábricas por ejemplo). En este sentido y como parte de los objetivos iniciales del trabajo, se decidió emplear la prueba del cometa en los núcleos estaminales de Tradescantia para estudiar agentes genotóxicos encontrados como contaminantes ambientales. El glifosato, por ejemplo, es un herbicida ampliamente utilizado en diversas partes del mundo y del cual existen serias contradicciones respecto a su genotoxicidad: Clements et al. (42) y Peluso (43) demostraron, con la prueba del cometa, que el glifosato induce rupturas en el ADN en células de ratón y Rana catesbeiana. Li y Long (44) también comunicaron su efecto mutagénico en S. typhimurium, E. coli, B. subtilis, hamster chino y médula ósea de ratón. El programa Internacional de seguridad Química (IPCS) (45) informó un incremento en la incidencia de tumores testiculares de ratón. En Drosophila melanogaster, Kaya et al. (46) encontraron efecto genotóxico directo del glifosato. Alvarez-Moya et al. (47) asociaron el daño genético y la "marchitez del agave" con el uso del glifosato en cultivos de Agave tequilana. Sin embargo, varios autores (48-50) informaron ausencia de genotoxicidad del glifosato. Estas diferencias pueden atribuirse a la distinta sensibilidad de los sistemas de prueba, la cual depende de factores como el manejo experimental y tipo de organismo utilizado (51). Nuestros estudios con la prueba del cometa en Tradescantia mostraron claramente que no todos los sistemas de prueba son adecuados para cualquier genotóxico; el glifosato, por ejemplo, estudiado con la prueba de mutación rosa en Tradescantia produjo la aclaración de las células estaminales e hizo imposible distinguir entre células rosa y azules. Los resultados mostrados en la tabla III muestran la dificultad de la lectura y no se observan resultados concluyentes, además de que, dependiendo de la experiencia, iluminación y criterio del observador, los resultados mostrarán amplia variabilidad. Es probable que la polémica respecto de la genotoxicidad del glifosato esté relacionada con los diferentes sistemas empleados. La prueba del cometa tiene la particularidad de detectar daño genético directamente en el ADN. En este caso, como se observa en la tabla IV, el glifosato sí presenta actividad mutagénica con la prueba del cometa en los núcleos estaminales. Es claro que el sistema de prueba empleado en la detección de genotóxicos es fundamental, como en este caso para el glifosato: la prueba del cometa en Tradescantia sí detecta genotoxicidad, pero la prueba de mutación rosa en la misma planta no lo hace. Aunque los estudios de este herbicida son preliminares (estamos conscientes de que el número de núcleos debe incrementarse) la aplicabilidad de la prueba en la detección de este herbicida es evidente.
Aunque uno de los propósitos del presente trabajo fue proponer el uso de los núcleos de Tradescantia cometizados como un nuevo biomonitor de genotoxicidad, es evidente de acuerdo con posteriores publicaciones que la prueba del cometa es factible de realizar en cualquier célula vegetal; entonces ¿por qué no utilizar las plantas, silvestres o cultivadas, que estén en contacto directo con los agentes de quienes sospechamos que poseen actividad mutagénica Existen infinidad de plantas (pastos, por ejemplo) que crecen directamente en cuerpos de agua contaminados o expuestos a químicos emitidos por industrias o bien en contacto con la contaminación urbana. En todos estos casos podemos dejar de utilizar biomonitores específicos y sólo recabar las plantas de sitios determinados. De la misma manera, los cultivos comerciales expuestos a diferentes pesticidas pueden estudiarse y observar si existe daño genético inducido por las sustancias agregadas. En este sentido, nuestro grupo publicó un estudio que determinó daño genético en células de Agave tequilana enfermas (marchitez del agave) (47).
Suele ser frecuente que un agente químico no presente mutagenicidad en un sistema de prueba. Ello no excluye la posibilidad de que sí lo sea, por lo que es preferible medir el efecto mutagénico directamente sobre los individuos de interés; por supuesto, esto no significa que los bioensayos en organismos de prueba dejen de emplearse en estudios genotoxicidad.
Dado que como consecuencia de la mutación inducida por genotóxicos se pueden observar daños en la descendencia de los organismos, resultaría ventajoso trabajar con polen y analizar posible daños genéticos ya que la colecta es fácil y las células ya están separadas, si bien hay que romper la pared celular. Nuestro grupo esta enfocado en este sentido.
Aunque es posible realizar la prueba del cometa en cualquier célula vegetal, los esfuerzos futuros deben o deberían orientarse a simplificar y economizar la prueba. Actualmente la prueba resulta económica una vez que se tiene el equipo, pero adquirirlo resulta costoso. En adición, los diversos programas para analizar cometas son caros, aunque existen algunos gratuitos (52). En cuanto a la metodología, vale la pena mencionar algunas experiencias que pueden resultar útiles: es frecuente escuchar comentarios acerca de que la lámina de agarosa sobre la laminilla se desprende durante la manipulación, lo que, evidentemente, termina con el experimento. Estas contingencias pueden evitarse con sólo efectuar algunas líneas con el lápiz marca vidrio (dejando libre la zona de observación) lo que garantiza buena adherencia. Otro problema que conduce al desprendimiento del gel es el hecho de que se coloquen cubreobjetos sobre la agarosa fresca con la finalidad de proporcionar una superficie lisa. Esta manipulación resulta innecesaria ya que la superficie lisa se puede obtener con sólo estilar el gel líquido.
En conclusión, la prueba del cometa en los núcleos estaminales de Tradescantia es un efectivo, simple y rápido procedimiento para obtener información respecto de la mutagenicidad. Puede ser usada para estudiar mutágenos ambientales peligrosos para los seres humanos y otros organismos. No se plantea descartar la prueba de mutación rosa en Tradescantia , porque ella es de gran utilidad; el objetivo consiste en utilizarla como un sistema útil y complementario para obtener resultados en poco tiempo.
El hecho de que la prueba del cometa se informe en diversas plantas corrobora lo mencionado en trabajos previos: es posible realizar la prueba en cualquier célula vegetal. Ahora el reto será emplearla en plantas de importancia comercial o aquellas que, sin ser biomonitores, están en contacto con genotóxicos y por lo tanto nos pueden aportar información respecto de la integridad de su ADN. Por otra parte, es importante hacer más accesible la metodología a laboratorios modestos ya que los costos del equipo y programas son prohibitivos, si bien ya instalados la prueba es bastante económica.