EXPRESION DE LA PROTEINA DEL SHOCK TERMICO 70 INDUCIBLE POR ESTRES Y SU ARNM EN AORTA DE CONEJO EN LA ATEROESCLEROSIS
(especial para SIIC © Derechos reservados)
Coautores
Uma Singh* Geetanjali Bansal*
PhD., Panjab University, Chandigarh-, India*
Recepción del artículo: 24 de julio, 2003
Aprobación: 0 de , 0000
 Conclusión breve
Los autores demuestran que el estrés celular inducido por una alimentación aterogénica, produce la síntesis de la proteína del shock térmico a nivel de los vasos afectados. Discuten el posible efecto cardioprotector de estas proteínas. El presente estudio muestra que las células de la pared vascular están sujetas a importante estrés durante el desarrollo de la placa ateromatosa.
Conclusión breve
Los autores demuestran que el estrés celular inducido por una alimentación aterogénica, produce la síntesis de la proteína del shock térmico a nivel de los vasos afectados. Discuten el posible efecto cardioprotector de estas proteínas. El presente estudio muestra que las células de la pared vascular están sujetas a importante estrés durante el desarrollo de la placa ateromatosa.
 Resumen
Varios factores proaterogénicos también pueden producir respuesta al estrés. El presente estudio compara la aorta de conejos normales y ateroescleróticos con respecto a la expresión y localización de la proteína de shock térmico 70 (hsp70) y su ARNm. Los niveles séricos de colesterol y triglicéridos aumentaron significativamente con la alimentación basada en una dieta elevada en grasas. La hsp70 fue demostrada con métodos inmunohistoquímicos y su ARNm se detectó mediante hibridación in situ con un oligonucleótido explorador, que reconoció únicamente la transcripción de hsp70 inducible por estrés. La aorta normal mostró una distribución homogénea de hsp70, mientras que la aorta ateroesclerótica, caracterizada por distribución heterogénea, con zonas alrededor de los focos de necrosis mostraba elevada expresión de hsp70. La expresión de hsp70 inducible no fue detectable en la aorta normal, pero pudo observarse intensa tinción en la aorta ateroesclerótica, particularmente en las células espumosas del área de la placa. La presente investigación muestra que las células de la pared vascular están sometidas a importante estrés durante el desarrollo de la placa ateroesclerótica y centra su estudio en la regulación de la transcripción de hsp70 inducible, en condiciones aterogénicas.
Resumen
Varios factores proaterogénicos también pueden producir respuesta al estrés. El presente estudio compara la aorta de conejos normales y ateroescleróticos con respecto a la expresión y localización de la proteína de shock térmico 70 (hsp70) y su ARNm. Los niveles séricos de colesterol y triglicéridos aumentaron significativamente con la alimentación basada en una dieta elevada en grasas. La hsp70 fue demostrada con métodos inmunohistoquímicos y su ARNm se detectó mediante hibridación in situ con un oligonucleótido explorador, que reconoció únicamente la transcripción de hsp70 inducible por estrés. La aorta normal mostró una distribución homogénea de hsp70, mientras que la aorta ateroesclerótica, caracterizada por distribución heterogénea, con zonas alrededor de los focos de necrosis mostraba elevada expresión de hsp70. La expresión de hsp70 inducible no fue detectable en la aorta normal, pero pudo observarse intensa tinción en la aorta ateroesclerótica, particularmente en las células espumosas del área de la placa. La presente investigación muestra que las células de la pared vascular están sometidas a importante estrés durante el desarrollo de la placa ateroesclerótica y centra su estudio en la regulación de la transcripción de hsp70 inducible, en condiciones aterogénicas.
 Palabras clave
Proteína del shock térmico, ARNm, transcripción, hibridación, expresión, ateroesclerosis
Clasificación en siicsalud
Palabras clave
Proteína del shock térmico, ARNm, transcripción, hibridación, expresión, ateroesclerosis
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/20026
Especialidades
 Principal: Cardiología,
Principal: Cardiología,
 Relacionadas: Cardiología, Cirugía,
Relacionadas: Cardiología, Cirugía,
 Enviar correspondencia a:
Enviar correspondencia a:
Prof. M.P. Bansal, Department of Biophysics, Panjab University, Chandigarh-160 014, India. Ph. +91 172 534120
EXPRESSION OF STRESS-INDUCIBLE HEAT SHOCK PROTEIN 70 AND ITS MRNA IN RABBIT AORTA DURING ATHEROSCLEROSIS
 Abstract
Abstract
Several proatherogenic factors can also activate a stress response. The present study compared normal and atherosclerotic aorta of rabbits with respect to expression and localization of heat shock protein 70 (hsp70) and its mRNA. Serum cholesterol and triglycerides levels increased significantly on high fat diet feeding. Hsp70 was demonstrated immunohistochemically and hsp70 mRNA was detected by in situ hybridization with an oligonucleotide probe that recognized only stress-inducible transcripts of hsp70. Normal aorta showed homogeneous distribution of hsp70 while atherosclerotic aorta depicted by heterogeneous distribution with areas around foci of necrosis showing high hsp70 expression. Inducible hsp70 mRNA expression was not detectable in normal aorta but intense staining was seen in atherosclerotic aorta, particularly foam cells of the plaque area. The present investigation shows that cells of the vascular wall are subjected to extreme stress during atherosclerotic plaque development and points towards transcription regulation of inducible hsp70 expression under atherogenic conditions.
 Key words
Key words
Proteína del shock térmico, ARNm, transcripción, hibridación, expresión, ateroesclerosis
EXPRESION DE LA PROTEINA DEL SHOCK TERMICO 70 INDUCIBLE POR ESTRES Y SU ARNM EN AORTA DE CONEJO EN LA ATEROESCLEROSIS
(especial para SIIC © Derechos reservados)
Artículo completo
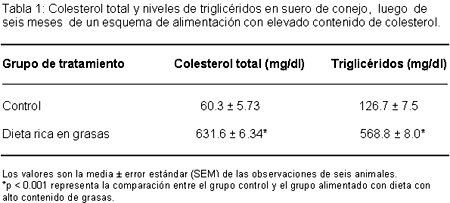
IntroducciónLas lesiones ateroescleróticas son el resultado de modificaciones metabólicas y estructurales que tienen lugar sobre la cara luminal de la íntima y en la pared vascular. Los principales componentes de la placa avanzada, los macrófagos cargados de lípidos o las células espumosas y el centro necrótico que incluye detritos celulares, cristales de colesterol, ésteres del colesterol y calcio, son el resultado de estos cambios. Muchos factores favorecedores del ateroma, como los radicales oxígeno,1 derivados oxidados del colesterol,2 citoquinas,3 lipoproteínas modificadas4 y estrés mecánico,5 son citotóxicos y puedan también activar una respuesta al estrés.La respuesta al estrés representa un programa celular de defensa universalmente conservado. Las proteínas del estrés o proteínas del shock térmico son una familia de aproximadamente dos docenas de proteínas que están subdivididas a su vez en subfamilias (integradas por varios miembros) basadas en el peso molecular de las proteínas. La hsp70 es una de las proteínas del shock térmico más investigada en el campo de la ateroesclerosis. Está demostrada la presencia de hsp70 en la lesión ateroesclerótica humana6 y algunos autores sugieren que esta enfermedad altera la localización de hsp70 en la aorta humana y del macaco.7Ambos estudios, consideraron tanto el hsp70 constitucional como el hsp70 inducido. Ningún estudio hasta ahora publicó la regulación de la expresión del hsp70 a nivel de la transcripción, bajo condiciones aterogénicas, in vivo. El objetivo del presente estudio fue la evaluación de la expresión y la distribución espacial del hsp70 y del ARNm inducibles, en lesiones ateroescleróticas.Material y métodosTratamiento de animalesSe obtuvieron conejos machos blancos de Nueva Zelanda (1 a 1.2 kg de peso) del Experimental Animal Facility, Institute of Microbial Technology de Chandigarh y divididos de manera aleatoria en dos grupos de 6 conejos cada uno. Los animales alimentados con dieta alta en grasas recibieron una dieta rica en colesterol (0.5 g de colesterol y 10 g de manteca de mesa en 100 g de raciones para conejos) durante 6 meses. Los conejos utilizados como control fueron alimentados con alimento normal. Podían tomar agua libremente. Completados los 6 meses, el peso de los conejos fue registrado en cada grupo. Se les extrajo sangre de la vena marginal de la oreja, en condiciones de ayuno y se preparó el suero a partir de la sangre, según lo descrito por Gupta.8 Todas las determinaciones en el suero fueron realizadas inmediatamente después del aislamiento. Luego del análisis del suero, los conejos fueron sacrificados mediante la inyección intravenosa de fenobarbital sódico y la aorta fue utilizada inmediatamente para varios estudios.Medición del perfil lipídico basalSe determinaron los niveles de colesterol total y triglicéridos en suero de los conejos controles y del grupo alimentado con dieta rica en colesterol.Colesterol total sérico: se midió por el método de Chiamori y Henry.9 Los valores obtenidos fueron expresados en mg de colesterol por dl de suero.Triglicéridos: se determinaron utilizando el Tryglycerides (GPO) Reagent Set (Pointe Scientific Inc., MI, EE.UU.). El kit contaba con muestras estándar de triglicéridos. Los valores obtenidos fueron expresados en mg/dl de suero.Localización inmunohistoquímica de las proteínas del shock térmico 70 (hsp70)Los cortes transversales de porciones de aorta fresca normal y con lesiones fueron fijadas en formol al 10% neutral y con solución amortiguadora (buffer) y luego procesados y sumergidos en parafina. Cortes transversales de aorta de 8 micrones de espesor fueron desparafinados con xilol y rehidratados con una serie de alcoholes de distintos grados. La actividad de la peroxidasa endógena fue bloqueada mediante la incubación con agua oxigenada al 3% por 30 minutos a temperatura ambiente. La incubación en BSA al 2% en solución salina amortiguada con fosfato (PBS; 0.01 M, pH 7.2) por 30 minutos a temperatura ambiente, bloqueó la tinción no específica.Los cortes fueron luego incubados durante 2 horas con anticuerpo monoclonal contra hsp70 (1:3 000; Sigma Immunochemicals, St. Louis, EE.UU.) diluido en solución salina con buffer de fosfato y 1% de BSA.El anticuerpo reconoce tanto hsp70 constitucional como la forma inducible. Para el control negativo, sólo se agregó diluyente (solución salina con 1% de BSA).Los cortes fueron luego incubados con suero de cabra anti-IgG de ratón marcado con biotina, seguido de peroxidasa de rábano marcado con streptavidina (extracto de peroxidasa del kit de Sigma Immunochemicals, St. Louis, EE.UU.).El producto de reacción se obtuvo usando diaminobenzidina (8 mg en 10 ml de solución salina amortiguada con fosfato) más 100 microlitros de agua oxigenada al 3%. La reacción finalizó mediante el lavado con agua destilada y los cortes fueron montados en jalea de glicerol.Hibridación in situ del ARNm con oligonucleótido específico para hsp70El presente estudio utilizó un oligonucleótido sintético de 30 bases marcado con biotina (5`-CGATCTCCTTCATCTTGGTCAGCACCATGG-3`), que reconoce selectivamente solo el hsp70 inducido por el estrés en la rata. El oligonucleótido es complementario a la secuencia de ARNm transcripto del hsp70 humano y que codifica los aminoácidos 21-30.10Cortes en frío de 10 micrones fueron preparados a partir de tejido aórtico fresco y montados en portaobjetos cubiertos de poly-L-licina y conservados a -70 ºC hasta su uso. Antes de la hibridación, los preparados fueron rápidamente llevados a temperatura ambiente, enjuagados una vez con solución salina y luego 2 veces con 2X SSC (Stock 20X SSC: 0.3 M de citrato de sodio, 3 M cloruro de sodio, pH 7.0) La actividad de la peroxidasa endógena fue bloqueada con agua oxigenada al 3% y los cortes fueron deshidratados en concentraciones crecientes de alcohol. La prehibridación fue realizada en buffer de prehibridación (50% de formamida, 20% de sulfato de dextran, 5X Denhardt\'s, 10 mM de fosfato de sodio, 5X SSC, 100 μg/ml de ADN de esperma de salmón desnaturalizado) durante 15 minutos a 41ºC, seguido de hibridación con 0.5 μg/ml de nucleótido de exploración a 41ºC por 4 horas en cámara húmeda. Los cortes hibridados fueron lavados secuencialmente en formamida al 50%/5X SSC a 37ºC, 2X SSC a 37ºC y 1X SSC a temperatura ambiente. La tinción no específica fue bloqueada con solución bloqueante (1% BSA en PBS) por 30 minutos a 37ºC seguido de incubación por 30 minutos a 37ºC, y luego incubación con solución de peroxidasa de rabanito con streptavidina marcada a 42ºC. Luego del lavado con solución al 0.1% Tween-20 en solución salina fosfatada precalentada a 42ºC los cortes fueron incubados con diaminobenzidina adicionada con agua oxigenada. La reacción fue detenida mediante lavado con solución salina fosfatada. Los controles negativos fueron tratados siguiendo el mismo protocolo, pero sin el agregado del nucleótido explorador. Los cortes fueron montados en glicerol al 90% y observados y fotografiados con un microscopio invertido (Olympus, Tokio, Japón).ResultadosPerfil lipídico básico del sueroEl colesterol total sérico y niveles de triglicéridos (Tabla 1) fueron medidos para obtener el perfil lipídico sérico de los conejos, después de seguir diferentes esquemas dietarios. Los conejos alimentados con una dieta elevada en grasas por 6 meses mostraron un significativo incremento en la concentración del colesterol total (p < 0.001), los triglicéridos presentaron similar incremento (p < 0.001) comparados con los conejos de control.
Localización inmunohistoquímica del hsp70Mientras que la aorta de los conejos de control mostró histología normal, los animales alimentados con dieta elevada en grasas durante 6 meses, presentaron placas similares a lesiones ateroescleróticas avanzadas en la aorta. La figura 1 muestra los patrones de la inmunotinción del hsp70 en la aorta de los conejos control. La reacción no específica fue mínima en los controles negativos (no mostrado).

Figura 1. Sección aórtica de conejo control, de inmunotinción para proteína de shock térmico 70 (hsp70). Se observa distribución frágil, homogénea de hsp70. Luz (L); media (M). x250.
La aorta de los conejos control contenía hsp70 distribuido de manera homogénea en la íntima y media. La aorta ateroesclerótica mostró tinción heterogénea, con áreas fuertemente inmunoteñidas adyacentes a otras zonas con mucho menor contenido de hsp70 (Fig. 2). Mientras que la expresión del hsp70 fue principalmente intracelular y mayor en el casquete fibroso y alrededor de las zonas de necrosis, típicamente en la porción central de la placa, la inmunotinción fue casi nula en las áreas de necrosis y vacuolización.

Figura 2. Distribución de hsp70 en aorta de conejo alimentado condieta rica en grasas durante 6 meses. Se observa inmunotinción fuerte en el casquete fibroso (F) y en la región central de la placa fibrosa (P). Areas de intensa inmunotinción con áreas adyacentes de tinción atenuada (punta de flecha) pueden apreciarse con claridad. Luz (L); media (M). x100.
Expresión del ARNm de hsp70Para estudiar los niveles de ARNm que codifica el hsp70 inducible, en los cortes de aorta de conejos control y de los alimentados con dieta rica en grasas, cortes en frío de un espesor de 10 μ fueron hibridados con oligonucleótido explorador de 30 bases y biotina marcada, específico para la detección de transcripciones de hsp70 inducible. La tinción no específica fue mínima en los controles negativos (no mostrado).La aorta de los conejos utilizados como control no mostró niveles detectables de ARNm que codifica hsp70 (Fig. 3). Sin embargo, en la íntima de la aorta ateroesclerótica pudo observarse intensa tinción (Fig. 4).

Figura 3. Sección aórtica de conejo control, con hibridación con oligonucleótido de investigación específico para ARNm de hsp70 inducible. No se observó tinción alguna detectable. Luz (L); media (M). x250.

Figura 4. Sección aórtica de conejo alimentado con dieta rica en grasas durante seis meses que muestra la expresión de ARNm de hsp70 inducible. Se observó elevada expresión en la placa (P), con una señal relativamente débil en la media (M). x250.
En las placas avanzadas pudo observarse alta expresión del ARNm del hsp70 en la capa fibrosa y la cubierta endotelial así como en la región de la íntima cercana a la media. La señal de hibridación fue principalmente observada en los macrófagos cargados con colesterol (células espumosas) ubicadas en la placa (Fig. 5).

Figura 5. Placa (P) en aorta de conejo alimentado durante seis meses con dieta rica en grasas, que muestra expresión de ARNm de hsp70 inducible, en las células espumosas. Media (M). x400.
Un análisis comparativo entre los estudios inmunohistoquímicos y la hibridación in situ, indicó que el incremento de la expresión de hsp70 guardaba correlación con el aumento en la expresión de ARNm del hsp70 en las lesiones ateroescleróticas avanzadas, especialmente en las células espumosas.DiscusiónLa ateroesclerosis es una enfermedad lentamente progresiva que está definida por la infiltración de células mononucleares, proliferación celular y acumulación de lípidos en la íntima de la pared arterial. La expresión de las proteínas del shock térmico es una respuesta común a una variedad de condiciones adversas, como temperatura elevada, exposición a radicales de oxígeno, metales pesados, etc.11Crecientes evidencias indican que las proteínas del shock térmico, particularmente hsp70, podrían tener un papel en la ateroesclerosis. En el presente estudio hemos usado el conejo, que es un animal frecuentemente utilizado en el modelo de aterogénesis inducida por la dieta.El perfil lipídico sérico basal y el examen histológico de aortas de conejos alimentados con dieta aterogénica y controles sugirieron que la alimentación aterogénica produce un importante estrés sobre las células de la pared aórtica. El presente estudio demuestra que la expresión de hsp70 estaba aumentada en las lesiones ateroescleróticas. La distribución de hsp70 dentro de la pared aórtica también fue diferente: homogénea a través de toda la media en el grupo control y heterogénea en el grupo con alimentación aterogénica.También la expresión de hsp70 estaba incrementada en la zona de la placa, aunque la media también mostraba expresión de hsp70.El aumento de la expresión de hsp70 ha sido observado tanto en humanos como en macacos.6,7 Estos resultados también están de acuerdo con los hallazgos de Zhu y col.,12,13 las LDL oxidadas que son un potente factor aterogénico, inducen la expresión de hsp70 en cultivo de células endoteliales y músculo liso.Por otro lado, algunos componentes de la placa parecerían inhibir, según se sugirió, la síntesis de hsp70 in vivo.7Nuestros estudios previos in vitro realizados sobre macrófagos, indican que el 7 β-hidroxicolesterol podría ser uno de estos componentes de la placa.14 Esto podría explicar la heterogeneidad de la expresión de hsp70 dentro de la placa. Las áreas de intensa inmunotinción podrían representar células con resistencia aumentada a diversos tipos de estrés: mecánico, químico y oxidativo, al que están sometidos en la placa. En contraste, las zonas adyacentes con mínima existencia de expresión de hsp70, podrían representar áreas con síntesis disminuida de hsp70 y por lo tanto centros de necrosis de la placa en expansión y evolución.Los resultados de la hibridación in situ indican un sitio específico de inducción de niveles de hsp70 en las lesiones ateroescleróticas. La ausencia de cualquier señal detectable en la aorta de los conejos de control prueba la especificidad del explorador de la transcripción de hsp70 inducible.En el presente trabajo el anticuerpo monoclonal utilizado para detectar hsp70, reconoce ambos, tanto el constitucional como el inducido. El oligonucleótido explorador usado para la detección del ARNm de hsp70, por otro lado, es específico para la transcripción del ARNm que codifica hsp70 inducido. En vista de esto, la comparación de la expresión de hsp70 (estudio inmunohistoquímico) y la expresión de su ARNm en la aorta de los conejos control, indica que la expresión de hsp70 observada por inmunohistoquímica en la capa media de la aorta control es debida a hsp70 constitucional únicamente.La expresión del ARNm de hsp70 inducida en la capa media de la aorta aterosclerótica, comparada con la ausencia de cualquier señal en la aorta control revela que las células en condiciones ateroescleróticas están estresadas en comparación con las células en condiciones normales, lo que lleva a la síntesis de hsp70 inducible. Una menor expresión de hsp70 en la capa media, comparada con el área de placa ateroesclerótica, podría explicarse sobre la base de los hallazgos de Manzerra y col.15 y Boshoff y col.,16 respecto de que los niveles mayores de hsp70 constitucional llevan a menor síntesis de hsp70 inducible.La tinción del ARNm de hsp70 inducible fue coincidente con la expresión de hsp70 en la zona de la placa, tal como puede verse en los estudios inmunohistoquímicos, lo que indica que este incremento en los niveles de hsp70 fue debido a un aumento de los niveles de ARNm de hsp70. Esto apunta hacia la inducción transcripcional de la expresión de hsp70.Se piensa que las proteínas del shock térmico juegan un papel en la sobrevida celular.17,18 Se demostró que hsp70 provee cardioprotección durante los fenómenos de isquemia/reperfusión.19,21También se sugirió que la hsp70 inducible tiene una función en el mantenimiento de la homeostasis celular, bajo estrés térmico, oxidativo o de otro carácter ambiental. La expresión aumentada de hsp70 en las células endoteliales, que son un blanco importante durante las lesiones de la pared vascular, puede conferir protección celular contra eventos citotóxicos asociados con la aterogénesis. Esto también significa mayores posibilidades de sobrevida y por lo tanto presencia prolongada de macrófagos cargados con lípidos en las lesiones ateroescleróticas avanzadas. Si esta "citoprotección" en este estadio de la patogénesis de la ateroesclerosis es beneficiosa, es un tema por aclarar. El equilibrio entre ataques proaterogénicos como la toxicidad de LDL oxidadas y la capacidad de las células para soportarlas (respuesta al estrés), afectará la evolución de las lesiones ateroescleróticas.El mecanismo de citoprotección de hsp70 no es claro. Los niveles incrementados de hsp70 previenen la activación de quinasas del estrés en células U937 y células PEER del tumor linfoide humano, y contribuyen de esta forma a la termotolerancia adquirida en estas células.22 Vayssier y col.23 sugirieron que hsp70 confiere protección mediante el desvío de las células que mueren por necrosis hacia la apoptosis. El mecanismo molecular de los efectos de hsp70 sobre las células en estrés oxidativo queda por verse. En nuestro laboratorio, el trabajo en este sentido está en curso.En conclusión, el presente estudio muestra que las células de la pared vascular están sujetas a importante estrés durante el desarrollo de la placa ateromatosa y apunta hacia la regulación transcripcional de la expresión de hsp70 en condiciones aterogénicas.Los autores no manifiestan conflictos.
 Bibliografía del artículo
Bibliografía del artículo
- Quinn MT, Parthasarathy S, Fong LG, Steinberg D: Oxidatively modified low density lipoproteins: a potential role in the recruitment and retention of monocyte/macrophages during atherosclerosis. Proc Natl Acad Sci USA 1987; 84: 2995-2998.
- Guyton JR, Black BL, Seidel CL: Focal toxicity of oxysterols in vascular smooth cell culture: a model of the atherosclerotic core region. Am J Pathol 1990; 137: 425-434.
- Libby P, Hansson GK: Involvement of human immune system in human atherogenesis: current knowledge and unanswered questions. Lab Invest 1991; 64: 5-15.
- Steinberg D, Parthasarathy S, Carew TE, Khoo JC, Witztum JL: Beyond cholesterol. Modification of low-density lipoprotein that increase its atherogenicity. New Engl J Med 1989; 320: 915-924.
- MacMahon S, Peto R, Cutler J, Collins R, Sorlie P, Stamler J: Blood pressure, stroke and coronary heart disease. Lancet 1990; 335: 764-765.
- Berberian PA, Myers W, Tytell M, Challa V, Bond MG: immunohistochemical localization of heat shock protein-70 in normal-appearing and atherosclerotic specimens of human arteries. Am J Pathol 1990; 136(1): 71-80.
- Johnson AD, Berberian PA, Tytell M, Bond MG: Atherosclerosis alters the localization of hsp70 in human and macaque aortae. Exp Mol Pathol 1993; 58: 155-168.
- Gupta, SK: Antisera: Techniques of immunization, use of adjuvants; in Talwar GP (ed.): A handbook of practical immunology. India, Vikas Publishing House Pvt. Ltd., 1983, pp 40.
- Chiamori N, Henry RJ: Study of the ferric chloride method for determination of total cholesterol and cholesterol esters. Am J Clin Pathol 1959; 31: 305-309.
- Udelsman RJ, Blake MJ, Stagg CA, Li D-G, Putney DJ, Holbrook NJ: Vascular heat shock protein expression in response to stress. J Clin Invest 1993; 91: 465-473.
- Roma P, Catapano AL: Stress proteins and atherosclerosis. Atherosclerosis 1996; 127: 147-154.
- Zhu WM, Roma P, Pellegatta F, Catapano AL: Oxidized-LDL induce the expression of heat shock protein 70 in human endothelial cells. Biochem Biophys Res Commun 1994; 200: 389-394.
- Zhu WM, Roma P, Pirillo A, Pellegatta F, Catapano AL: Oxidized-LDL induce hsp70 expression in human smooth muscle cells. FEBS Lett 1995; 372: 1-5.
- Bansal G, Singh U, Bansal MP: Effect of 7-hydroxycholesterol on cellular redox status and heat shock protein 70 expression in macrophages. Cell Physiol Biochem 2001;11:241-246.
- Manzerra P, Rush SJ, Brown IR: Tissue-specific differences in heat shock protein hsc70 and hsp70 in the control and hyperthermic rabbit. J Cell Physiol 1997; 170: 130-137.
- Boshoff T, Lombard F, Eiselen R, Bornman JJ, Bachelet M, Polla BS, Bornman L: Differential basal synthesis of hsp70/hsc70 contributes to interindividual variation in hsp70/hsc70 inducibility. Cell Mol Life Sci 2000; 57(8-9): 1317-1325.
- Johnson AD, Berberian PA, Tytell M, Bond MG: Differential localization of 70-kD heat shock protein in atherosclerosis. Its potential role in arterial SMC survival. Arterioscler Thromb Vasc Biol 1995; 15(1): 27-36.
- Chong K-Y, Lai C-C, Lille S, Chang C, Su C-Y: Stable overexpression of the constitutive form of heat shock protein 70 confers oxidative protection. J Mol Cell Cardiol 1998; 30: 599-608.
- Marber MS, Mestril R, Chi S-H, Sayen MR, Yellon DM, Dillmann WH: Overexpression of the rat inducible 70-kD heat stress protein in a transgenic mouse increases the resistance of the heart to ischemic injury. J Clin Invest 1995; 95: 1446-1456.
- Hutter JJ, Mestril R, Tam EKW, Sievers RE, Dillmann WH, Wolfe CL: Overexpression of heat shock protein 72 in transgenic mice decreases infarct size in vivo. Circulation 1996; 94: 1408-1411.
- Radford NB, Fina M, Benjamin IJ, Moreadith RW, Graves KH, Zhao P, Gavva S, Wiethoff A, Sherry AD, Malloy CR, Williams WS: Cardioprotective effects of 70-kDa heat shock protein in transgenic mice. Proc Natl Acad Sci USA 1996; 93: 2339-2342.
- Gabai VL, Meriin AB, Mosser DD, Caron AW, Rits S, Shifrin VI, Sherman MY: Hsp70 prevents activation of stress kinases. A novel pathway of cellular thermotolerance. J Biol Chem 1997; 272(29): 18033-18037.
- Vayssier M, Banzet N, Francois D, Bellmann K, Polla BS: Tobacco smoke induces both apoptosis and necrosis in mammalian cells: differential effects of hsp70. Am J Physiol 1998; 275 (Lung Cell. Mol. Physiol. 19): L771-L779.
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC




 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a:




