




 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a:
Figura 1. Modelo de la patogenia del lupus eritematoso sistémico. (De C. G. Drake y B. L. Kotzin.)
Se ha propuesto la existencia de predisposición genética a partir de la aparición de LES en dos o más miembros de la misma familia, así como también en gemelos idénticos. Aproximadamente el 10% de los pacientes lúpicos poseen un familiar en primer o segundo grado con esta enfermedad u otra estrechamente relacionada con ella.4-7
La concordancia entre gemelos varía ampliamente, pero es más elevada también en homocigotas (25%-70%) que en heterocigotas (2%-9%).8,9 La asociación entre LES y antígenos HLA determinados genéticamente aporta evidencia más amplia a favor de la influencia genética en el desarrollo de la entidad.
La importancia del ambiente es clara. Las manifestaciones incluyen exacerbación del exantema cutáneo después de la exposición al sol, agravamiento posterior a infecciones virales o bacterianas y modificación en la actividad de la enfermedad después de la administración exógena de hormonas. Está claro también que el tratamiento crónico de pacientes con ciertas drogas induce la producción de anticuerpos antinucleares y enfermedad similar al lupus. La producción de autoanticuerpos en el lupus ha sido abundantemente investigada. La detección de anticuerpos antinucleares y anti linfocitotóxicos (ALT) en familiares que comparten el mismo ámbito con individuos portadores de LES, pero no en parientes que viven alejados de ellos,10,11 fue muy bien recibida por los defensores de la teoría ambiental.
La presentación familiar provee una oportunidad única para analizar la participación relativa de varios marcadores genéticos en la expresión de la enfermedad. Presentamos aquí la síntesis de un estudio que hemos publicado previamente y lo discutimos a la luz de los nuevos hallazgos científicos.
El objetivo de nuestra investigación original fue evaluar el papel de los factores genéticos y ambientales en 26 familias con dos o más miembros afectados por esta enfermedad del tejido conectivo.
Pacientes y métodos
En total participaron 150 individuos, 61 de los cuales padecía LES, y 89 parientes en primer grado sanos. De los 61 enfermos, 44 eran de sexo femenino y 17 masculino con edades en el rango de 15 a 62 años. Todos los pacientes vivos, excepto dos a los que se les había diagnosticado probable LES, cumplían los criterios de la American Rheumatism Association (ARA)12 para LES definido. Siete enfermos con diagnóstico establecido habían fallecido. Se incluyeron 4 pares de gemelos, uno dicigota y tres homocigotas, de 4 familias diferentes.
Cuarenta y dos voluntarios sanos sin historia personal ni familiar de enfermedad del tejido conectivo, y que no recibían ningún tipo de drogas, fueron utilizados como controles para los estudios de anticuerpo anti-linfocitotóxico (ALT) y pareados, según edad, sexo y raza, con familias en las que había casos de LES.
Aunque la tipificación del HLA se realizó sobre 26 familias, la prueba para ALT se llevó a cabo en 9 de ellas y en controles.La asociación entre los alelos del HLA y LES se analizó a través de un test de chi cuadrado con corrección de Yates. Se estableció el nivel de significación en 0.05. Se presentan los intervalos de confianza de 95% para las diferencias en las proporciones. Se empleó la prueba exacta binomial para comparar la proporción observada con la proporción esperada de ambos haplotipos, único y no-separado.
Análisis de separación
Diez de las familias analizadas eran blancas, nueve afro-norteamericanas y siete norteamericanas de origen mexicano. Tal como puede apreciarse en la Tabla 1, no existe ningún tipo hereditario en estos grupos de parientes. Todos los grupos asociados padre/hija/hijo, abuela/madre/nietos, hermano/hermano, hermana/hermana, etc. son factibles. En nuestras series, sin embargo, el más común fue hermana/hermana (31%) y predominaron las mujeres (72%).
HLA-A, B, C / DR y análisis de haplotipo
La tipificación de los pacientes para antígeno de clase I con LES y sus familiares no mostró diferencias significativas en la frecuencia de algún antígeno HLA-A, B, C. No obstante, hubo aumento de la frecuencia de HLA-DR2 en norteamericanos blancos (p = 0.003) pero no en norteamericanos africanos ni mexicanos.
El análisis de haplotipo HLA fue desarrollado en 14 pares de hermanos de ambos sexos concordantes para LES. Gemelos monocigóticos no presentaron HLA idénticos como se podía esperar. Siete pares (50%) eran idénticos para ambos haplotipos, cinco pares (36%) para uno de los dos, y dos pares (14%) no lo fueron para ninguno, aunque la distribución esperada es de 25%, 50% y 25% respectivamente. Los valores fueron estadísticamente significativos.
Anticuerpos anti-linfocitotóxicos
La figura 2 muestra la prevalencia de ALT en pacientes con LES, sus parientes consanguíneos y no-consanguíneos y los familiares controles. Como se ve, 15/18 (83%) pacientes y 11/22 (50%) parientes consanguíneos eran ALT positivos, mientras que sólo fueron positivos 1/9 (11%) parientes no-consanguíneos (cónyuges) y 2/42 (5%) miembros del grupo control. Cuando la frecuencia y el título de los anticuerpos fueron comparados en los pacientes y sus familiares, resultó sencillo notar que estaban más elevados y eran más evidentes en los sujetos con LES.
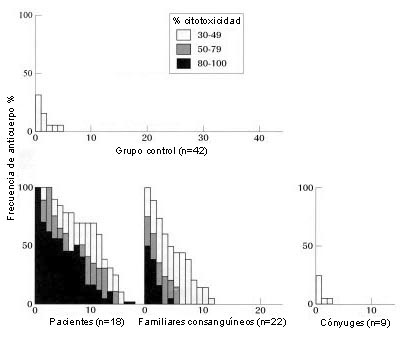
Figura 2. El porcentaje de frecuencia contra el panel celular se representa por barras; esto es, las medias de reactividad del 50% a las que el suero tenía ALT contra la mitad del panel celular.
Discusión
En el LES, la demostración de predisposición genética deriva de varias líneas de pruebas. La primera se basa en la prevalencia de la enfermedad en familias con múltiples casos declarados.4-7 En segundo lugar, hay marcada concordancia en gemelos monocigóticos cuando se los compara con los dicigóticos.8,9 Nuestros estudios refuerzan la evidencia existente acerca de un vínculo genético, tal como lo presentamos aquí en 26 familias de las cuales por lo menos dos miembros se encuentran afectados. Es particularmente interesante ver en tres generaciones la presencia de la entidad, abuela/madre/nieto (tabla 1).

Asimismo en nuestras series, se halló una marcada concordancia entre los gemelos idénticos. Todos los gemelos monocigóticos la presentaban. La asociación entre LES y el sistema HLA da pruebas aun más fuertes. Primero, en 1972, McDevitt y Bodmer informaron asociación entre LES y HLA-B8.13 Lo propio fue anunciado por otros informes estableciendo una relación con HLA-A1, B8, B13, y B17.14-16 Hubo también comunicaciones de presentación simultánea entre la entidad y HLA-DR2 y DR3.17-20 Sin embargo, estos hallazgos no fueron confirmados de manera unánime. En nuestra experiencia no existió asociación con los alelos de HLA clase I. En cambio, se verificó una asociación significativa entre HLA-DR2 y LES en blancos (p = 0.003), pero no en norteamericanos africanos y norteamericanos mexicanos.
A la inversa de informes recientes, nuestros estudios muestran un incremento notable en el HLA compartido entre miembros de la familia afectada. Según ya se mencionó, los gemelos monocigóticos no fueron incluidos en este análisis debido a que se esperaba que tuvieran HLA idéntico. Siete de 14 pares de hermanos de ambos sexos compartían dos haplotipos que diferían significativamente del tipo esperado. No se encontró ningún haplotipo específico común a todos los pares de hermanos. La división del haplotipo es particularmente importante, porque los alelos específicos del HLA solamente pueden ser marcadores para otros todavía indefinidos pero estrechamente ligados a genes que se encuentran dentro de la región HLA. Así la asociación de ciertos haplotipos HLA con la enfermedad en múltiples miembros de una familia puede proveer mayor información genética incluso que los alelos únicos.
Para evaluar el papel de los factores del medio ambiente, examinamos la presencia de ALT en individuos con LES y sus familiares. La figura 2 muestra que 15/18 (83%) de los pacientes y 11/22 (50%) de sus parientes consanguíneos eran positivos para los ALT mientras que sólo 1/9 (11%) de los familiares no-consanguíneos (cónyuges) y 2/42 (5%) en el grupo control resultaron positivos. Estas observaciones son altamente significativas y demuestran que el desarrollo de ALT es debido a un parentesco cercano, no a un contacto cercano. No se verificó relación entre ningún alelo HLA específico y ALT. Hay informes previos, nuestros y de otros investigadores, sobre estos últimos en pacientes con LES.21-24 También fueron descritos en otra enfermedad autoinmune25 y en algunas infecciones virales tales como la mononucleosis infecciosa, sarampión, rubéola,26 y sida.27-29 En estos estudios se concluyó que existía asociación entre ALT e infecciones virales. Aún así, nuestros datos sugieren que se presentan en huéspedes genéticamente predispuestos.No se verificó relación entre el nivel de los ALT y la actividad clínica de la enfermedad.
En resumen, nuestras observaciones confirman los datos de estudios anteriores que indicaban que los factores genéticos poseen un papel determinado en el desarrollo y expresión del LES. Los factores ambientales tal vez pueden disparar la enfermedad en sujetos genéticamente susceptibles.