




 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a:Epidemiología
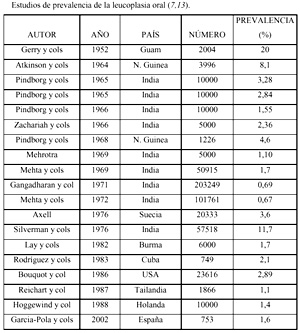
Desde sus primeras observaciones, Schwimmer consideró a esta entidad como una lesión infrecuente, ya que encontró sólo 20 casos en una muestra de casi cinco mil pacientes dermatológicos que estudió durante nueve años (2). Gracias a los diversos estudios epidemiológicos realizados, se han establecido cifras aproximadas de la prevalencia de esta entidad; la cifra real no es conocida, y en la actualidad se la considerada como la lesión precancerosa más frecuente (7). Los datos publicados en la literatura difieren ampliamente entre estudios. Las discrepancias contables son debidas, principalmente, a la falta de homogeneidad del concepto aplicado por los diversos investigadores para realizar el diagnóstico; y también a las variadas particularidades de las muestras estudiadas: edad, etnia, hábitos tóxicos (en especial, el hábito tabáquico) y padecimientos concomitantes de algunas enfermedades.En la población general se han encontrado cifras de prevalencia que oscilan entre 0.2% (8,9) y 11.7% (10). La incidencia anual estimada es de 14 casos por 100.000 habitantes (11). Las cifras obtenidas en estudios realizados en países europeos fluctúan entre 1.4% (Holanda) (12), el 1.6% obtenido en España (13) y el 3.6% hallado en Suecia (14). En los países asiáticos se han realizado numerosos estudios epidemiológicos, sobre todo en el denominado sudeste asiático; en los estudios más importantes, la prevalencia observada varía de 0.6% en China (15), a 1.3% en Malasia (16). En Estados Unidos la cifra de prevalencia encontrada en la población adulta (> 35 años) fue de 2.89% (17).Los estudios realizados en pacientes con algún tipo de patología definida revelan cifras que van de 6.2% en diabéticos (18), 7.6% en pacientes con alteraciones psiquiátricas (19), 10.7% en receptores de trasplante renal (20), a 11% cuando la muestra estudiada estaba integrada por pacientes afectados por enfermedades de la mucosa oral (21).Con respecto a la edad, los estudios epidemiológicos demuestran que es un dato importante a la hora de realizar su diagnóstico, ya que suele diagnosticarse habitualmente a partir de la segunda década de la vida; por encima de los 40 años se observa la mayoría de los casos (70% a 90%) (22,23). Las décadas con mayor afectación son las comprendidas entre los 50 y 60 años en el caso de los hombres (22), y la de 60 a 70 años en las mujeres (24).Los registros de la prevalencia de la leucoplasia oral según el sexo varían entre países. En Europa, los estudios realizados arrojan una relación varón/mujer de 6 a 1 (14) en Suecia, y de 2 a 1 (25), 1.6/1(26), de 4/1 (13) y de 7/1 (27) en España. En Estados Unidos la proporción es prácticamente de 1/1 (22, 28), y en Japón de 2.7/1 (29).
Etiopatogenia
De los datos obtenidos en los numerosos estudios longitudinales efectuados sobre esta entidad, se destaca la multitud de factores con importancia etiopatogénica implicados, tanto en su desencadenamiento como en su desarrollo.Desde la reunión de expertos en Uppsala en 1996, se considera que etiopatogénicamente existen dos tipos de leucoplasias: las leucoplasias idiopáticas y las leucoplasias asociadas al tabaco (6), dado que el tabaco es el único factor desencadenante de leucoplasia oral que estaba aceptado como tal de forma universal (1). En la actualidad, algunos autores como van der Waal y Axell consideran que ambos grupos deberían estar integrados en uno solo, como leucoplasias idiopáticas (30).La prevalencia de las leucoplasias asociadas al tabaco es de 4 (31) a 6 (32) veces mayor que la de las idiopáticas, llegando incluso a encontrarse en algunas muestras que la totalidad de los pacientes diagnosticados con leucoplasia eran fumadores (33).La forma de consumo del tabaco parece ser un factor relativamente influyente que incrementa la incidencia de esta lesión. Las connotaciones peyorativas que en la actualidad tiene el tabaco para fumar han provocado que se busquen otras formas de consumo, en especial el uso de tabaco de mascar o en polvo, el tabaco denominado «bidi» (34,35), o fumar con el extremo del cigarrillo encendido dentro de la boca («chuta», «candela pa\'dentro») (3). En estos fumadores, las lesiones tienden a localizarse en zonas determinadas, como en el suelo de boca, la cara ventral de la lengua y el paladar blando (36-38).Otros factores desencadenantes de la leucoplasia oral involucrados se agrupan de forma didáctica en tres categorías: el factor infeccioso, el factor nutricional y ciertos hábitos tóxicos (11,35,38-40).
Factor infeccioso
Se ha descrito la participación de algunos géneros de hongos, varios virus y alguna bacteria.
Factor nutricional
Para autores como Zain, la existencia de relación entre factores nutricionales y la ingesta de determinados nutrientes con el cáncer de vías aéreo-digestivas altas es evidente (52). La leucoplasia es una lesión observada en pacientes que padecían anemia por déficit de hierro y con disfagia sideropénica (síndrome de Plummer-Vinson o de Paterson-Kelly) (46,53).
Hábitos tóxicos
El papel que representa el alcohol en la génesis de la leucoplasia es confuso y en la actualidad está consensuado no considerarlo como factor causal de la leucoplasia (6), a pesar de que es un factor de riesgo bien conocido para el cáncer oral. En estudios realizados en consumidores de cerveza, se encontró que aquellos que consumían más de 10 unidades diarias, presentaban un riesgo mayor de desarrollar leucoplasia (54). Por el efecto agresivo que sobre la mucosa oral tiene el hábito de masticar nuez de betel (hábito extendido en la población asiática), esta costumbre ha sido involucrada en la producción de leucoplasias y fibrosis submucosas (35,39).Entre el resto de factores desencadenantes de la leucoplasia oral descriptos, se cuentan determinados productos farmacológicos. Uno de los más anecdóticos es un colutorio bucal (cuyo principio activo se obtiene de la Sanguinaria canadensis) prescrito para la higiene oral por su actividad antibacteriana, antifúngica y antiinflamatoria; su uso ha sido relacionado con aumento de la prevalencia de leucoplasias localizadas en el vestíbulo bucal (55-57).
Características clínicas
La lesión que caracteriza a esta entidad es una mancha blanca que puede alternar con zonas rojas y presentar en algunas ocasiones irregularidades, adoptando un aspecto verrugoso sobre la mucosa bucal, y que puede localizarse en cualquiera de sus áreas topográficas, aunque existen áreas con mayor predilección tales como la mucosa yugal y las comisuras labiales (14,25,58). También se citan como localizaciones frecuentes (por este orden) al bermellón labial, la mucosa yugal y la encía (17). Las localizaciones menos habituales son el paladar, el reborde alveolar, el labio inferior y el suelo de boca (28).La leucoplasia también puede afectar otras mucosas de la economía, como las de la faringe, la laringe, el tracto urinario, los genitales y el ano; también puede haber compromiso de la córnea (3,11,59).
Sintomatología
La sintomatología en las formas homogéneas es anodina y en muchas ocasiones el diagnóstico se realiza en inspecciones rutinarias de la cavidad bucal.Las formas no homogéneas pueden cursar con sensación de rugosidad y leves molestias; y las formas erosivas, con dolor. Se ha referido que tan sólo 25% de los pacientes consultan por esta lesión en el transcurso del primer año de ser observada (23).
Clasificación
La importancia intrínseca de esta lesión (por su alta incidencia y por la trascendencia de su posible transformación metaplásica) y sus intrincadas características, en especial su apariencia ampliamente variable, han sido motivo de la realización de diversas clasificaciones.La mayoría de éstas se han elaborado sobre la base de su forma de presentación macroscópica (59), pero también se confeccionaron otras según la etiopatogenia, la clínica o según su relación clínico-histológica.Fruto del empeño de diversos investigadores para desentrañar la complejidad de esta entidad son las clasificaciones que se exponen a continuación. La más didáctica y completa es la última clasificación expuesta, elegida para definir las formas clínicas.
Clasificación etiopatogénica de Schüermann, Greither y Horstein, 1966 (60)
Clasificación clínico-histopatológica de las leucoplasias de Bacnózy y Sugar, 1972 (61)
Clasificación clínico-histopatológica de las leucoplasias de Grinspan, 1975 (59)
Clasificación clínica de las leucoplasias de Krammer y Pindborg, 1980 (62)
Clasificación de la leucoplasia oral, 1997 (6,63)
Formas clínicas (64)
1.- La leucoplasia homogénea es una lesión uniformemente blanca, de consistencia firme, de poco espesor y de superficie lisa o arrugada que en ocasiones presenta surcos poco profundos. Es la más frecuente de todas las formas clínicas.
2.- La leucoplasia no homogénea es una lesión predominante blanca (no uniforme). Esta leucoplasia puede ser: verrugosa, nodular, eritroleucoplásica y verrugosa exofítica proliferativa.
- La leucoplasia verrugosa es una lesión sobreelevada con bordes irregulares.
- La leucoplasia nodular se presenta con pequeñas elevaciones de la mucosa redondeadas, blancas y rojas, que le dan un aspecto granular. También se la ha denominado leucoplasia moteada.
- La eritroleucoplasia es una lesión que incluye, entre las zonas blancas, áreas enantematosas y en ocasiones áreas erosivas.
- La leucoplasia verrugosa proliferativa fue descripta por primera vez en 1985 (65), y ha sido definida como una lesión predominantemente blanca exofítica, verrugosa, persistente, multifocal, clínicamente agresiva y resistente al tratamiento (27,66).
Correlación clínico-patológica
Uno de los problemas que más esfuerzo ha procurado a la mayoría de los clínicos que estudian esta entidad es conseguir la posibilidad de conjeturar su evolución sin necesidad de ampararse en su correlación histopatológica.Como ejemplo de estos esfuerzos, están los criterios de seguimiento y valoración de las leucoplasias, que en 1969 estableció Cawson (67); y los criterios clínicos para calcular el riesgo de malignización de la lesión leucoplásica, establecidos en 1991 por García-Pola y López-Arranz (25).
Criterios de Cawson (1969):
Criterios clínicos de García-Pola y López-Arranz (1991):
Se establecieron 16 criterios clínicos: sexo, edad, hábito tabáquico, hábito alcohólico, ambos hábitos simultáneamente, tiempo de evolución, sintomatología clínica, localización, forma clínica de la lesión, tamaño, higiene oral, irritación mecánica de la lesión, sobreinfección candidiásica, respuesta a tratamientos previos, tinción con azul de toluidina y el criterio miscelánea que agrupaba a varios factores (estados carenciales, sífilis, cáncer en otra área de la economía, galvanismo intraoral, exposición a la luz solar excesiva, trabajos con asbesto, esferas de vidrio, etc.).Agrupados en criterios menores y mayores, se les asignó una puntuación entre 0 a 1 y 0 a 2 respectivamente. Esta puntuación se aplicó a una muestra de 74 pacientes con diagnóstico de leucoplasia, cuya evolución fue seguida durante 5 años. De estos 74 pacientes, 12 superaban la cifra de 9 puntos; este resultado correspondió a los casos de lesiones que en algún momento del seguimiento sufrieron transformación metaplásica.Los criterios clínicos no sustituyen al estudio histológico de la lesión, pero ayudan a comprender la evolución y la posible transformación maligna (38).En el año 2000, van der Waal (68) propuso una modificación del sistema de estadiaje de la leucoplasia que anteriormente había promovido Axell, con el fin de poder utilizarlo sin tener que recurrir a la histopatología, y es de especial interés en estudios epidemiológicos.


Histopatología
Clasificación histopatológica
El factor que más intensamente condiciona el potencial maligno de una leucoplasia es la presencia de displasia epitelial en el análisis histopatológico (7). Según el criterio histopatológico, la leucoplasia puede ser sin displasia y con displasia (69).En las leucoplasias sin displasia, el epitelio está bien estructurado. Los cambios histológicos no displásicos observables varían desde hiperqueratosis (orto y/o para), a acantosis y a papilomatosis. En las leucoplasias con displasia podemos observar trastornos de la diferenciación celular, de las relaciones intercelulares y de la unión epitelio-coriónica. Otros cambios son la presencia de carcinoma in situ y carcinoma epidermoide (28). Los signos de hiperparaqueratosis y de infiltrado inflamatorio en el corion son más frecuentes en las leucoplasias con displasias (26, 70).
Displasia y atipia epitelial
Por definición, el término «displasia» hace referencia al crecimiento desordenado del epitelio y proviene de la fusión de dos términos griegos: δψσ (dys: mal) y πλασσεν (plassein: forma o modelo).Los criterios morfológicos de displasia epitelial, son (2,71):
Gradación de los cambios displásicos (2,72)

Diagnóstico
El término leucoplasia es considerado por la OMS como fundamentalmente descriptivo (4). En el Symposium de Uppsala (6) se propuso que el diagnóstico de leucoplasia tuviese dos fases diagnósticas:
Criterios indicativos clásicos de degeneración maligna en una leucoplasia (38)
Diagnóstico diferencial
El diagnóstico diferencial hay que realizarlo con otras lesiones que cursan como manchas blancas. Hay que tener constancia de que el concepto de mancha blanca define a un área circunscripta o difusa de color más blanco que la mucosa aparentemente normal circundante. Puede ser macular, papular o en placa, única o múltiple, que se desprende o no (77).
Clasificación etiológica de mancha blanca

Figura 1. Leucoplasia localizada en bermellón de labio inferior.

Figura 2. Leucoplasia localizada en bermellón de labio inferior.

Figura 3. Leucoplasia localizada en mucosa yugal.

Figura 4. Leucoplasia localizada en mucosa yugal.
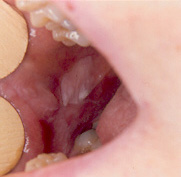
Figura 5. Leucoplasia localizada en mucosa yugal.
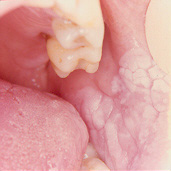
Figura 6. Leucoplasia con displasia leve localizada en mucosa yugal.

Figura 7. Leucoplasia con displasia moderada localizada en mucosa yugal.

Figura 8. Leucoplasia con displasia grave o severa localizada en mucosa yugal.
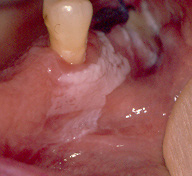
Figura 9. Leucoplasia localizada en encía mandibular.
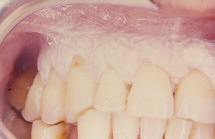
Figura 10. Leucoplasia localizada en encía maxilar superior.

Figura 11. Leucoplasia localizada en encía maxilar superior.
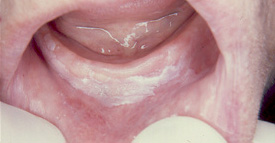
Figura 12. Leucoplasia localizada en encía y vestíbulo oral inferior.
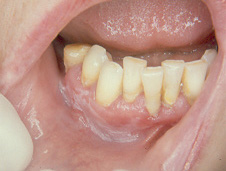
Figura 13. Leucoplasia con displasia moderada localizada en encía y vestíbulo oral inferior.

Figura 14. Leucoplasia localizada en suelo oral y cara ventral de la lengua.

Figura 15. Leucoplasia localizada en suelo oral y cara ventral de la lengua.
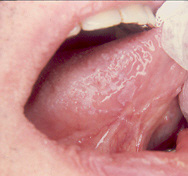
Figura 16. Leucoplasia localizada en borde lateral lingual.

Figura 17. Leucoplasia localizada en borde lateral lingual.

Figura 18. Carcinoma epidermoide tras malignizar una leucoplasia localizada en el borde lateral de la lengua.
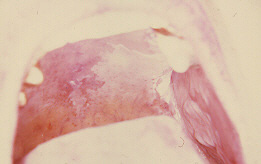
Figura 19. Extensa leucoplasia que se localiza en el paladar y mucosa yugal.Tratamiento
Primer nivel
En primer lugar, se actuará sobre los factores desencadenantes o asociados con la leucoplasia (factores leucoplasicogenéticos) (11). La actuación a este nivel es el paso previo al tratamiento médico o quirúrgico de la lesión (80). Se eliminarán los elementos que puedan ser el origen de microtraumatismos mecánicos relacionados con la lesión (superficies dentarias anfractuosas, prótesis dentales con aristas cortantes, etc.) (11).Se debe recomendar la supresión del consumo de alcohol y de tabaco, ya esta única medida produce la desaparición del 50% al 60% de las leucoplasias desencadenadas por el tabaco, entre los 6 y los 12 meses tras el abandono de este hábito (28,34).Los hábitos higiénicos orales, si son deficientes, se reconducirán hasta conseguir un estado de higiene bucal correcto. Si existiesen niveles elevados de placa bacteriana, se pautarán enjuagues de clorhexidina (al 0.12%), y si con esta medida no se consiguiese adecuadamente su reducción, se eliminarán los dientes y prótesis dentales capaces de retener placa bacteriana.Se controlarán los hábitos nutricionales y se corregirán los estados carenciales. Es recomendable evitar la ingestión de alimentos muy calientes, excesivamente condimentados o ácidos.
Segundo nivel
El tratamiento médico es el segundo nivel de actuación, y se puede aplicar de forma tópica y sistémica. Inicialmente, si se sospecha sobreinfección por Candida se establecerá un tratamiento tópico antimicótico con nistatina (71), o con miconazol durante 15 días (81), hasta el día programado para la revisión del paciente y la práctica de la biopsia. Si se comprueba la persistencia de Candida en el tejido biopsiado, se pautará fluconazol u otro derivado azólico por vía oral durante 15 días más (82).
Tratamiento tópico. Los principios activos más utilizados y estudiados por sus efectos en la aplicación tópica son el ácido retinoico (13 cis-retinoico o etretionato) (81,83) y, después, la bleomicina (84-87). La principal indicación de los retinoides sería lesiones extensas, mientras que el empleo de la bleomicina se reservaría para lesiones multifocales y de difícil acceso quirúrgico.
Tratamiento sistémico. Para el tratamiento de la leucoplasia se han utilizado, por vía oral, la vitamina A o sus derivados (etretionato, fenretinida) (88-97) y la vitamina E (alfa-tocoferol) (98). También hay clínicos que han utilizado calcipotriol, betacaroteno, curcumina, epigalocatequina-3-galato y el inhibidor de Bowman-Birk, con mayor o menor éxito; estudios posteriores deberán valorar su eficacia (99).
Tercer nivel
El tercer nivel de actuación es el tratamiento quirúrgico (100) ya sea por técnicas convencionales, por el empleo del láser (101-107), la crioterapia (109-111), terapia fotodinámica (7) o la ultrasonografía (112).El empleo del láser es, para la mayoría de autores, la técnica ideal por su inocuidad, facilidad de aplicación, su escasa morbilidad. En algunos casos, debido a la extensión de la lesión, se requiere después de la intervención realizar injertos cutáneos o autoinjertos de mucosa oral cultivada in vitro (103).La ventaja de la crioterapia radica en la poca profundidad de su campo de acción, lo que supone cicatrices superficiales y flexibles. Las complicaciones que puede desencadenar son falta de control de la coagulación, dolor y necrosis posoperatoria (109-111).
Cuarto nivel: reevaluación y seguimiento
Si la leucoplasia no es displásica se realizará una reevaluación clínica cada 6 meses. En las formas eritroleucoplasias y en las displásicas (independientemente de su forma clínica) la revisión se realizará cada 2 ó 3 meses (113). Es conveniente hacer una biopsia si el paciente sigue fumando o si han habido cambios clínicos que incrementen la severidad de la lesión (28, 46).
Evolución y pronóstico
La OMS define como lesión precancerosa a aquel tejido morfológicamente alterado en el que el cáncer puede aparecer más fácilmente que en el tejido equivalente de apariencia normal. En este sentido, la leucoplasia oral es considerada por la OMS como una lesión precancerosa (6).Existen dos circunstancias que ratifican esta apreciación. La primera es que en las proximidades de gran número de carcinomas epidermoides se han diagnosticado vestigios de leucoplasias (113). Y la segunda, se ha podido objetivar que con el paso del tiempo algunas leucoplasias han malignizado (71).El porcentaje estimado de transformación maligna varía en función del país en donde se realice el estudio. Así, el porcentaje de lesiones que evolucionan hacia la malignización es inferior en algunos países (India), incluso en estudios realizados sobre muestras de gran tamaño, en oposición a los índices hallados en países occidentales con muestras menos importantes. La justificación a este desfase se explica por la forma de obtener y de recoger la muestra, bien de un centro hospitalario, bien de una muestra aleatoria. Los porcentajes publicados oscilan entre 0.13 y el 17.5% (25,113-115).Diferentes estudios en los que se ha realizado un seguimiento de pacientes con leucoplasia, han puesto de manifiesto que existen factores clínicos e histopatológicos relacionados con mayor riesgo potencial de transformación maligna de la lesión (25,46). Los más importantes son el sexo, la localización y la forma clínica de la leucoplasia (color y textura).Con respecto al sexo, se ha descrito un riesgo de transformación maligna de dos a cuatro veces superior en la mujer que en el varón. Sin embargo, en un estudio recientemente realizado en Grecia, la tendencia en ese país parece orientarse al equilibrio, ya que encontraron una distribución por género semejante en leucoplasia y cáncer, con la única salvedad de que en los hombres el diagnóstico se realizaba a edades más tempranas (117).Las leucoplasias localizadas en el suelo de la boca, en la cara ventral de la lengua (101) y el vestíbulo inferior (7) malignizan con más frecuencia que en otras localizaciones. Las leucoplasias que asientan en más de dos áreas topográficas lo hacen entre 16% y 39% (46).En cuanto a la forma clínica, destaca que las leucoplasias homogéneas malignizan entre 1% y 7% de los casos; este porcentaje es superado por las leucoplasias nodulares sobreinfectadas por Candida, las leucoplasias no homogéneas con lesiones rojas concomitantes y sobre todo por la forma verrugosa proliferativa (7,46). Merece especial atención esta última forma, debido a su gran agresividad evolutiva y sus altos índices de malignización.Otros factores que se han citado como influyentes en los cambios evolutivos de la leucoplasia (11) han sido la edad superior a los 50 años, el tamaño mayor de 1 cm y un tiempo de evolución amplio. La transformación maligna suele ocurrir entre los 2 y los 4 años, pero también puede desarrollarse a los pocos meses del diagnóstico o bien pasados 20 años (46).La presencia de displasia es el dato histológico más importante relacionado con riesgo más elevado de transformación maligna de las leucoplasias. De forma orientativa, está consensuado aceptar que el riesgo de malignización de una leucoplasia con displasia es alrededor de cinco veces mayor que cuando la displasia no está presente.Algunos de los porcentajes registrados en la literatura sobre las leucoplasias con displasia que han malignizado han sido 9% (71), 20% (116,118) y 36% (119). Las leucoplasias con displasias de carácter leve malignizan de 4% a 11%, y con displasias severas entre 20% y 35% (46).