




 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: Introducción
Mycobacterium tuberculosis es un patógeno distribuido en todo el mundo (1,2). Y peor aún, han aparecido cepas de M. tuberculosis resistentes a múltiples drogas; diversos informes indican que estas cepas resistentes también se hallan ampliamente distribuidas (3-6). Los métodos clásicos para el diagnóstico de laboratorio de tuberculosis consumen mucho tiempo, y la tardanza resultante puede afectar adversamente el cuidado del paciente y el control de la enfermedad. Recientemente han surgido nuevos métodos rápidos de biología molecular que nos sirven para la amplificación de ácidos nucleicos, tales como la reacción en cadena de la polimerasa (PCR), que aumentan la sensibilidad de detección de M. tuberculosis. La PCR no sólo permite hacer el diagnóstico de infección por M. tuberculosis sino que también hace posible la identificación de cepas mutantes de M. tuberculosis que son resistentes a múltiples drogas (7-9). En México, muchos de los Estados no cuentan con la metodología de PCR y se desconoce la prevalencia de infección por M. tuberculosis resistente a múltiples drogas. Debido a la importancia del problema de la tuberculosis en México, es esencial iniciar la utilización de la PCR no sólo para hacer el diagnóstico temprano de la enfermedad sino también para el rápido reconocimiento de resistencia a los principales agentes antituberculosos. Sólo de esta manera se logrará mejorar el control de la tuberculosis.La rifampicina es una de las drogas antituberculosas de primera línea. La resistencia de M. tuberculosis a la rifampicina ha sido asociada con mutaciones en el gen que codifica la subunidad beta de la ARN polimerasa (rpoB) y con resistencia a otras drogas antituberculosas (8). Estas mutaciones pueden ser identificadas por varios métodos de biología molecular como la PCR y el ensayo de sondeo lineal (LiPA) (9-11), polimorfismo de la longitud del fragmento de restricción (12,13), y secuenciado (6,14). La prevalencia de infección por M. tuberculosis resistente a rifampicina y los tipos de mutaciones asociadas con tal resistencia varían ampliamente en todo el mundo (7,15-17). Sin embargo, hay muy poca información respecto a la epidemiología molecular de infecciones por M. tuberculosis resistente a rifampicina en México en general, y carencia de comunicaciones sobre Durango en particular. Por ese motivo hemos diseñado el presente estudio; el objetivo fue estimar mediante métodos moleculares la frecuencia de infecciones por cepas de M. tuberculosis resistentes a rifampicina en pacientes que sufren de tuberculosis pulmonar, y determinar las mutaciones del gen rpoB asociadas con resistencia a rifampicina en cepas de M. tuberculosis que circulan en México.
Material y métodos
Aislados de Mycobacterium
Se estudiaron treinta y siete aislados de M. tuberculosis cultivados en el medio de Löwenstein-Jensen. Los aislados fueron obtenidos de pacientes con tuberculosis captados consecutivamente en 5 hospitales públicos de México. Veintiuna muestras fueron recolectadas en 4 hospitales de la ciudad de Durango, y 16 en un hospital de la ciudad de México. Los 37 aislados fueron cultivados de los siguientes especímenes: 31 esputos, 4 lavados broncoalveolares y 2 líquidos pleurales.Veintidós de los 37 pacientes tuberculosos (59.5%) había recibido previamente tratamiento antituberculoso, mientras que los 15 restantes habían sido recientemente diagnosticados y no habían sido tratados contra la tuberculosis.
Reacción en cadena de la polimerasa (PCR)
De cada cultivo de Löwenstein-Jensen positivo, una muestra de 10 µl de bacterias fue obtenida y suspendida en 500 µl de solución salina, inactivada a 95 °C por 15 minutos, y congelada a –20 °C hasta que fueron analizadas. La amplificación del gen rpoB de M. tuberculosis fue realizada usando el ensayo de amplificación Rif. TB, como se describe en otro lado (11). Brevemente, 5 µl de la suspensión de bacterias fue agregada a la mezcla maestra conteniendo cebadores biotinilados rpoB. La amplificación fue realizada en un termociclador GeneAmp PCR System 9600, bajo las siguientes condiciones: desnaturalización inicial a 95 °C por 5 minutos y 30 ciclos de 95 °C por un minuto, 62 °C por 1 minuto y 72 °C por 1 minuto, y extensión terminal a 72 °C por 10 minutos. Los productos del PCR fueron separados sobre geles de agarosa al 2.5%, teñidos con bromuro de etidio y visualizados mediante iluminación ultravioleta.
Ensayo de sondeo lineal (LiPA)
Las mutaciones de M. tuberculosis asociadas con resistencia a la rifampicina fueron detectadas mediante INNO-LiPA Rif. TB, como se describe en otro lado (11). Brevemente, 10µl de los productos del PCR marcados con biotina fueron hibridados con el complejo de M. tuberculosis (TB), tipo salvaje (S1-5), y sondas específicas de la mutación rpoB: R2 (D516V), R4a (H526Y), R4b (H526D) y R5 (S531L) inmovilizadas como líneas paralelas sobre tiras de papel de nitrocelulosa. Después de la hibridación, se realizó un lavado fuerte y se agregó estreptavidina marcada con fosfatasa alcalina. Las tiras fueron luego lavadas e incubadas con substrato BCIP/NBT. La reacción fue detenida mediante la adición de agua destilada. Un patrón de líneas café violáceo, como resultado de la hibridación, se configuró sobre las tiras.
Resultados
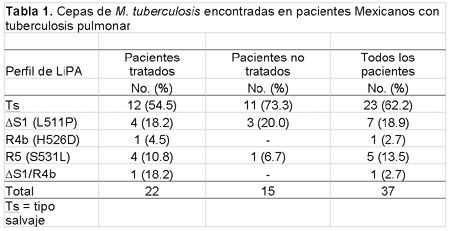
Todos los 37 aislados analizados fueron positivos a la PCR e hibridaron con la sonda del complejo de M. tuberculosis sobre las tiras LiPA confirmando que todos los aislados fueron realmente cepas de M. tuberculosis. Catorce de los 37 aislados (37.8%) dieron patrones de mutaciones asociados a resistencia, esto es, fallaron en hibridar con por lo menos una de las sondas de tipo salvaje y/o hibridaron con las sondas específicas de mutación del gen rpoB. Los restantes 23 aislados (62.2%) hibridaron solamente con sondas del tipo salvaje indicando su susceptibilidad a la rifampicina.Diez (45.5%) de los 22 pacientes previamente tratados estuvieron infectados por cepas de M. tuberculosis resistentes a la rifampicina, mientras que 4 (26.7%) de los 15 pacientes no tratados estuvieron infectados por cepas resistentes a la rifampicina. La tabla 1 resume los resultados del LiPA y la distribución de cepas de M. tuberculosis en pacientes tuberculosos tratados y no tratados.
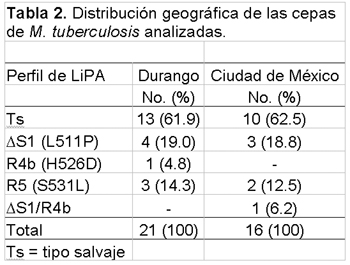
La distribución geográfica de cepas de M. tuberculosis en Durango y en la ciudad de México se muestra en la tabla 2.
Discusión
En este estudio, una prevalencia alarmantemente alta de 37.8% de infección por M. tuberculosis resistente a rifampicina fue encontrada en pacientes tuberculosos mexicanos. Esta prevalencia es más alta que la reportada en Estados Unidos, Europa, y en países africanos (16,18-22), mucho más alta que la prevalencia mundial promedio (17), pero solo más baja que la reportada en países de la ex Unión Soviética (6,23). En nuestro estudio, 45.5% de los pacientes previamente tratados para tuberculosis y 26.7% de pacientes no tratados estuvieron infectados por cepas de M. tuberculosis resistentes a rifampicina. Estas frecuencias son también más altas que las frecuencias mundiales promedio observadas en pacientes tuberculosos tratados y no tratados, respectivamente (17,19,22,24).Trece de los 14 aislados con mutaciones en el gen rpoB contenían mutaciones únicas; en solamente un caso se observó doble mutación en los nucleótidos L511P y H526D. En total, 3 mutaciones diferentes ya sea en presentación única o en combinación fueron observadas entre nuestros aislados mexicanos: la mutación en el nucleótido L511P estuvo presente en 8 de los 14 aislados resistentes a la rifampicina (57.1%), la mutación en el nucleótido S531L en 5 (35.7%), y la mutación en el nucleótido H526D en 2 aislados (14.3%). La frecuencia de mutación en el nucleótido L511P encontrada en aislados mexicanos resistentes a rifampicina es considerablemente más alta que la reportada en países asiáticos, Grecia y los Estados Unidos (15,18,25). La frecuencia de mutación en el nucleótido S531L encontrada fue similar a la informada en los Estados Unidos (18) y ligeramente más baja que la de Brasil, países asiáticos, Grecia y Ruanda (10,15,25,26). Respecto de la mutación en el nucleótido H526D, nuestra frecuencia fue similar a la comunicada de países asiáticos (15,25), pero ligeramente mayor que la observada en los Estados Unidos (18). Por otro lado, en el presente estudio no hubo casos de mutaciones en los nucleótidos D516V, H526Y, H526C y L533P, mutaciones generalmente halladas en países asiáticos, europeos, y africanos así como en los Estados Unidos (10,11,18). Con respecto a la distribución geográfica de cepas de M. tuberculosis en las dos ciudades exploradas, observamos aproximadamente la misma distribución de cepas en la ciudad de Durango que en la ciudad de México sugiriendo que las cepas de M. tuberculosis pueden circular en grados similares en el norte y centro de México. Además, los resultados indican que por lo menos 5 cepas diferentes de M. tuberculosis circulan en México. Fuimos capaces de identificar todos los 37 aislados por medio del LiPA. Este método ha sido ampliamente examinado y demostró ser un método altamente sensible para la detección de mutantes resistentes a la rifampicina (11,18,27). Es fácil de realizar y el equipo necesario suele estar disponible en laboratorios de países en desarrollo (donde la tuberculosis es un problema de salud pública), al contrario del instrumental necesario para otros métodos moleculares tal como el secuenciado de ADN. Ya que, según se cree, la resistencia a drogas antituberculosas resulta de tratamiento inadecuado, esto es, ingesta irregular de la droga, tiempo insuficiente y escasa aceptabilidad, los resultados del presente estudio estarían indicando realización subóptima de los programas actuales de terapia de tuberculosis; y sugieren que mayores esfuerzos son necesarios urgentemente para proporcionar tratamiento eficiente en México. De verdad, las infecciones por cepas de M. tuberculosis resistentes a múltiples drogas antituberculosas se han incrementado últimamente en México, en comparación con frecuencias previamente comunicadas (28-30). Concluimos que las infecciones de M. tuberculosis resistentes a rifampicina son comunes en México, y las cepas de M. tuberculosis resistentes a rifampicina que circulan en este país son principalmente las que contienen mutaciones únicas en los nucleótidos L511P, H526D o S531L. A fin de proporcionar tratamiento eficaz a los pacientes con tuberculosis, es muy importante analizar con métodos moleculares la resistencia de M. tuberculosis a la rifampicina. Frecuentemente, si no siempre, el médico tratante inicia la terapia con fármacos de primera línea incluyendo a la rifampicina; sin embargo, al menos en México, hemos demostrado que la resistencia a rifampicina es común, y hasta cierto punto no es racional dar inicio al tratamiento sin antes investigar si la bacteria que infecta es resistente a las drogas antituberculosas coma la rifampicina.