Conceito
É um tipo de tumor intra ocular maligno, constituído por melanócitos que, por definição, são células maduras produtoras e mantenedoras de melanomas. Derivada do neuroectoderma, pode ter origem na íris, corpo ciliar ou, mais comumente, coróide. Estas células podem estar presentes em olhos normais no epitélio pigmentar da retina, na conjuntiva e na íris. Os melanócitos uveais apresentam a forma dendrítica, com pigmentação variável e estão distribuídas pelo estroma da íris, corpo ciliar e coróide.1,2
Etiologia e epidemiologia
O melanoma maligno de coróide é o tumor primário intra-ocular mais comum em adultos, embora seja considerado um tumor raro.3 Possui incidência calculada de 6 casos por 1.000.000 de habitantes por ano nos Estados Unidos.4,5O agente etiológico específico dos melanomas é desconhecido, mas vários estudos relatam alguns fatores de risco no desenvolvimento dessa entidade, como: idade - mais comum na 6a década6 (média de idade no momento do diagnóstico é de 53 anos), raça (8,5 vezes mais freqüente em brancos que negros),1,2 sexo (discordância entre os dados, onde alguns estudos mostram uma maior incidência em homens),2 lesões predisponentes (melanoses congênitas e nevus), 1,2,7 fatores genéticos (melanoma em uma mesma família tem sido relatado na literatura),8 fatores hormonais (alteração hormonal induzida pela gravidez acelera o crescimento de melanomas de coróide)1 e fatores ambientais (exposição excessiva aos raios ultra violetas tem revelado evidências na correlação causa/efeito).1,2,7Não foi descrito nenhum padrão de herança familiar em pacientes com melanoma uveal. Várias anormalidades citogenéticas têm sido identificadas e podem ser responsáveis pelo desenvolvimento da neoplasia. A alteração mais comumente associada inclui deleção parcial do braço curto do cromossomo 9, multiplicação de parte do braço longo do cromossomo 8, monossomia do cromossomo 3 e ganho de material no cromossomo 6p com perda complementar do 6q.
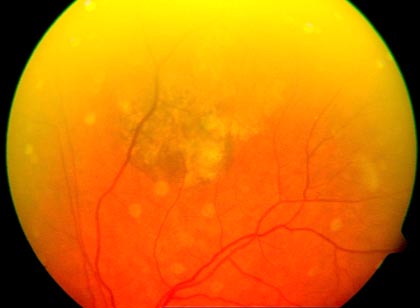
Figura 1. Melanoma de coróide observado no olho esquerdo de um paciente atendido no Serviço de Retina e Vítreo da Universidade Federal de Uberlândia.
Anatomia patológica dos tumores
- Aspecto microscópico (classificados com o tipo celular)
Em 1931, Callender9 propôs uma classificação dos melanomas malignos uveais baseada nos aspectos citológicos e histopatológicos. Segundo esta classificação, as células podem ser de dois tipos: fusiformes ou epitelióides:- células fusiformes, mais coesas, podem ser do tipo A, com núcleo alongado, ou do tipo B, com núcleo globoso
- células epitelióides apresentam-se maiores e mais pleomórficas que as fusiformes, com formato poliédrico, pouco coesas e com nucléolo evidente.
De acordo com Callender e colaboradores,10 os melanomas malignos da úvea foram classificados em seis grupos:- quatro grupos de acordo com o tipo citológico (fusiforme A, fusiforme B, epitelióide e misto)
- dois grupos adicionais classificados de acordo com as características histopatológicas (fascicular e necrótico).
Classificação Organização Mundial da Saúde / Zimmermam (1979):11- fusiforme A: 75% células fusiformes A e o restante fusiforme B
- fusiforme B: 75% células fusiformes B e o restante fusiforme A
- epitelióide: 75% células epitelióides e o restante A ou B
- celularidade mista: 03 tipos de células.
A classificação original de Callender foi modificada por McLean e colaboradores12 e, atualmente, prefere-se classificar os melanomas malignos da úvea em fusiformes, sem a distinção entre fusiforme A e B, e em mistos, eliminando-se o puramente epitelióide, uma vez que praticamente todos os melanomas uveais contém células fusiformes. - Aspecto macroscópico
- aspecto de cogumelo: mais freqüente. A esclera, tecido fibroso rígido, evita a expansão do tumor externamente e, com isso, a membrana de Bruch que é fraca se rompe. O tumor então pode herniar através da rotura e crescer no espaço subretiniano, parecendo que existe um cordão de estrangulamento na área da membrana de Bruch. A retina que recobre o tumor geralmente está atrófica e a retina ao redor do tumor pode descolar pelo acúmulo de líquido seroso subretiniano, formando um descolamento seroso em bolsão1,2,13
- difuso infiltrativo: menos freqüente. Padrão pouco usual de crescimento, onde o tumor cresce lateralmente sem que haja um grande aumento de espessura. Estes tumores tendem a invadir muito mais freqüentemente a esclera. 1,13,14
O melanoma maligno de coróide formado por células mistas foi o tipo de tumor mais comumente encontrado nos pacientes avaliados pelo Collaborative Ocular Melanoma Study (COMS).15Além do tipo histológico, muitos outros fatores patológicos têm valor prognóstico na mortalidade dos melanomas de coróide e corpo ciliar. Fatores desfavoráveis incluem o tamanho do tumor; a presença de alças e redes fibrovasculares no tumor; os valores calculados de parâmetros citomorfométricos (diâmetro nuclear, área nuclear, desvio padrão da área nuclear, diâmetro nucleolar, área nucleolar, desvio padrão da área nucleolar); a presença de invasão escleral; a ocorrência de extensão transescleral; o envolvimento do corpo ciliar; o alto índice de figuras de mitose do tumor; e um alto nível de pigmentação das células tumorais. Manifestações clínicas
Sintomas que variam de "vagos", tais como moscas volantes, metamorfopsia e fotopsias, a baixa evidente de visão, na dependência do topografia intra ocular da lesão, dor e defeitos de campo visual. Complicações tardias como glaucoma secundário, neovascularização da íris e extensão extra ocular podem ocorrer nos melanomas malignos de pólo posterior com franca atividade.8 Hill et al17 observaram que a queixa de perda visual é o sintoma mais freqüente nos portadores de melanoma de coróide.
Diagnóstico
O melanoma de coróide representa um tumor com importante agressividade, onde o diagnóstico precoce pode modificar o prognóstico de vida do portador.2 Na propedêutica do tumor ocular devem ser pesquisados minuciosamente os seguintes tópicos:
- História: questionar quanto a doenças neoplásicas sistêmicas, cirurgias prévias e problemas oculares
- Avaliação sistêmica: risco de metástase (sítio primário extra ocular ou metástase à distância de melanoma primário ocular)
- Exame físico, enzimas hepáticas, raio-X de tórax, ultra-sonografia e tomografia computadorizada de abdome e mapeamento de fígado com radioisótopos
- Exame do olho contralateral
- Exame ocular externo: vasos episclerais dilatados, denominados vasos sentinela, revelam a localização do tumor no quadrante correspondente; mancha pigmentada episcleral, que pode representar infiltração escleral2
- Oftalmoscopia indireta: mais importante método propedêutico na elucidação diagnóstica de um suspeito melanoma da coróide. Observa-se o aspecto cupuliforme com maior freqüência, com espessamento circunscrito.1,7 Segundo Kanski,6 a oftalmoscopia indireta em olhos com meios claros é o suficiente para um diagnóstico preciso de melanoma de coróide na grande maioria dos casos
- Retinografia colorida: importante no acompanhamento de nevus e melanomas pequenos18
- Angiofluoresceínografia: sem padrão patognomônico, auxilia no diagnóstico diferencial entre o melanoma e pseudomelanoma2,7
- Ultra-sonografia: informa com precisão o tamanho, localização e extensão da lesão, sendo de especial importância na presença de meios opacos. Pode também demonstrar massas relativamente pequenas de extensão extra-ocular19,20
- modo A: observa-se, na área do tumor, uma alta amplitude inicial, seguida de progressiva atenuação do eco, formando o chamado ângulo "kappa"
- modo B: a massa coroidal mostra silêncio acústico e escavação coroidal
- em casos de ruptura da membrana de Bruch, o tumor apresenta a forma de cogumelo.21
- Tomografia computadorizada e ressonância magnética: detecção de extensão extra ocular ou tumor orbitário provocando identação ocular. A ressonância tem a vantagem em relação a tomografia computadorizada de detectar pequenas extensões extra oculares.22
Diagnóstico diferencial23,24
- Nevus de coróide
- Carcinoma metastático em coróide
- Hemangioma da coróide circunscrito
- Melanocitoma de nervo óptico
- Osteoma de coróide
- Neurilenoma (schwannoma)
- Leiomioma
- Hemangioma capilar da retina
- Hemangioma cavernoso da retina
- Lesões não tumorais, como: degeneração senil de mácula, descolamento hemorrágico da retina, descolamento e efusão de coróide
- Lesões inflamatórias, como: esclerite posterior e granulomas corio-retinianos
- Lesões císticas, como: retinosquise degenerativa e cistos da íris e corpo ciliar.
Tratamento
Apesar da enucleação ter sido considerada o tratamento de escolha para o melanoma da coróide por muitos anos, a hipótese de que poderia atuar como um fator promotor da disseminação de células tumorais, através de sua ejeção para a corrente sangüínea, aumentando a incidência de metástases e piorando o prognóstico sistêmico, impulsionou o desenvolvimento e a crescente utilização de outras modalidades terapêuticas.25 Outro fator que contribui para o tratamento conservador, foi o número grande de olhos portadores de lesões benignas enucleados por diagnóstico errôneo de melanoma de coróide. O reconhecimento do estado de dormência de vários melanomas, com mínima tendência ao crescimento e disseminação metastática e a não comprovação de que a enucleação apresente melhora prognóstica quando comparada a outra modalidade também influenciou nesta pesquisa.26,27A conduta deve ser individualizada para cada caso. Fatores como acuidade visual, tamanho do tumor, condição do olho oposto, condições gerais do paciente devem ser considerados. O principal fator determinante do tipo de tratamento a ser utilizado é o tamanho da lesão tumoral.2,18
- Tratamento ocular: estudos indicam o uso de Termoterapia Transpupilar (TTT) para um grupo selecionado de pacientes com melanomas de coróide pequenos (lesões até 4 mm de altura),28,29 com base pequena (menos de 10 mm de diâmetro), com margens distintas, e com mínimo ou nenhum contato com o nervo óptico. Para tumores grandes, amelanocíticos ou tumores que encostam no nervo óptico mais do que 3 horas (90 graus); ou quando não há controle do melanoma após 03 sessões de TTT, outros métodos devem ser utilizados.29 A braquiterapia ou radioterapia com placas radioativas episclerais são técnicas utilizadas em tumores de 4 a 10 mm de altura.2,7,18,30 A ausência de diferença significativa entre a taxa de sobrevida de portadores de melanoma de coróide, tratados por enucleação ou braquiterapia, associada à possibilidade de conservação do globo ocular, muitas vezes com visão útil, levaram à crescente preferência deste método terapêutico,30 sendo a forma de tratamento mais utilizada em vários centros.
- Tratamento cirúrgico: lesões coroidianas bem delimitadas de tamanho pequeno ou médio (menos de 16 mm de diâmetro), não se estendendo por mais de 7 mm posteriormente ao equador e não existindo evidências de disseminação retiniana e/ou vítrea, a ressecção local do tumor poderá ser proposta como opção terapêutica. Entretanto, os melhores resultados são obtidos quando o tumor tem menos de 12 mm de diâmetro, não se estendendo por mais de 4 mm posteriormente ao equador e não envolvendo a pars plana.31 Hoje a técnica utilizada é a exérese em bloco (ressecção escleral) associada a vitrectomia via pars plana.32,33 A enucleação é utilizada atualmente numa freqüência muito menor que outrora e em casos selecionados. A indicação é para melanomas que estejam exibindo crescimento e sejam grandes o suficiente para contra-indicar qualquer outra forma de tratamento conservador; a presença de severo glaucoma neovascular secundário; descolamento de retina; e tumores que apresentam sinais de invasão do nervo óptico.2,7,18 A exenteração da órbita ocasionalmente é realizada em pacientes com invasão extraescleral extensa do tumor ou em casos de recorrência local após enucleação. Entretanto, evidências sugerem que esta medida agressiva não aumenta a sobrevida quando comparada com casos semelhantes submetidos a tratamentos mais conservadores. Uma abordagem cirúrgica menos mutilante associada à radioterapia pode ter resultado semelhante.
De acordo com Erwenne,34 a conduta nos casos de melanoma de coróide deve ser a seguinte:- Paciente sem qualquer sinal de doença metastática:
• tumores de até 3 mm de espessura: observação periódica
• tumores de 3 a 8 mm de espessura e base de até 15 mm - braquiterapia
• tumores com mais de 8 mm de espessura
• se base de até 15 mm: ainda pode-se tentar braquiterapia (prognóstico reservado)
• se a base for maior que 15 mm: indicado enucleação.
- Paciente com sinal de doença metastática: observação ou enucleação se o olho for doloroso.
Segundo Kanski,6 alguns autores utilizam radioterapia prévia à enucleação na tentativa de reduzir o risco subsequente de disseminação metastática. A radioterapia pré-cirúrgica teria como intuito esterilizar o tumor, diminuindo o potencial reprodutivo das células tumorais que eventualmente fossem disseminadas durante o ato cirúrgico, reduzindo o número de células viáveis abaixo do necessário para reiniciar o crescimento tumoral.35,36Os melanomas da coróide não são quimiosensíveis. O método quimioterápico mais utilizado em seus portadores tem sido a quimioterapia intra-arterial hepática com embolização venosa para controle de metástases nesse órgão.34 Os resultados são pobres e a sobrevida dos portadores de metástases de melanomas intra-oculares tem sido estimada em 6 meses. Sobrevida
Em relação ao tamanho temos sobrevida de 20 anos de 80% para os pequenos e 40% para os grandes sem uso de radioterapia prévia.37 O prognóstico parece ser pior nos pacientes com mais de 65 anos.6 Em 32 anos de seguimento, observou-se valor de sobrevida estimado em 80% para o total de pacientes enucleados.38 Em um estudo de Chojniak et al,40 um grupo de pacientes portadores de melanoma de coróide, com tamanho médio de 13,3 mm no maior diâmetro basal e 10,2 mm de espessura, foi submetido à enucleação simples, com seguimento entre 6 e 155 meses. Ao final deste período, 18 pacientes estavam vivos sem doença (62,1%); 1 estava vivo com doença metastática em atividade (3,5%); 6 tiveram óbito por doença metástica (20,1%) e 4 perderam o seguimento (13,8%). De acordo com Hayton et al,39 o acompanhamento desses pacientes precisa ser longo, pois as metástases podem ocorrer até 10 anos após o diagnóstico. Aproximadamente 20% dos pacientes enucleados desenvolvem doença metastática, com elevada prevalência em fígado, de 24 a 36 meses após a enucleação, mesmo que a doença nessa ocasião seja restrita ao globo ocular.9 A sobrevida em pacientes com metástase pulmonar geralmente é menor que 1 ano, e menor que 3 meses quando há acometimento hepático.6
Necessidade de diagnóstico precoce
É importante salientar as dimensões do tumor no momento do diagnóstico, pois o melanoma de coróide é um tumor de crescimento lento, levando cerca de 5 anos para atingir grandes dimensões (> 15 mm).41Acreditamos que a situação sócio cultural desses pacientes, caracterizada pela desinformação e até mesmo a dificuldade de atendimento contribuem para o diagnóstico da lesão em um fase avançada, limitando as opções terapêuticas e tornando frustante a evolução de uma neoplasia ocular potencialmente tratável, pois os pacientes portadores de tumores oculares podem ter um pior prognóstico visual e sistêmico na ocorrência de atraso diagnóstico e terapêutico.De acordo com Baddini-Caramelli et al,42 dois fatores principais contribuem para esse atraso: a falta de informação do doente ou de seu responsável (quando se trata de criança) com relação à importância do quadro clínico, ocorrendo estreita ligação com o baixo grau de instrução, e o atraso na decisão de procurar auxílio médico decorrente da conhecida dificuldade de acesso aos serviços públicos de saúde.Apesar da raridade, mas diante a gravidade dessa neoplasia, consideramos a relevância da oftalmoscopia indireta no diagnóstico, bem como a necessidade de um esclarecimento da população em relação à significância das alterações oculares e visuais (a exemplo do realizado na Campanha Nacional de Prevenção da Cegueira e na Campanha Olho no Olho no Brasil), pois, na grande maioria dos casos, é suficiente para detectar precocemente o tumor, melhorando o prognóstico e ampliando as opções terapêuticas.
Casuística na Universidade Federal de Uberlândia
Em janeiro de 2002, publicamos um artigo43 com objetivo de mostrar os resultados de avaliação, conduta e evolução com a população de pacientes portadores de melanoma de coróide atendidos no período de 01/01/1994 a 01/01/2000 no Ambulatório de Retina e Vítreo da Universidade Federal de Uberlândia - MG. Realizamos uma análise retrospectiva de 7 prontuários de pacientes com diagnóstico de melanoma de coróide, analisando: idade, sexo, cor, sintomas e duração, métodos de diagnóstico, tratamento realizado, tamanho e tipo do tumor e evolução. Não existiu diferença em relação ao sexo, e a idade média dos pacientes foi de 58,5 anos. O tumor predominou em brancos (66,5%) e baixa de acuidade visual foi o sintoma mais freqüente (66,5%). O diagnóstico deveu-se principalmente à oftalmoscopia indireta (66,5%) e todos realizaram ultra-sonografia (USG). Todos pacientes foram submetidos a tratamento cirúrgico, pois apresentavam tumores grandes (maior diâmetro basal superior a 12 mm à USG). O tipo mais freqüente foi o de celularidade mista (50%) e o tamanho médio dos tumores foi de 20,50 mm de maior diâmetro basal e 15,16 mm de espessura. O seguimento variou entre 8 meses e 5 anos. Dois pacientes apresentaram metástase a distância e evoluiram a óbito.Todos pacientes foram diagnosticados com o tumor em um estágio avançado, necessitando tratamento cirúrgico, com 2 pacientes desenvolvendo metástase à distância e evoluindo a óbito. Ressaltamos a importância da oftalmoscopia indireta em função da malignidade do tumor e da possibilidade do diagnóstico precoce, ampliando as opções de tratamento e melhorando seus resultados.Entre 02/01/2000 e 10/08/2003 foram diagnosticados mais 2 casos de melanoma em nosso serviço, um homem e uma mulher, sendo 1 em um jovem melanodérmico. Como se tratavam de tumores grandes à USG, ambos foram submetidos a enucleação. Estes pacientes encontram-se em acompanhamento ambulatorial sem evidências de metástases à distância.





 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: