ACTIVIDAD DEL DIGLUCONATO DE CLORHEXIDINA SOBRE AISLAMIENTOS HOSPITALARIOS DE STAPHYLOCOCCUS SP EN DIFERENTES CONDICIONES AMBIENTALES
(especial para SIIC © Derechos reservados)
Coautores
Mirta Beatriz Reynaldo* Mónica Beatriz Flores**
Licenciada en Genética, Profesional de Apoyo a la Investigación y Tecnología de la Comisión de Investigaciones Científicas de la Provincia de Buenos Aires.*
Farmacéutica, Docente auxiliar de la Cátedra de Higiene y Salud Pública de la Facultad de Ciencias Exactas, Universidad Nacional de La Plata.**
Recepción del artículo: 20 de junio, 2003
Aprobación: 0 de , 0000
 Conclusión breve
El digluconato de clorhexidina es uno de los antisépticos más utilizados en salud humana y animal. Los resultados de este estudio permiten considerarlo como un antiséptico eficaz frente a microorganismos grampositivos.
Conclusión breve
El digluconato de clorhexidina es uno de los antisépticos más utilizados en salud humana y animal. Los resultados de este estudio permiten considerarlo como un antiséptico eficaz frente a microorganismos grampositivos.
 Resumen
Los antisépticos, de amplio uso en los hospitales, son fundamentales para prevenir, erradicar y controlar las infecciones que ocurren en esos ámbitos. Es necesario considerar los diversos aspectos que afectan la actividad de los biocidas, ya que ellos tienen incidencia directa sobre la salud, higiene hospitalaria y los índices de infecciones nosocomiales. Los microorganismos pertenecientes al género Staphylococcus se hallan involucrados en dichas infecciones. Dado que el digluconato de clorhexidina es uno de los antisépticos más utilizados en salud humana y animal, en el presente estudio se realizó la evaluación de este biocida frente a 25 aislamientos hospitalarios del género Staphylococcus, coagulasa positivos y negativos, en presencia y ausencia de materia orgánica, empleándose como medio de dilución agua destilada y agua de 300 ppm de dureza. Los resultados hallados indican que el agua dura es uno de los factores que más afecta la acción bactericida de la clorhexidina, incluso en mayor grado que la interferencia generada por la materia orgánica, particularmente frente a S. aureus. Nuestro estudio permite considerarlo como un antiséptico efectivo para estos microorganismos grampositivos.
Resumen
Los antisépticos, de amplio uso en los hospitales, son fundamentales para prevenir, erradicar y controlar las infecciones que ocurren en esos ámbitos. Es necesario considerar los diversos aspectos que afectan la actividad de los biocidas, ya que ellos tienen incidencia directa sobre la salud, higiene hospitalaria y los índices de infecciones nosocomiales. Los microorganismos pertenecientes al género Staphylococcus se hallan involucrados en dichas infecciones. Dado que el digluconato de clorhexidina es uno de los antisépticos más utilizados en salud humana y animal, en el presente estudio se realizó la evaluación de este biocida frente a 25 aislamientos hospitalarios del género Staphylococcus, coagulasa positivos y negativos, en presencia y ausencia de materia orgánica, empleándose como medio de dilución agua destilada y agua de 300 ppm de dureza. Los resultados hallados indican que el agua dura es uno de los factores que más afecta la acción bactericida de la clorhexidina, incluso en mayor grado que la interferencia generada por la materia orgánica, particularmente frente a S. aureus. Nuestro estudio permite considerarlo como un antiséptico efectivo para estos microorganismos grampositivos.
 Palabras clave
Staphylococcus nosocomial, clorhexidina digluconato de, antisépticos, biocidas
Clasificación en siicsalud
Palabras clave
Staphylococcus nosocomial, clorhexidina digluconato de, antisépticos, biocidas
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/20150
Especialidades
 Principal: Infectología,
Principal: Infectología,
 Relacionadas: Administración Hospitalaria, Bioquímica, Enfermería, Farmacología, Medicina Interna, Salud Pública,
Relacionadas: Administración Hospitalaria, Bioquímica, Enfermería, Farmacología, Medicina Interna, Salud Pública,
 Enviar correspondencia a:
Enviar correspondencia a:
María Del Carmen Magariños. Calles 47 Y 115 S/N (1900) La Plata, Provincia De Buenos Aires, Argentina
 Abstract
Abstract
Activity of chlorhexidine digluconate upon hospital isolations of Staphylococcus sp in different environmental conditions. The antiseptic agents are widely used in hospitals, being essential when prevention and control of nosocomial infections is required. It is necessary to consider several aspects that affect the biocide activity, since they have direct incidence in hospital hygiene, health and also in the nosocomial infection rates. Organisms belonging to Staphylococcus genus are involved in such infections and, digluconate of chlorhexidine is one of the most used antiseptic agents for human and animal health. The current study involved the evaluation of this biocide agent against 19 nosocomial isolates of Staphylococcus, coagulase positive and coagulase negative, with and without organic substances and applying distilled water and water of 300 ppm hardness as dilution means. Results show that hard water was one of the factors that most highly affected the bactericidal activity of chlorhexidine. Moreover we found that it affected bactericidal activity more than the interference generated by organic substances, particularly against S. aureus. Our study allows to consider chlorhexidine as an effective antiseptic for these gram-positive microorganisms.
 Key words
Key words
Staphylococcus nosocomial, clorhexidina digluconato de, antisépticos, biocidas
ACTIVIDAD DEL DIGLUCONATO DE CLORHEXIDINA SOBRE AISLAMIENTOS HOSPITALARIOS DE STAPHYLOCOCCUS SP EN DIFERENTES CONDICIONES AMBIENTALES
(especial para SIIC © Derechos reservados)
Artículo completo
Introducción
Desde hace tiempo se conocen los problemas que generan las bacterias en distintos ambientes hospitalarios y las consecuencias que trae aparejada su persistencia en estos ámbitos. Estos microorganismos, que sobreviven a través del tiempo, lo que es razonable y además un hecho (1), poseen gran capacidad para adaptarse rápidamente a nuevas circunstancias. Con la implementación de nuevas terapias antibióticas se produce una fuerte presión de selección que provoca, muchas veces por su uso amplio e inapropiado, aumento en la resistencia de los gérmenes, haciendo difícil su control y erradicación (2). Las infecciones hospitalarias (IH) representan una de las mayores causas de deterioro en la salud de los pacientes; éstos pueden adquirir flora bacteriana patogénica durante su internación puesto que la diseminación se realiza por contacto de una persona a otra o a partir de elementos contaminados. En este proceso se hallan microorganismos pertenecientes al género Staphylococcus, cuya especie S aureus es el agente etiológico grampositivo más común de las infecciones, encontrándose algunos de sus integrantes, como por ejemplo los resistentes a meticilina (SAMR), en piel, nariz, sangre y orina; otras especies, como la epidermidis tienen fuerte impacto por su reciente surgimiento como patógenos (3). Se sabe que los desinfectantes y antisépticos son importantes en el control de infecciones nosocomiales, y que los diferentes compuestos varían su respuesta de acuerdo con los diferentes usos. Sus propiedades deben ser totalmente evaluadas antes de adoptarlos para un propósito particular (4), dado que diversos factores atentan contra su efectividad; no respetar estos factores puede significar el fracaso de los procedimientos de desinfección (5). Establecer estos parámetros es tan importante como conocer las respuestas que tienen las bacterias ante situaciones hospitalarias habituales; no considerarlos en contexto amplio, implica comprender sólo una parte del problema dado que no se deben desestimar las distintas variables que los afectan. Actualmente, uno de los agentes químicos más empleado es la clorhexidina (6). Este antiséptico bisguanidínico tiene muchas aplicaciones no sólo en el campo de la salud humana sino también en salud animal y en la industria de la alimentación, entre otros. Es un antimicrobiano efectivo sobre microorganismos grampositivos y gramnegativos, y tiene un buen efecto fungicida y esporicida (1,7). La clorhexidina se caracteriza por su capacidad para matar bacterias por contacto, poseer baja toxicidad y efecto residual; pero, al igual que otros compuestos empleados en procesos de higiene hospitalaria, presenta desventajas tales como ser dependiente del pH y verse afectada por la presencia de materia orgánica (8-10). Conocer la respuesta de las cepas hospitalarias es importante debido a que el digluconato de clorhexidina se emplea, como se ha mencionado, para erradicar agentes causales de IH y, como es bien conocido, no existe hasta el momento desinfectante o antiséptico que pueda ser empleado con total seguridad. Con los mismos propósitos con que se trata de encontrar un antibiótico totalmente eficaz, la literatura científica nos muestra que también se trata de hallar un biocida que resuelva los problemas de los centros asistenciales donde, a pesar de los avances, existen situaciones que todavía no se han resuelto, ya sea por falta de políticas adecuadas o por desconocimiento de la acción y de parámetros que deben considerarse para alcanzar los objetivos planteados (11,12). Teniendo en cuenta que la flora hospitalaria varía constantemente su comportamiento, se estudió cuál es la respuesta que presentan microorganismos del género Staphylococcus, tanto coagulasa positivos como negativos, provenientes de nuestro ámbito hospitalario, frente a digluconato de clorhexidina, simulando condiciones de uso habitual: presencia de materia orgánica y otras variables en el medio de dilución. La prevención, el control y la erradicación de los microorganismos causantes de infecciones en ambientes nosocomiales continúan siendo un problema no resuelto y de permanente actualidad. La relevancia de estos tres procesos se da no sólo por la incidencia directa que tienen sobre las personas y la calidad asistencial de los centros encargados del cuidado de la salud, sino también por sus implicaciones sociales y económicas.Materiales y métodos
Se analizaron 25 cepas hospitalarias del género Staphylococcus pertenecientes a las especies aureus, saprophyticus y haemolyticus, provenientes de hemocultivo, urocultivo, catéter y abscesos, y una cepa de colección S aureus ATCC 6538. La evaluación se realizó en presencia y en ausencia de materia orgánica (albúmina de huevo al 40% y suero humano al 20%), empleándose como medios de dilución agua destilada y agua de 300 ppm de dureza (CaCl2 al 10% + MgSO4 al 10%). Estas variables se estudiaron porque la dureza es una característica predominante de las aguas de la Provincia de Buenos Aires y la materia orgánica constituye una condición frecuentemente encontrada en medios hospitalarios, y al entrar en contacto con biocidas pueden influir sobre la efectividad de los mismos. Las cepas mencionadas fueron enfrentadas a una solución de digluconato de clorhexidina al 20% (Schütz & Co, Alemania) y analizadas mediante el ensayo de Kelsey-Sykes (13), que es específico para valorar agentes químicos de uso hospitalario y permite estimar las concentraciones bactericidas efectivas de desinfectantes y antisépticos. Para ello se realizó un cultivo «overnight» del microorganismo a evaluar a 35 °C - 37 °C, y se preparó una suspensión microbiana estandarizada de 2.7 x 109 ufc/ml en solución fisiológica (NaCl 0.85 g%) (14). A partir de ella se realizó una dilución decimal y se inoculó por tres veces a los 0, 10 y 20 minutos cada una de las concentraciones a ensayar; luego de un tiempo de contacto de 8 minutos, se sembró una muestra en placas de Petri que contenían agar tripteína de soja y la mezcla neutralizante tween 80 al 2% y tiosulfato de sodio al 0.5%, por quintuplicado. El empleo de neutralizante se realiza a fin de prevenir la acción residual del agente químico. Luego que las placas fueron incubadas por 48 horas a 35 °C - 37 °C, se procedió a la lectura de los resultados. Se considera como concentración bactericida efectiva a aquella que no permite el desarrollo de más de 5 ufc/placa, a partir de las 5 gotas sembradas, después del segundo agregado. Todos los ensayos fueron realizados por duplicado y se determinó el pH de los diversos componentes, que no presentaron variación. Todos los resultados fueron analizados estadísticamente mediante el test de Mann-Whitney y Wilcoxon (15).Resultados
La respuesta de los 26 microorganismos fue analizada entre especies, en presencia y ausencia de materia orgánica, para cada condición, y también para el grupo representado por las bacterias hospitalarias respecto de la cepa de referencia. Los resultados hallados con agua destilada, agua dura, albúmina de huevo al 40% y suero humano al 20% demostraron que existe variación en la respuesta de los microorganismos ante la acción del digluconato de clorhexidina (figuras 1, 2 y 3), diferencias de comportamiento que se hicieron más evidentes cuando fueron analizadas para cada condición en forma particular y con respecto a la cepa de colección, como también en ausencia y presencia de materia orgánica.

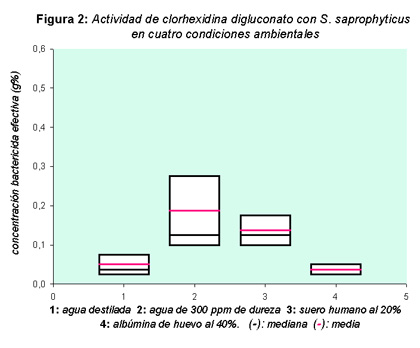
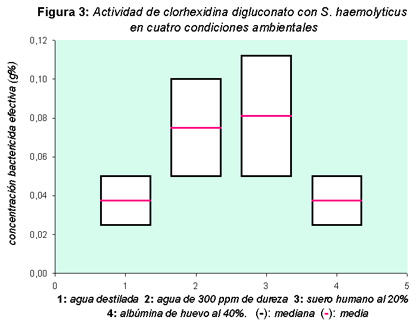
La evaluación entre coagulasa positivos y coagulasa negativos mostró diferencias estadísticas (p < 0.0001), mientras que solamente S aureus presentó diferencias significativas (p = 0.0026) entre ausencia y presencia de materia orgánica. Ante la acción del biocida, el diluyente agua destilada no mostró diferencias estadísticas en ninguno de los casos evaluados. Por el contrario, se halló mayor resistencia a la acción de digluconato de clorhexidina en presencia de agua dura, hallándose diferencias significativas cuando se comparó S aureus (p = 0.0077) y S saprophyticus (p = 0.0571) con agua destilada. S aureus mostró diferencias estadísticas cuando se analizó respecto de la cepa de colección (p = 0.0005), y también entre agua dura y suero (p = 0.0599). Se esperaría tener mayores diferencias, puesto que es de suponer un efecto sumatorio al emplear agua de 300 ppm de dureza como medio de dilución del germicida en presencia de suero. Sin embargo, cuando se analizó suero al 20%, no se encontraron diferencias significativas entre cepas hospitalarias y de colección dado que su comportamiento fue similar. Ante la presencia de materia orgánica se observaron diferentes respuestas con los microorganismos hospitalarios, hallándose que con albúmina de huevo al 40% las concentraciones bactericidas efectivas fueron menores que las estimadas para suero humano al 20%. Las diferencias entre estas dos condiciones fueron significativas desde el punto de vista estadístico para S aureus (p < 0.0001) y S saprophyticus (p = 0.0286), al igual que el análisis realizado entre agua destilada y albúmina (p = 0.0016) para S aureus, siendo agua destilada el diluyente empleado para estudiar esta materia orgánica. Por otra parte, tanto los microorganismos nosocomiales como la cepa de colección requirieron bajas concentraciones de digluconato de clorhexidina en presencia de albúmina, no hallándose diferencias significativas para ninguna de las especies evaluadas. Este hecho merece destacarse puesto que ante una mayor concentración de materia orgánica cabría esperar un aumento en las concentraciones del biocida para poder matar a los microorganismos; sin embargo, esto no se pudo establecer bajo nuestras condiciones de ensayo. Los resultados obtenidos indican que las cepas hospitalarias responden de diferente manera, y que si bien se pudo determinar influencia de la materia orgánica ante la acción del digluconato de clorhexidina, ésta se hizo más evidente con suero que con albúmina, aunque mayor interferencia se produjo en presencia de dureza del agua. La neutralización de clorhexidina presenta divergencias. Algunos autores señalan que deben emplearse mezclas de tween 80, cisteína, histidina y saponina (16) o lubrol W 1%, lecitina 0.5% y tween 80 al 1% (17). Cuando probamos las mezclas sugeridas, no obtuvimos respuestas satisfactorias bajo nuestras condiciones de ensayo, pero sí con una asociación de tween 80 al 2% y tiosulfato de sodio al 0.5%.Discusión
Existe variada información respecto de la acción que ejercen distintas formulaciones que contienen clorhexidina sobre diferentes microorganismos. Algunos autores como Oie y Kamiya (18) sugieren controlar las diluciones de gluconato de clorhexidina porque suelen contaminarse con microorganismos gramnegativos, por lo cual no recomiendan su uso como antiséptico. Sin embargo, otros autores establecen que, como regla general, la mayoría de las bacterias gramnegativas son inhibidas con una concentración de 2 a 2,5 mg/l de clorhexidina, mientras que las grampositivas lo son con una concentración de 1 mg/l (9); cepas resistentes y sensibles a antibióticos son igualmente susceptibles a este biocida (19). Independientemente de estas controversias, se ha establecido que distintas formulaciones de clorhexidina son eficaces con cepas SAMR (16,20,1) y existe un rango significativamente bajo de IH cuando en las unidades de cuidados intensivos se empleó en lugar de alcohol o jabón (8). Según Irizarry y cols, (21) es razonable especular que las cantidades de antisépticos y desinfectantes empleados en ambientes hospitalarios contribuyen a seleccionar y mantener la multirresistencia de SAMR, lo cual tiene importantes consecuencias clínicas. Algunas publicaciones señalan que diferentes formulaciones de clorhexidina se ven afectadas por presencia de materia orgánica (6,9), que son eficaces en ausencia de ella y son más efectivas in vitro con cepas de colección que con aislamientos clínicos (22,23). Cada uno de los autores deja expresa constancia de las diferentes metodologías que han empleado, pero la mayoría proviene de evaluaciones realizadas en otros países; poco o casi nada se sabe de lo que ocurre en nuestro ámbito. Este hecho tiene distintas connotaciones porque no toda la población bacteriana hospitalaria se halla sujeta a la misma presión de selección. Los resultados obtenidos en este estudio muestran que la respuesta de S aureus y S saprophyticus no fue la misma entre las condiciones estudiadas. En ausencia de materia orgánica y para los medios de dilución evaluados se ha establecido que el agua dura influye en mayor grado, incluso más que la presencia de materia orgánica, sobre S aureus, mientras que las otras especies presentaron respuesta similar en ausencia y presencia de materia interfiriente. Se sabe que el efecto bactericida de clorhexidina es el resultado de la unión de esta molécula catiónica a la pared celular bacteriana cargada negativamente (10), y aunque la pared celular parece una barrera efectiva a la entrada de antisépticos y desinfectantes, sustancias de alto peso molecular como clorhexidina pueden atravesar la pared de los estafilococos (6). También se conoce que clorhexidina es dependiente del pH, y es precisamente este parámetro el que permitiría explicar nuestros resultados con agua de 300 ppm de dureza. Puede sugerirse que al estar el digluconato de clorhexidina en contacto con los cationes calcio y magnesio se produce una competencia con el agente químico por la pared celular bacteriana, pero además los aniones sulfato y cloruro interferirían la acción de clorhexidina precipitándola en forma de sal, y como consecuencia se requieren concentraciones mayores para producir un buen efecto bactericida. Es conocido que la máxima adsorción de clorhexidina se produce a pH = 7, que su actividad antibacteriana aumenta cuando existe incremento de pH, en medio alcalino su acción ante S aureus y E coli es óptima (10,3) y que actúa en forma rápida sobre algunas cepas grampositivas (6). Sin embargo, debe considerarse que en medio alcalino es más importante el efecto producido por el pH sobre la pared celular que el ejercido por el cambio de ionización del biocida, y de acuerdo a Hugo y cols (24) no se modifica sustancialmente por encima del pH = 7. En consecuencia, con suero y albúmina que tienen pH alcalino se produciría un incremento en la acción de digluconato de clorhexidina y por ello, en nuestras condiciones de ensayo, se requirieron bajas concentraciones para alcanzar el efecto bactericida. Vale decir que con albúmina al 40%, la competencia entre iones no se produciría y no hubo interferencia en grado tal que ésta constituya una barrera que impida la acción de clorhexidina. Con suero ocurrirían dos fenómenos; por un lado se produciría competencia entre iones, dado que el agua dura fue el diluyente empleado para esta materia orgánica, y por el otro al tener pH alcalino se favorecería la acción de clorhexidina. En consecuencia, las concentraciones bactericidas efectivas fueron más bajas que las establecidas para ausencia de materia interfiriente, pero más altas que las encontradas para albúmina. Es ampliamente debatido cuál de los agentes químicos empleados como antisépticos es el más efectivo en ámbitos hospitalarios. Lowbury (25) demostró que la preparación detergente de clorhexidina al 4% produce inmediata reducción de la flora residente de la piel, mejor que iodopovidona en condiciones similares. Otros autores señalan que una solución alcohólica o acuosa de clorhexidina es tan efectiva como iodopovidona (1,26), y que clorhexidina combinada con etanol al 80% es más efectiva y rápida contra cepas SAMR y sensibles a la meticilina (SAMS) que iodopovidona o digluconato de clorhexidina (17). De acuerdo con los resultados obtenidos en el presente estudio, el digluconato de clorhexidina es un antiséptico que puede considerase efectivo contra cepas grampositivas hospitalarias SAMR y SAMS. Con relación a iodopovidona, clorhexidina tiene efecto residual aún en bajas concentraciones (27), no es irritante y, de acuerdo con resultados previos, iodopovidona está más afectada por presencia de materia orgánica (28), que digluconato de clorhexidina. En el conocimiento de los distintos factores que afectan a biocidas empleados en hospitales, se deben considerar todos los parámetros que puedan interferir la efectividad de ellos. Unicamente de esta manera será posible alcanzar los objetivos previstos, cuando se trata de ejercer un amplio control de infecciones hospitalarias.
 Bibliografía del artículo
Bibliografía del artículo
- Raahave D (1974) Antisepsis of the Operation Site with Aqueous Cetrimide/Chlorhexidine and Chlorhexidine in Alcohol. Acta Chir. Scand. 140: 595-601.
- Piédrola Gil G, Amaro Lasheras J y Cruzet Fernández F (1991) Saneamiento, esterilización y desinfección. En: Piédrola Gil G, del Rey Calero J, Domínguez Carmona M, Cortina Greus P, Gálvez Vargas R, Sierra López A, Sáenz González MC, Gómez López LI, Fernández-Crehuet Navajas J, Salleras Sanmartí L, et al. Medicina Preventiva y Salud Pública. Ed. Masson - Salvat Medicina, Barcelona, España. p. 304-318.
- Hernández Esquivel L y Silva Montaña J (1995) El proceso de prevención de la infección hospitalaria. En: Magalón - Londoño y Hernández Esquivel. Infecciones Hospitalarias. Ed. Médica Panamericana, Bogotá, Colombia. p. 89-120.
- Fraise AP (1999) Choosing disinfectants. J. of Hosp. Infect. 43: 255-264.
- D´Aquino M y Nuñez L (1997) Influencia de la materia orgánica sobre la acción de los desinfectantes. Rev. Arg. Infectología. X: 3-9.
- Mc Donnell G and Russell AD (1999) Antiseptics and Disinfectants: Activity, Action, and Resistance. Clin. Microbiol. Rev. 12: 147-179.
- Altemeier WA (1983) Surgical antiseptics. In: Block, SS, Disinfection, Sterilization and Preservation. Lea & Febiger. Philadelphia. p. 493-504.
- Doebbeling BN, Stanley GL, Sheetz CT, Pfaller MA, Houston AK, Ning Li LA and Wenzel RP (1992) Comparative Efficacy of Alternative Hand-Washing Agents in Reducing Nosocomial Infections in Intensive Care Units. N. Engl. J. Med. 327: 88-93.
- Russell AD and Day MJ (1983) Antibacterial activity of chlorhexidine. J. of Hosp. Infect. 25: 229-238.
- Gardner JF and Gray KG (1983) Chlorhexidine. In: Block, SS, Disinfection, Sterilization and Preservation. Lea & Febiger. Philadelphia. p. 251-270.
- Hernández L, Contreras N, Prieto C, Negret N y Torres N (1995) Infección intrahospitalaria: factores de riesgo y condicionantes. En: Magalón - Londoño y Hernández Esquivel. Infecciones Hospitalarias. Ed. Médica Panamericana, Bogotá, Colombia. p. 675-714.
- Baquero F (1997) Gram-positive resistance: challenge for the development of new antibiotics. J. Antimimicrob Chemother. 39: 1-6.
- Kelsey JC and Sykes G (1969) A new test for the assessment of disinfectants with particular reference to their use in hospitals. Pharm. J. 202: 607-609.
- Farmacopea Argentina (1978) VI Ed. Codex S.A. Buenos Aires. p. 833.
- GraphPAD InStat (1990) Software Versión 1.13.
- Kampf G, Höfer M and Rüden H (1998) Inactivation of chlorhexidine for in vitro testing of disinfectants. Zentralbl. Hyg. Umweltmed. 200: 457-464.
- Sakuragi T, Yanagisawa K and Dan K (1995) Bactericidal Activity of Skin Disinfectants on Methicillin-Resistant Staphylococcus aureus. Anesth. Analg. 81: 555-558.
- Oie S and Kamiya A (1996) Microbial contamination of antiseptics and disinfectants. Infect. Control. 24: 389-395.
- Jones RD (1999) Bacterial resistance and topical antimicrobial wash products. Am. J. Infect. Control. 27: 351-363
- Faoagali JL, George N, Fong J, Davy J and Dowser M (1999) Comparison of the antibacterial efficacy of 4% chlorhexidine gluconate and 1% triclosan handwash products in an acute clinical ward. Am. J. Infect. Control. 27: 320-326.
- Irizarry L, Merlin T, Rupp J and Griffith J (1996) Reduced Susceptibility of Methicillin-Resistant Staphylococcus aureus to Cetylpyridinium Chloride and Chlorhexidine. Chemotherapy. 42: 248-252.
- Michel D and Zach GA (1997) Antiseptics Efficacy of Disinfecting Solutions in Suspension Test in vitro against Methicillin-Resistent Staphylococcus aureus, Pseudomonas aeruginosa and Escherichia coli in Pressure Sore Wounds after Spinal Cord Injury. Dermatology. 195: 36-41.
- Odore R, Colombatti Valle V and Re G (2000) Efficacy of chlorhexidine against some strains of cultured and clinically isolated microorganisms. Vet. Res. Commun. 24: 229-238.
- Hugo WB and Longworth AR (1964) Some aspects of the mode of action of chlorhexidine. J. Pharm. Pharmacol. 16: 655-662.
- Lowbury EJL and Lilly HA (1973) Use of 4% Chlorhexidine Detergent Solution (Hibiscrub) and Other Methods of Skin Disinfection. British. Medical J. 1: 510-515.
- Maki DG and Tambyah PA (2001) Engineering Out the Risk of Infection with Urinary Catheters. Emerg. Infect. Dis. 7: 1-6.
- Haley CE, Marling-Cason M, Smith JW, Luby JP and Mackowiak PA (1985) Bactericidal Activity of Antiseptics Against Methicillin-Resistant Staphylococcus aureus. J. of Clin. Microbiol. 21: 991-992.
- Reynaldo MB, Flores MB, Infanti AY, Viegas Caetano JA, Castelo SM, Benítez ME, Magariños MC y D´Aquino M (2000) Variación de resistencia a biocidas de Staphylococcus spp intrahospitalario. Acta Bioquímica Clínica Latinoamericana XXXIV: 463-470.
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC





 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a:

