NUEVA QUIMIOTERAPIA DIRIGIDA
(especial para SIIC © Derechos reservados)
Coautor
Vilmarie M. Rodriguez*
Mayo Clinic, Pediatric Hematology/Oncology*
Recepción del artículo: 26 de mayo, 2003
Aprobación: 0 de , 0000
 Conclusión breve
La combinación de gemcitabina con samario, más la transfusión de células madre hematopoyéticas, fue de ayuda en el tratamiento de cánceres que involucran los huesos
Conclusión breve
La combinación de gemcitabina con samario, más la transfusión de células madre hematopoyéticas, fue de ayuda en el tratamiento de cánceres que involucran los huesos
 Resumen
El acoplamiento químico de una partícula con afinidad por el hueso a un metal radiactivo, samario, produjo una nueva droga radiofarmacéutica específicamente dirigida a los huesos y la médula ósea. Esto permite que la radiación sea emitida específicamente a los cánceres formadores de hueso (osteosarcomas) así como a los que causan neoformación ósea cuando invaden los huesos (por ejemplo, carcinomas tales como el de mama y de próstata, paragangliomas y condrosarcomas). Esta breve revisión discute algunos de los principios del uso eficaz del samario en altas dosis para tratar cánceres que involucran los huesos así como neoplasias hematológicas que toman la médula ósea (por ejemplo leucemia mielógena aguda y mieloma múltiple). Se describe la gran ventaja terapéutica comparada con la baja toxicidad de altas dosis de samario observada en nuestra experiencia en la Clínica Mayo. Se detalla el uso del samario como parte de un enfoque secuencial, que abarca el cáncer de hueso y/o médula ósea.
Resumen
El acoplamiento químico de una partícula con afinidad por el hueso a un metal radiactivo, samario, produjo una nueva droga radiofarmacéutica específicamente dirigida a los huesos y la médula ósea. Esto permite que la radiación sea emitida específicamente a los cánceres formadores de hueso (osteosarcomas) así como a los que causan neoformación ósea cuando invaden los huesos (por ejemplo, carcinomas tales como el de mama y de próstata, paragangliomas y condrosarcomas). Esta breve revisión discute algunos de los principios del uso eficaz del samario en altas dosis para tratar cánceres que involucran los huesos así como neoplasias hematológicas que toman la médula ósea (por ejemplo leucemia mielógena aguda y mieloma múltiple). Se describe la gran ventaja terapéutica comparada con la baja toxicidad de altas dosis de samario observada en nuestra experiencia en la Clínica Mayo. Se detalla el uso del samario como parte de un enfoque secuencial, que abarca el cáncer de hueso y/o médula ósea.
 Palabras clave
Samario, cáncer de hueso, esqueleto, radiación, leucemia mielógena aguda, osteosarcoma, metástasis óseas, gammagrafía ósea, PET, trasplante de médula ósea, rescate de células madre
Clasificación en siicsalud
Palabras clave
Samario, cáncer de hueso, esqueleto, radiación, leucemia mielógena aguda, osteosarcoma, metástasis óseas, gammagrafía ósea, PET, trasplante de médula ósea, rescate de células madre
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/20154
Especialidades
 Principal: Farmacología, Medicina Farmacéutica, Osteoporosis y Osteopatías Médicas, Pediatría,
Principal: Farmacología, Medicina Farmacéutica, Osteoporosis y Osteopatías Médicas, Pediatría,
 Relacionadas: Medicina Interna, Oncología, Pediatría,
Relacionadas: Medicina Interna, Oncología, Pediatría,
 Enviar correspondencia a:
Enviar correspondencia a:
Peter M. Anderson MD, PhD. Mayo Clinic, Pediatric Oncology. 200 First St SW, Rochester MN 55905, EE.UU.
TARGETING THE SKELETON AND CANCER IN BONE: SAMARIUM TREATMENT OF OSTEOSARCOMA, OSTEOBLASTIC BONE METASTASES, AND HEMATOLOGIC MALIGNANCY IN THE BONE MARROW
 Abstract
Abstract
Chemical coupling of a bone-seeking chemical moiety to a radioactive metal, samarium, has produced a new radiopharmaceutical drug that has very specific targeting to the bones and bone marrow. This allows radiation to be specifically delivered to cancers that make bone (osteosarcoma) as well as cancers that cause new bone formation when they invade bones (e.g. carcinomas such as breast cancer and prostate cancer, paragangliomas, and chondrosarsomas). This mini-review discusses some of the principles of effective use of high-dose samarium to treat malignancies involving the bones as well as hematologic malignancies involving the bone marrow (e.g. acute myelogenous leukemia and multiple myeloma). The high therapeutic benefit compared to low toxicity of high-dose samarium in our Mayo Clinic experience is described. The use of samarium as part of a sequential, comprehensive approach to cancer involving the bones and/or bone marrow is detailed
 Key words
Key words
Samario, cáncer de hueso, esqueleto, radiación, leucemia mielógena aguda, osteosarcoma, metástasis óseas, gammagrafía ósea, PET, trasplante de médula ósea, rescate de células madre
NUEVA QUIMIOTERAPIA DIRIGIDA
(especial para SIIC © Derechos reservados)
Artículo completo
¿Qué es el samario
La terapia oncológica dirigida específicamente al cáncer en el esqueleto implica aumentar la efectividad de la intervención contra las células cancerosas sin afectar el tejido normal adyacente. Aunque la quimioterapia y la radioterapia son modalidades de tratamiento comunes y eficaces para las neoplasias esqueléticas,1 los radioisótopos con afinidad por el hueso ofrecen una nueva oportunidad de proporcionar beneficios adicionales al apuntar específicamente a las lesiones del esqueleto y/o formadoras de hueso (por ejemplo metástasis osteoblásticas en el esqueleto, neoplasias en la médula y osteosarcomas osteoblásticos).Las lesiones del esqueleto, de las metástasis osteoblásticas y las osteoblásticas del osteosarcoma normalmente tienen mediana, moderadamente ávida y muy alta captación de fosfonatos con afinidad por el hueso. Tanto el 99mTc-MDP (el trazador radiactivo usado para las exploraciones óseas rutinarias mediante gammagrafías) como el 153Sm-EDTMP (un radioisótopo emisor de radiación beta y gamma que permite la toma de imágenes y la dosimetría) se dirigen específicamente al esqueleto, las metástasis osteoblásticas y los osteosarcomas, con altos índices de acoplamiento/avidez tumor (hueso)/sangre y tumor (hueso)/músculo.2-5 La gammagrafía ósea es altamente predictiva de la dosis de captación y de radiación que puede ser entregada usando samario (figura 1).
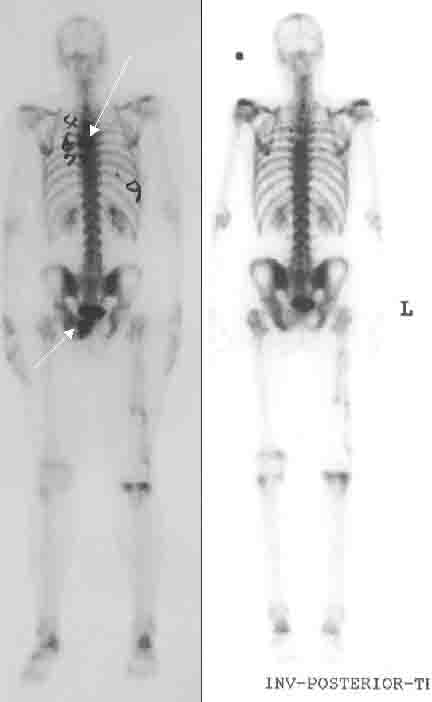
Figura 1. Ejemplo de captación intensa del radioisótopo con afinidad ósea 153Sm-EDTMP en el esqueleto y el tumor formador de hueso (osteosarcoma). Observe que hay captación en todo el esqueleto, ligeramente más acentuada en una metástasis en la columna dorsal, pero principalmente en una metástasis en la pelvis. Esta imagen demuestra que el samario se liga fuertemente y la radiactividad es fácilmente detectada mediante cámara gamma estándar para gammagrafía ósea.
En el osteosarcoma canino se demostró inicialmente alto índice terapéutico de la radiación emitida por 153Sm-EDTMP en lesiones cancerosas formadoras de hueso.6 Muchos de los perros en esta serie tenían respuestas clínicas durables con dosis estándar de 153Sm-EDTMP. Estudios posteriores en Oslo también demostraron la eficacia clínica de 153Sm-EDTMP en el osteosarcoma canino.7En ensayos clínicos fase I/II8-15 así como en ensayos clínicos aleatorizados16 se detalló la focalización terapéutica de las metástasis esqueléticas osteoblásticas por 153Sm-EDTMP. La radioterapia dirigida al osteosarcoma humano usando 153Sm-EDTMP mostró por primera vez ser prometedora al paliar en forma extremadamente impresionante un osteosarcoma recurrente, recidivado, que involucraba la columna dorsal con hemiparesia asociada en un hombre de 35 años.17 El dolor en el sitio de recurrencia L1 mejoró marcadamente; el déficit neurológico (paresia) se resolvió por meses después de la administración del radioisótopo con afinidad ósea. El 153Sm-EDTMP (samarium 153Sm lexidronam) fue aprobado por la FDA (Food and Drugs Administration) para el tratamiento de las metástasis óseas en 1997.Se han estudiado la captación, localización y retención de 153Sm-EDTMP en el hueso y lesiones formadoras de hueso.2,3,18-23 Luego de su administración, se observa rápida depuración del samario en sangre y tejidos no óseos.3 El 153Sm-EDTMP permanece fuertemente ligado luego de la captación esquelética, con una vida media de eliminación del hueso (30 días) que excede por lejos la vida media física del radioisótopo (47 horas).22 Después de la administración intravenosa de 153Sm-EDTMP, más del 90% de la dosis inyectada se elimina de la sangre dentro de las 2 horas.4 El samario que no se deposita en sitios óseos o lesiones osteoblásticas se elimina por la orina casi totalmente dentro de las 6 horas. El hueso normal puede tener una meseta de captación en las superficies corticales; las lesiones esqueléticas osteoblásticas tienen de 3 a 7 veces mayor captación. No hemos visto un límite superior de depósito en hueso con altas dosis de 153Sm-EDTMP.Se ha observado efectividad clínica contra metástasis esqueléticas con dosis estándar de 153Sm-EDTMP.16,24 Sin embargo, los efectos tóxicos que limitan la dosis de samario son la leucopenia (baja producción de glóbulos blancos por la médula) y la trombocitopenia (baja producción de plaquetas por la médula). Estos efectos secundarios ocurren porque la médula es un "espectador inocente" del depósito del radioisótopo en el esqueleto, lo cual no sorprende si uno recuerda que este patrón es como el "cuadro esquelético" visto en una imagen de gammagrafía ósea plana típica. Sin embargo, en el caso de cáncer que comprometa la médula (por ejemplo mieloma, linfoma o leucemia) la afinidad esquelética de 153Sm-EDTMP puede proporcionar una forma nueva y relativamente segura de conseguir altas cantidades de radiación terapéutica en la médula pero no en otros órganos.Altas dosis de samario pueden ser muy efectivas, pero necesitan la infusión de células madre 2 semanas más tarde
A pesar de que el bajo recuento hemático debido a la radiación esquelética generalizada por el samario es un problema potencialmente serio, hay una solución relativamente sencilla que permite administrar hasta 30 veces más samario y emitir una dosis de radiación mucho más alta al esqueleto. Esto es posible con la infusión de células progenitoras hemáticas periféricas ("células madre hemáticas") para rescatar la médula dos semanas después de una dosis alta de samario. Se ha demostrado que se evitan graves problemas a largo plazo por bajos recuentos de sangre.En la Clínica Mayo hemos demostrado que es posible aplicar dosis altas de samario seguidas por "rescate" con células madre con seguridad y mínima internación (1-2 días). Las células madre, por supuesto, se deben infundir después de la declinación física del samario. La dosis máxima tolerada en nuestra experiencia en la Clínica Mayo de Rochester (30 mCi/kg) se relacionó con calcemia baja y durante la infusión del samario, así como con consideraciones prácticas del manejo y la administración de gran cantidad de radiación terapéutica (1 500 - 3 000 mCi/paciente).Las estrategias para aumentar la eficacia de altas dosis de samario para el cáncer esquelético están muy relacionadas con el modelo de cuidado multidisciplinario de la Clínica Mayo (tabla 1), e incluyen: - quimioterapia (por ejemplo melfalán) en las neoplasias hematológicas que involucran la médula
- uso de radiación antes o después del samario (por ejemplo, en osteosarcomas, carcinomas y otros cánceres con metástasis óseas)
- eliminación de la enfermedad no ósea con otras estrategias locales (por ejemplo, embolización, cirugía, ablación con radiofrecuencia o "RFA")
- enfoque paso a paso de la evaluación de enfermedad activa con los mejores métodos de exploración disponibles, incluyendo la gammagrafía ósea y PET para determinar la extensión del compromiso óseo tratable con samario vs. el metabolismo activo del tumor
- eliminación quirúrgica de la enfermedad de los tejidos blandos que no es probable que responda al samario (por ejemplo, metástasis pulmonares), antes de la terapia con samario
- radiosensibilización con gemcitabina
Se eligió gemcitabina porque no sólo tiene amplio espectro de actividad antineoplástica, sino también es un radiosensibilizador potente. Los resultados preliminares de nuestro estudio actual con altas dosis de samario seguido por gemcitabina y rescate con células madre en el osteosarcoma están dando información acerca de los principios y la logística del uso de esta nueva estrategia enfocada a las neoplasias esqueléticas.Los cánceres esqueléticos que hemos tratado con este enfoque en la Clínica Mayo abarcan leucemias mielógenas agudas, discrasias de células plasmáticas, metástasis osteoblásticas óseas y osteosarcomas. Actualmente estamos realizando una experiencia en cerca de 100 pacientes (que proveyeron su consentimiento informado) usando samario en altas dosis con apoyo de células madre hematopoyéticas. Leucemia mielógena aguda (LMA)
Los regímenes preparatorios estándar de trasplante de sangre y médula ósea que usan quimioterapia con irradiación total del cuerpo (ITC) a partir de una fuente externa estándar han demostrado ser levemente superiores a los regímenes con quimioterapia solamente (por ejemplo, busulfán/ciclofosfamida). Aunque la adición de ITC a los regímenes de quimioterapia completamente mieloablativos (es decir drogas quimioterápicas en dosis capaces de destruir la totalidad de la médula ósea de los recipientes y la función inmune, como por ejemplo busulfán + ciclofosfamida + ITC) puede disminuir las recaídas, el aumento de los efectos secundarios tales como los daños pulmonares permanentes hacen que no mejore la supervivencia total. Puesto que nuestros estudios de dosimetría indican que 19-30 mCi/kg de 153Sm-EDTMP pueden proporcionar aproximadamente 3 000 - 4 000 cGy al esqueleto con una cantidad minúscula de radiación a los pulmones, hemos utilizado 153Sm-EDTMP en individuos de alto riesgo con LMA y contraindicación relativa de ITC. Se dan a continuación algunos detalles acerca de cómo fue realizado esto en dos casos ilustrativos.Un paciente con compromiso de la médula y el sistema nervioso central por LMA recibió samario el día -14 seguido por la dosis estándar de busulfán (1 mg/kg/dosis cada 6 horas x 16 dosis los días -9 a -6) y ciclofosfamida (50 mg/kg/dosis los días -5 a -2). La toxicidad fue similar a la del régimen estándar de quimioterapia de busulfán/ciclofosfamida para este trasplante alogénico entre hermanos compatibles. Aunque hubo citopenia precoz debido al efecto del samario, la especificidad de la radiación por el hueso se demostró porque el paciente pudo mantener la nutrición enteral durante el régimen preparatorio y las primeras semanas postrasplante. Aunque se logró la remisión con 100% de aceptación del injerto, la recaída del sistema nervioso central y subsecuentemente de la médula ocurrió en los meses 5 y 7, respectivamente.Un segundo paciente, de 15 años, con sarcoma de Ewing y leucemia secundaria de alto riesgo permanece en remisión a los 2 años, después de un régimen de preparación con samario y trasplante autólogo. Las células madre autólogas estaban disponibles en este caso porque fueron cultivadas poco después del diagnóstico de sarcoma de Ewing de alto riesgo. La citogenética en este caso de leucemia secundaria era de muy alto riesgo (monosomía 7). El paciente recibió quimioterapia de inducción y logró la remisión antes de la terapia de altas dosis. El régimen preparatorio era de 30 mCi/kg 153Sm-EDTMP (día -14) y melfalán (140 mg/m2 el día -2). El paciente continuó en forma ambulatoria después de la infusión de células madre hemáticas y tuvo pocos efectos colaterales, excepto por citopenias temporarias. Pudo reasumir sus actividades normales luego de semanas del trasplante basado en samario. Este adolescente en la actualidad tiene una gran calidad de vida.Discrasias de células plasmáticas
Se vio una respuesta clínica gratificante en un hombre con síndrome POEMS (polineuropatía, organomegalia, endocrinopatía, gammapatía monoclonal y cambios en la piel) luego de altas dosis de samario y melfalán seguidas de infusión de células progenitoras hemáticas autólogas. El estudio actual de altas dosis de samario y melfalán para el mieloma múltiple en la Clínica Mayo está casi completado (A. Dispenzieri, comunicación personal; otros investigadores del grupo son la Dra. Martha Lacy y el Dr. Morie Gertz.). Este estudio utiliza una dosis de prueba para definir la dosis terapéutica que administrará cerca de 3 000 cGy a la médula. La dosis requerida para alcanzar esto es generalmente de 20-24 mCi/kg.Metástasis óseas osteoblásticas
Hemos tratado a pacientes con metástasis óseas de adenocarcinoma, cáncer de mama, condrosarcoma y paraganglioma. Una paciente con paraganglioma y metastásis ósea ilustra la utilidad y la logística del samario en altas dosis como parte de una "estrategia apuntada al cáncer" paliativa y agresiva. En esta paciente la gammagrafía ósea mostró captación ávida en 3 de 4 lesiones. Las células madre autológas fueron cultivadas usando movilización G-CSF, en Montana. Se realizó radioterapia externa a las lesiones de la columna (4 000 cGy). Se usaron altas dosis de samario (30 mCi/kg) en la Clínica Mayo, seguidas por rescate con células madre autólogas 14 días más tarde en el hospital de derivación en Montana. La paciente permaneció ambulatoria. Recibió una transfusión de glóbulos rojos y dos de plaquetas. La recuperación hematopoyética no tuvo problemas. El dolor anunció el empeoramiento de una lesión paraespinal no osteoblástica. Se realizó ablación por radiofrecuencia (calentamiento preciso del tumor para matar a las células malignas). Este paciente continúa con buena salud, 2 años después de la terapia dirigida a las metástasis osteoblásticas del hueso con samario y ablación con radiofrecuencia de la lesión no osteoblástica restante.Osteosarcoma
La gammagrafía ósea es la prueba más útil para determinar si un osteosarcoma tendrá retención favorable de 153Sm-EDTMP. Puesto que estos tumores y las metástasis óseas forman hueso activamente, a algunos osteosarcomas se les puede entregar muy altas de radiación. Hemos aplicado dosis estimadas de 3 900 - 22 000 cGy a lesiones de osteosarcoma en pacientes con imágenes favorables. Aunque todos los pacientes con dolor óseo al momento del tratamiento han tenido alivio muy significativo o completo después del samario en altas dosis, es común la reactivación temporaria (flare) del dolor durante 1 día. Los resultados no son durables en la mayoría de los pacientes; son habituales las recaídas en el sitio de captación ósea tomográfica y/o en sitios distantes, particularmente los pulmones.Las potenciales razones de este patrón de fracaso incluyen la heterogeneidad de la captación (es decir, la neoformación de hueso ocurre solamente en algunas partes del tumor), la corta longitud de la trayectoria de la radiactividad emitida por el samario (≈1 mm) y que el osteosarcoma no se considera un tumor particularmente radiosensible. Puesto que los osteosarcomas tratados con radiación y quimioterapia tuvieron mejores resultados de lo esperado en dos estudios recientes, también es posible que nuestra serie estuviera sesgada al estar compuesta por pacientes resistentes, refractarios, con osteosarcoma con pocas probabilidades de responder a cualquier terapia, incluyendo la radiación. Debido a ello, hemos comenzado a usar gemcitabina como radiosensibilizador 1 día después de que el samario está irreversiblemente unido al hueso.Aunque muchas células se radiosensibilizarán, sólo aquellas muy cercanas al hueso tendrán un efecto radiobiológico aumentado. Como en informes anteriores, el esquema de administración de gemcitabina fue muy importante. Dosis bajas de gemcitabina (200 mg/m2/dosis/día por 5 días) se asociaron con mucositis grado 3 (n = 1), un efecto secundario no visto con samario solo o con una sola dosis de gemcitabina (1 500 mg/m2) dada 1 día después del samarium (n = 10). Nos sentimos alentados por las gammagrafías óseas, que mejoraron más rápidamente con la combinación de samario + gemcitabina comparada con samario solo (figura 2).

Figura 2. Gammagrafía ósea antes y después de la administración de samario. La captación del marcador está muy disminuida después de altas dosis de samario + gemcitabina. La gemcitabina empleada 1 día después del samario aumentó la eficacia del radioisótopo sin incrementos en la toxicidad.
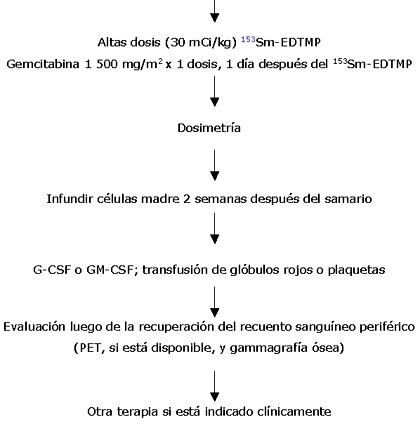
La logística de nuestro ensayo clínico se diagrama a continuación. - Documentación de una o más lesiones osteoblásticas (observables en la gammagrafía ósea)
- Cultivo y criopreservación de células madre; meta: > 5 x 106 CD34+/kg; mínimo: 2 x 106 CD34+/kg
- Consideración de radioterapia local externa al componente de tejido blando de las lesiones identificadas
- Estudios de reestadificación antes del tratamiento con samario
 Bibliografía del artículo
Bibliografía del artículo
- Owen, J.B., L.R. Coia, and G.E. Hanks, Recent patterns of growth in radiation therapy facilities in the United States: a patterns of care study report. Int J Radiat Oncol Biol Phys, 1992. 24(5): p. 983-6.
- Goeckeler, W.F., et al., 153Sm radiotherapeutic bone agents. Int J Rad Appl Instrum B, 1986. 13(4): p. 479-82.
- Goeckeler, W.F., et al., Skeletal localization of samarium-153 chelates: potential therapeutic bone agents. J Nucl Med, 1987. 28(4): p. 495-504.
- Singh, A., et al., Human pharmacokinetics of samarium-153 EDTMP in metastatic cancer. J Nucl Med, 1989. 30(11): p. 1814-8.
- Laznicek, M., et al., Comparison of biological characteristics of EDTMP complexes with 99mTc, 111In and 153Sm in rats. Appl Radiat Isot, 1994. 45(9): p. 949-53.
- Lattimer, J.C., et al., Clinical and clinicopathologic response of canine bone tumor patients to treatment with samarium-153-EDTMP. J Nucl Med, 1990. 31(8): p. 1316-25.
- Aas, M., et al., Internal radionuclide therapy of primary osteosarcoma in dogs, using 153Sm-ethylene-diamino-tetramethylene-phosphonate (EDTMP). Clin Cancer Res, 1999. 5(10 Suppl): p. 3148s-3152s.
- Turner, J.H., et al., Samarium-153 EDTMP therapy of disseminated skeletal metastasis. Eur J Nucl Med, 1989. 15(12): p. 784-95.
- Turner, J.H., et al., A phase I study of samarium-153 ethylenediaminetetramethylene phosphonate therapy for disseminated skeletal metastases. J Clin Oncol, 1989. 7(12): p. 1926-31.
- Turner, J.H. and P.G. Claringbold, A phase II study of treatment of painful multifocal skeletal metastases with single and repeated dose samarium-153 ethylenediaminetetramethylene phosphonate. Eur J Cancer, 1991. 27(9): p. 1084-6.
- Sandeman, T.F., R.S. Budd, and J.J. Martin, Samarium-153-labelled EDTMP for bone metastases from cancer of the prostate. Clin Oncol (R Coll Radiol), 1992. 4(3): p. 160-4.
- Holmes, R.A., [153Sm]EDTMP: a potential therapy for bone cancer pain. Semin Nucl Med, 1992. 22(1): p. 41-5.
- Collins, C., et al., Samarium-153-EDTMP in bone metastases of hormone refractory prostate carcinoma: a phase I/II trial. J Nucl Med, 1993. 34(11): p. 1839-44.
- Bayouth, J.E., et al., Dosimetry and toxicity of samarium-153-EDTMP administered for bone pain due to skeletal metastases. J Nucl Med, 1994. 35(1): p. 63-9.
- Tian, J.H., et al., Multicentre trial on the efficacy and toxicity of single-dose samarium- 153-ethylene diamine tetramethylene phosphonate as a palliative treatment for painful skeletal metastases in China. Eur J Nucl Med, 1999. 26(1): p. 2-7.
- Serafini, A.N., et al., Palliation of pain associated with metastatic bone cancer using samarium-153 lexidronam: a double-blind placebo-controlled clinical trial. J Clin Oncol, 1998. 16(4): p. 1574-81.
- Bruland, O.S., et al., Targeted radiotherapy of osteosarcoma using 153 Sm-EDTMP. A new promising approach. Acta Oncol, 1996. 35(3): p. 381-4.
- Ketring, A.R., 153Sm-EDTMP and 186Re-HEDP as bone therapeutic radiopharmaceuticals. Int J Rad Appl Instrum B, 1987. 14(3): p. 223-32.
- Heggie, J.C., Radiation absorbed dose calculations for samarium-153-EDTMP localized in bone. J Nucl Med, 1991. 32(5): p. 840-4.
- Eary, J.F., et al., Samarium-153-EDTMP biodistribution and dosimetry estimation. J Nucl Med, 1993. 34(7): p. 1031-6.
- Heggie, J.C., Samarium-153-EDTMP dosimetry. J Nucl Med, 1994. 35(1): p. 191-2.
- Louw, W.K., et al., Evaluation of samarium-153 and holmium-166-EDTMP in the normal baboon model. Nucl Med Biol, 1996. 23(8): p. 935-40.
- van Rensburg, A.J., A.S. Alberts, and W.K. Louw, Quantifying the radiation dosage to individual skeletal lesions treated with samarium-153-EDTMP. J Nucl Med, 1998. 39(12): p. 2110-5.
- Resche, I., et al., A dose-controlled study of 153Sm- ethylenediaminetetramethylenephosphonate (EDTMP) in the treatment of patients with painful bone metastases. Eur J Cancer, 1997. 33(10): p. 1583-91.
- Franzius, C., et al., High-activity samarium-153-EDTMP therapy in unresectable osteosarcoma. Nuklearmedizin, 1999. 38(8): p. 337-40.
- Franzius, C., et al., High-activity samarium-153-EDTMP therapy followed by autologous peripheral blood stem cell support in unresectable osteosarcoma. Nuklearmedizin, 2001. 40(6): p. 215-20.
- Anderson, P.M., et al., High-dose samarium-153 ethylene diamine tetramethylene phosphonate: low toxicity of skeletal irradiation in patients with osteosarcoma and bone metastases. J Clin Oncol, 2002. 20(1): p. 189-96.
- McGinn, C.J., D.S. Shewach, and T.S. Lawrence, Radiosensitizing nucleosides. J Natl Cancer Inst, 1996. 88(17): p. 1193-203.
- Mason, K.A., et al., Maximizing therapeutic gain with gemcitabine and fractionated radiation. Int J Radiat Oncol Biol Phys, 1999. 44(5): p. 1125-35.
- Seong, J., S.H. Kim, and C.O. Suh, Enhancement of tumor radioresponse by combined chemotherapy in murine hepatocarcinoma. J Gastroenterol Hepatol, 2001. 16(8): p. 883-9.
- Eisbruch, A., et al., Radiation concurrent with gemcitabine for locally advanced head and neck cancer: a phase I trial and intracellular drug incorporation study. J Clin Oncol, 2001. 19(3): p. 792-9.
- Pattaranutaporn, P., et al., Phase II study of concurrent gemcitabine and radiotherapy in locally advanced stage IIIB cervical carcinoma. Gynecol Oncol, 2001. 81(3): p. 404-7.
- McGinn, C.J. and T.S. Lawrence, Recent advances in the use of radiosensitizing nucleosides. Semin Radiat Oncol, 2001. 11(4): p. 270-80.
- Cividalli, A., et al., Combined use of gemcitabine and radiation in mice. Anticancer Res, 2001. 21(1A): p. 307-12.
- Hogan, W.J., et al., Successful treatment of POEMS syndrome with autologous hematopoietic progenitor cell transplantation. Bone Marrow Transplant, 2001. 28(3): p. 305-9.
- Kamada, T., et al., Efficacy and safety of carbon ion radiotherapy in bone and soft tissue sarcomas. J Clin Oncol, 2002. 20(22): p. 4466-71.
- Machak, G.N., et al., Neoadjuvant chemotherapy and local radiotherapy for high-grade osteosarcoma of the extremities. Mayo Clin Proc, 2003. 78(2): p. 147-55.
- O\'Rourke, T.J., et al., Phase I clinical trial of gemcitabine given as an intravenous bolus on 5 consecutive days. Eur J Cancer, 1994. 3: p. 417-8.
- Abbruzzese, J.L., Phase I studies with the novel nucleoside analog gemcitabine. Semin Oncol, 1996. 23(5 Suppl 10): p. 25-31.
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC




 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a:


