EXPRESION FENOTIPICA DE LA MUTACION C282Y ASOCIADA CON EL DESARROLLO DE HEMOCROMATOSIS EN NORUEGA Y EN OTROS PAISES
(especial para SIIC © Derechos reservados)
Coautor
Helge Bell*
Profesor, Unidad de Hepatología, Departamento de Medicina, Aker University Hospital*
Recepción del artículo: 12 de septiembre, 2002
Aprobación: 0 de , 0000
 Conclusión breve
El estudio genético puede detectar la mutación C282Y en individuos clínicamente asintomáticos que no desarrollarán hemocromatosis; por esta razón, su valor predictivo y preventivo es limitado.
Conclusión breve
El estudio genético puede detectar la mutación C282Y en individuos clínicamente asintomáticos que no desarrollarán hemocromatosis; por esta razón, su valor predictivo y preventivo es limitado.
 Resumen
Casi el 0.5% de la población caucásica es homocigota para el gen HFE C282Y, asociado con el desarrollo de hemocromatosis. La prevalencia de la alteración genética es particularmente elevada en el Norte de Europa. Estudios recientes sugieren que la mutación no siempre se expresa en hemocromatosis clínica. Presentamos una síntesis de un trabajo publicado con anterioridad y lo analizamos en el contexto de los conocimientos más recientes. El trabajo original muestra la prevalencia del alelo C282Y en una población hospitalizada y estudia la expresión fenotípica en homocigotas. Se tomaron muestras de sangre en 1 900 pacientes caucásicos internados por patologías agudas. Catorce (0.74%) eran homocigotas para la mutación C282Y. Diez de ellos tenían expresión bioquímica leve o moderada de hemocromatosis, 2 no tenían expresión clínica y los dos restantes tenían cirrosis hepática (uno de ellos con hepatocarcinoma). Estudios de rastreo similares realizados en otros países sugirieron que sólo la mitad de los individuos homocigotas para la mutación C282Y tenía evidencia de aumento de los parámetros de hierro. La progresión a enfermedad clínica sería muy inferior aún. En conclusión, el rastreo de la mutación C282Y detecta individuos que no necesariamente desarrollan hemocromatosis. La expresión fenotípica es un aspecto importante a tener en cuenta cuando se realizan estudios poblacionales de hemocromatosis.
Resumen
Casi el 0.5% de la población caucásica es homocigota para el gen HFE C282Y, asociado con el desarrollo de hemocromatosis. La prevalencia de la alteración genética es particularmente elevada en el Norte de Europa. Estudios recientes sugieren que la mutación no siempre se expresa en hemocromatosis clínica. Presentamos una síntesis de un trabajo publicado con anterioridad y lo analizamos en el contexto de los conocimientos más recientes. El trabajo original muestra la prevalencia del alelo C282Y en una población hospitalizada y estudia la expresión fenotípica en homocigotas. Se tomaron muestras de sangre en 1 900 pacientes caucásicos internados por patologías agudas. Catorce (0.74%) eran homocigotas para la mutación C282Y. Diez de ellos tenían expresión bioquímica leve o moderada de hemocromatosis, 2 no tenían expresión clínica y los dos restantes tenían cirrosis hepática (uno de ellos con hepatocarcinoma). Estudios de rastreo similares realizados en otros países sugirieron que sólo la mitad de los individuos homocigotas para la mutación C282Y tenía evidencia de aumento de los parámetros de hierro. La progresión a enfermedad clínica sería muy inferior aún. En conclusión, el rastreo de la mutación C282Y detecta individuos que no necesariamente desarrollan hemocromatosis. La expresión fenotípica es un aspecto importante a tener en cuenta cuando se realizan estudios poblacionales de hemocromatosis.
 Palabras clave
Hemocromatosis, mutación del gen HFE, rastreo, ferritina
Clasificación en siicsalud
Palabras clave
Hemocromatosis, mutación del gen HFE, rastreo, ferritina
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/20321
Especialidades
 Principal: Genética Humana,
Principal: Genética Humana,
 Relacionadas: Diagnóstico por Laboratorio, Epidemiología, Gastroenterología, Hematología, Medicina Interna,
Relacionadas: Diagnóstico por Laboratorio, Epidemiología, Gastroenterología, Hematología, Medicina Interna,
 Enviar correspondencia a:
Enviar correspondencia a:
Dra. S. Distante. Hepatology Unit, Department of Medicine; Aker University Hospital, Oslo 0514, Norway.
PHENOTYPIC EXPRESSION OF THE HEMOCHROMATOSIS ASSOCIATED C282Y MUTATION IN NORWAY AND ABROAD
 Abstract
Abstract
Up to 0.5% of the Caucasian population is homozygous for the HFE gene C282Y mutation associated to hemochromatosis. Especially high prevalence figures have been reported in Northern Europe. Recent studies suggest that this mutation is not always associated with overt clinical haemochromatosis. We present a synthesis of a previously published study and set it in the light of newer findings. The original study reports the prevalence of the C282Y allele in a hospitalised population and studies the phenotypic expression in the homozygotes. Blood samples were obtained from 1900 acutely hospitalised Caucasians patients. Fourteen patients (0.74%) were homozygous for the C282Y mutation. Ten of these displayed mild to moderate biochemical expression of haemochromatosis, 2 patients were "non expressing" and 2 had liver cirrhosis (one with hepatocellular carcinoma). Similar screening studies in other countries have suggested that only about half of C282Y homozygous individuals display increased iron parameters, and much less will develop clinical disease. In conclusion, C282Y mutation screening detects individuals that may not develop haemochromatosis. Phenotypic expression is an important issue to consider in talks of population screening for hemochromatosis.
 Key words
Key words
Haemochromatosis, HFE gene mutation, screening, ferritin
EXPRESION FENOTIPICA DE LA MUTACION C282Y ASOCIADA CON EL DESARROLLO DE HEMOCROMATOSIS EN NORUEGA Y EN OTROS PAISES
(especial para SIIC © Derechos reservados)
Artículo completo
Introducción
La hemocromatosis hereditaria (HH) es el trastorno genético más común en la población caucásica. Los individuos afectados tienen absorción anormalmente alta de hierro en intestino delgado, lo cual se asocia con depósito progresivo de hierro y daño tisular en hígado, articulaciones, corazón y otros órganos.1,2 El gen involucrado, HFE, se localiza en el cromosoma 6, en posición telomérica a la región HLA. En el 83% de los pacientes con HH clínica se encontró una única mutación -sustitución de cisteína por tirosina en la posición 282 (C282Y)- en ambos cromosomas.3 Lebron y colaboradores4 han sugerido que el producto del gen HFE normal se une al receptor de transferrina y reduce la afinidad de la transferrina cargada con hierro. La mutación C282Y evita la asociación de la proteína HFE con el receptor de transferrina.5,6 En el gen HFE de la población normal, pero no en cromosomas portadores de la mutación C282Y, se encontró una segunda mutación: sustitución de histidina por aspartato en la posición 63 (H63D). El papel de la última mutación aún es incierto. Sin embargo, los heterocigotas compuestos -con la mutación C282Y y la H63D- parecen tener mayor riesgo de desarrollar sobrecarga de hierro en comparación con los heterocigotas para la mutación C282Y.7 La publicación original de Feder y colaboradores5 reveló que 147 de 178 pacientes con hemocromatosis confirmada por biopsia hepática eran homocigotas para la mutación C282Y, lo cual sugería que la sensibilidad de la mutación, como herramienta diagnóstica en la detección clínica de hemocromatosis, era del 83%. A medida que los profesionales de todo el mundo comenzaron a efectuar estudio genotípico en los pacientes con HH, se hizo evidente que la sensibilidad variaba desde el 60% en Italia8 al 100% en Australia.9 Sin embargo, el análisis de la mutación C282Y se realizaba fácilmente y prometía ser un elemento diagnóstico de utilidad en todo el mundo. Los estudios en familias de individuos afectados revelaron primariamente la variabilidad en la penetrancia de la mutación C282Y. En Australia, 22 de 127 (17.3%) homocigotas para la mutación C282Y, hermanos de individuos con HH, no expresaban o sólo expresaban parcialmente sobrecarga de hierro.10 Cuando se publicó el primer estudio de rastreo en personas sanas fue evidente que, aunque algunos homocigotas en la población general eran casos de HH no detectada, una cantidad igual o aún mayor tenía nivel normal o sólo ligeramente elevado de los parámetros férricos, sin signos clínicos.11,12Estudio noruego
En Noruega investigamos la prevalencia de la mutación C282Y en una población de pacientes internados. Estudios previos de rastreo con diseño semejante, basados en la saturación de transferrina, mostraron una prevalencia de hemocromatosis inferior en relación con la población general.13 Entre noviembre de 1998 y mayo de 1999 estudiamos 2 337 pacientes consecutivos internados por patologías agudas en la guardia del Aker University Hospital en Oslo.14 Todos recibieron una planilla con información y fueron invitados a participar en el estudio; en los que estaban gravemente enfermos se esperó hasta que la patología estuviera estabilizada. Los pacientes en coma, los reinternados al menos una vez durante los 6 meses del tiempo de inclusión y aquellos que rehusaron firmar el consentimiento informado fueron excluidos de la investigación. En total, la cohorte estuvo integrada por 2 027 pacientes. Se obtuvo el consentimiento informado en todos los casos. Entre los 2 027 individuos, 1 900 eran caucásicos de origen escandinavo y 127 (6.3%) eran no caucásicos, predominantemente de origen asiático o africano. Debido a que ningún paciente no caucásico expresó la mutación, los índices de hierro de este subgrupo fueron eliminados. La mediana de la edad de la población caucásica fue de 71 años (rango: 15 a 102); en las mujeres (54%) fue de 74 años y en el grupo de varones, levemente inferior: 68 años. En el momento de la internación se tomaron muestras de sangre para analizar el hierro sérico, la concentración de transferrina y ferritina y el nivel de proteína C reactiva (PCR). Se tomó una muestra de sangre con 5 ml de EDTA para estudio genético de la mutación C282Y en el gen HFE. Prevalencia de la mutación C282Y en Noruega
Catorce de las 1 900 personas de origen caucásico internadas (0.74%) eran homocigotas para la mutación C282Y (tabla 1). Hubo 224 heterocigotas (11.8%), entre los cuales 32 (1.7%) eran heterocigotas para las mutaciones C282Y y H63D (heterocigotas compuestos). La frecuencia del alelo C282Y en esta población fue del 6.6% (sin diferencias entre hombres y mujeres). La cifra está dentro del intervalo de confianza del 95% que previamente publicamos, 7.8% ± 1.6%, entre individuos sanos en la misma ciudad.15 Los resultados, en combinación con los de un estudio piloto de rastreo en recién nacidos,6 confirman que la prevalencia de la mutación C282Y en Escandinavia es mayor que la prevalencia promedio en Europa (3.8% ± 0.7%, intervalo de confianza de 95%).17 El origen de la mutación C282Y se atribuye a la población celta del norte de Europa. Sin embargo, la elevada prevalencia observada en Escandinavia cuestiona esta teoría, y es posible que la mutación original surgiera entre los vikingos, quienes, un milenio antes, eran hombres de mar y viajaban extensamente por toda Europa.15 La prevalencia de la mutación C282Y homocigota también fue más alta que la prevalencia de hemocromatosis detectada en la misma ciudad de Noruega (0.34%), cuando se rastreó la enfermedad a través de la determinación de ferritina en suero de 3 500 dadores de sangre.18 Esta discrepancia también sugirió que la mutación C282Y homocigota podía ocurrir sin expresión bioquímica o enfermedad clínica. Expresión fenotípica de la mutación C282Y en Noruega
Entre los 14 homocigotas detectados en nuestro estudio, había 9 mujeres y 5 hombres. La mediana de la edad era de 64 y 78 años, respectivamente. Sólo un varón y una mujer tenían aumento en el índice de saturación de la transferrina igual o por encima del 50% en el momento de la internación. La saturación mediana de la transferrina entre los pacientes homocigotas fue del 27% (3 a 51%) (figura 1a). La concentración sérica de ferritina fue igual o superior a los 200 µg/l en 9 pacientes, con un valor mediano de 370 µg/ml (29 a 2 203 µg/ml) (figura 1b).

Figura 1. (a) Valores de transferrina en suero y (b) ferritina sérica en 12 individuos homocigotas para la mutación C282Y en el momento de la internación (fase aguda) y durante el seguimiento, seis semanas más tarde. Dos enfermos fueron excluidos porque no se dispuso de estos valores durante el seguimiento. Las medianas de los valores se indican con una corta línea horizontal azul.
Doce pacientes homocigotas pudieron ser seguidos durante 6 semanas después de ser dados de alta. Las muestras de sangre mostraron que la mediana de la saturación de transferrina aumentó a un valor de 71% (33 a 90%) (figura 1a) y que la concentración de ferritina descendió a un valor de 219 µg/l (52 a 1 001 µg/l) (figura 1b). Se dosó el nivel de la PCR, un reactante de fase aguda, para determinar la influencia de la inflamación sobre los índices de hierro. La concentración mediana de la PCR entre homocigotas para la mutación C282Y fue de 20 mg/l (1 a 434 mg/l) en el momento de la internación y de 5 mg/l (0 a 18 mg/l) durante el seguimiento. La saturación de transferrina y los valores de ferritina en el momento de la internación fueron más altos en sujetos homocigotas en comparación con individuos sin la mutación (tabla 1).

El cálculo del valor predictivo positivo, sin embargo, reveló que niveles de ferritina de 200 µg/l o menos o de 1 000 µg/l o más en el momento de la internación no eran buenos indicadores de la presencia de la mutación. Entre los 60 individuos con ferritina sérica de 1 000 µg/l o más predominaron las enfermedades malignas, cardiovasculares e infecciosas, así como la enfermedad hepática alcohólica. Diecinueve (31%) fallecieron un mes después de terminado el estudio. Esto indica que la concentración de ferritina de 1 000 µg/l o más, como reactante de fase aguda, es predictiva de pronóstico desfavorable pero rara vez se asocia con hemocromatosis. Es bien sabido que la liberación de ferritina de los tejidos lesionados durante la inflamación aguda y en patologías malignas puede aumentar notablemente su concentración en suero. Por otra parte, el hierro en suero y la transferrina pueden descender en estados inflamatorios.19 De hecho, en 1955, Finch & Finch20 observaron falsos valores bajos de hierro en plasma en pacientes con hemocromatosis e infecciones concomitantes. Más aún, la baja prevalencia de hemocromatosis en una población de pacientes internados en Suecia se atribuyó a la desaturación de la transferrina, inducida por situaciones inflamatorias.21 En una carta al editor, Moodie & Maxwell22 comentaron que el estudio noruego pone de manifiesto algunas de las limitaciones de la saturación de la transferrina como parámetro de rastreo de hemocromatosis. Ellos agregaron que el rastreo o las pruebas para hemocromatosis deberían limitarse a los personas ambulatorias aparentemente sanas.Discusión
En el estudio noruego, la expresión fenotípica de 14 pacientes homocigotas fue variable. Sólo dos enfermos tuvieron cirrosis comprobada por biopsia hepática: un hombre que también presentaba hepatocarcinoma y una mujer con insuficiencia cardíaca congestiva. Es interesante señalar que durante el período de 6 meses, sólo 2 de estos 14 enfermos fueron internados por patologías directamente relacionadas con hemocromatosis, mientras que en los 12 restantes esto no ocurrió a pesar de que la mediana de la edad rondó los 73 años. En otros dos pacientes homocigotas se consideró que la mutación no se expresaba. Una mujer de 47 años con historia de diabetes, sin gestaciones y sin causa conocida de pérdida de sangre tuvo ferritina en suero de 52 µg/l e índice de saturación de transferrina del 38%. Un hombre de 78 años tuvo ferritina sérica de 118 µg/l e índice de saturación del 73%. Los restantes 9 individuos homocigotas presentaron aumento moderado en los depósitos corporales de hierro (ferritina sérica por debajo de los 550 µg/l). Tres de ellos, a quienes se les ofreció la posibilidad de ser sometidos a una biopsia de hígado, no tuvieron evidencia de fibrosis. Ninguno de estos enfermos tenía signos de enfermedad clínica relacionada con la hemocromatosis. Se evaluó la historia completa y se realizó un profundo examen para descartar causas no reconocidas de pérdida de sangre. Los resultados del estudio de Noruega14 son coincidentes con los de otras investigaciones (tabla 2).11,12,23-25
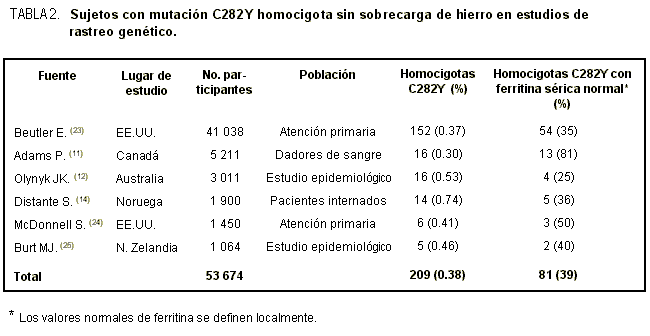
Se han estudiado diferentes grupos poblacionales (individuos sanos, dadores de sangre, pacientes de atención primaria y enfermos internados). A pesar de las diferencias geográficas, los resultados muestran que al menos un tercio de los homocigotas para la mutación C282Y tiene ferritina sérica dentro de valores normales y no desarrolla hemocromatosis. El estudio de rastreo más amplio se llevó a cabo en los Estados Unidos23 (tabla 2). Entre 152 homocigotas identificados, los síntomas de hemocromatosis no fueron más prevalentes que en los controles. Los autores estimaron que menos del 1% de los homocigotas desarrollará hemocromatosis franca.La falta de expresión clínica en individuos homocigotas es un tema recientemente revisado por P. Adams.26 La introducción del estudio genético ha creado un problema de definición. Así, ¿puede considerarse que un individuo con predisposición a hemocromatosis por la presencia homocigota de la mutación C282Y, pero sin sobrecarga de hierro, tiene la enfermedad El Consenso Internacional de Hemocromatosis de la Asociación Europea para el Estudio del Hígado (EASL)27 estableció la siguiente postura: "Puede considerarse que estos individuos -portadores de la mutación genética que puede ocasionar hemocromatosis- aún no tienen la enfermedad". Pero queda planteado un problema clínico: ¿Se debe realizar el seguimiento de estas personas sanas La sobrecarga de hierro es un factor que depende de la edad. No obstante, parece improbable que un varón homocigota sin expresión (por encima de los 40 años) desarrolle sobrecarga de hierro más tardíamente (lo que puede ocurrir en mujeres después de la menopausia). Las comparaciones de los niveles séricos de ferritina antes y después del estudio genético, en el trabajo australiano, no mostraron progresión de la sobrecarga de hierro a lo largo de 4 años en individuos homocigotas.12 Los síntomas relacionados con hemocromatosis no son esperables en homocigotas sin expresión, ya que se estima que la alteración funcional de los órganos es secundaria a la sobrecarga de hierro.26 Aún no se comprende por qué algunas personas con la mutación homocigota desarrollan la enfermedad y otras no. La ingesta de hierro en la dieta y la pérdida crónica de sangre no pueden explicar completamente la variabilidad en la expresión fenotípica de la mutación. La proteína HFE es una de las involucradas en la homeostasis del hierro, y es probable que mutaciones en otros genes modifiquen el nivel de acumulación del elemento. Estudios estructurales y bioquímicos recientes muestran que la unión de la proteína HFE al receptor de transferrina es crítica para los efectos de la proteína, pero las piezas finales del rompecabezas aún no están establecidas.28 El debate relacionado con el rastreo sigue su curso; la hemocromatosis cumple con los criterios para el rastreo poblacional ya que es una entidad frecuente, sobre la cual se puede actuar preventivamente y tratable. Algunos científicos sostienen que no es ético dejar de realizar el rastreo. Otros consideran que el rastreo puede detectar curiosidades bioquímicas más que gente con la enfermedad.28 En el estudio más amplio de rastreo efectuado a la fecha se midió la saturación de transferrina en más de 65 000 individuos. La mutación C282Y sólo se evaluó en individuos que repetidamente tuvieron saturación elevada de transferrina. Los autores no encontraron correlación entre la ferritina sérica, la edad y la presencia homocigota de la mutación. Las complicaciones fueron leves y sólo 4 individuos de los 65 000 registraron cirrosis hepática.29 La mayoría coincidiría en que el rastreo es aconsejable en áreas de riesgo alto, pero permanece sin definición si debe basarse en el fenotipo o el genotipo. A partir de nuestra experiencia, el rastreo con el análisis del ADN podría detectar individuos que pueden no desarrollar la enfermedad. Más aún, el estudio genético exclusivo de la mutación C282Y podría ser insuficiente para detectar hemocromatosis en pacientes con otras alteraciones genéticas. La saturación de la transferrina parece ser el método de elección para el rastreo30,31 siempre y cuando se pueda excluir la presencia de un estado inflamatorio. Conclusión
El rastreo de la mutación C282Y detecta individuos que no desarrollarán hemocromatosis y, por lo tanto, no parece recomendable como estudio de detección de primera línea. La saturación de transferrina y el dosaje de ferritina pueden no ser lo suficientemente confiables en presencia de inflamación. La expresión fenotípica variable que se observa en homocigotas para la mutación C282Y sugiere que ciertos factores genéticos o ambientales aún no identificados tendrían un papel importante en la patogenia de la hemocromatosis. Lista de abreviaturas:HH, hemocromatosis hereditaria. PCR, proteína C reactiva. IHH, índice hepático de hierro. CHH, concentración hepática de hierro.
 Bibliografía del artículo
Bibliografía del artículo
- Edwards CQ, Griffen LM, Goldgar D, et al. Prevalence of hemochromatosis among 11,065 presumably healthy blood donors. N Engl J Med 1988; 318: 1355-62.
- Niderau C, Fisher R, Purschel A, et al. Long-term survival in patients with hereditary hemochromatosis. Gastroenterology 1996; 110: 1107-19.
- Feder JN , Gnirke A, ThomasW, et al. A novel MCH class I-like gene is mutated in patients with hereditary haemochromatosis. Nature Genet 1996; 13: 399-408.
- Lebron J.I, Bennett MJ, Vaughn DA, et al. Crystal structure of the hemochromatosis protein HFE and characterisation of its interaction with transferrin receptor. Cell 1998; 93: 111-23.
- Feder JN, Tsuchihashi Z, Irrinki A, et al. The hemochromatosis founder mutation in HLA-H disrupts B2- microglobulin interaction and cell surface expression. J Biol Chem 1997; 272: 14025-8.
- Feder JN, Penny DM, Irrinki A, et al. The hemochromatosis gene product complexes with the transferrin receptor and lowers its affinity for ligand binding. Proc Natl Acad Sci U.S.A.1998; 95: 1472-7.
- Beutler E, Gelbart T, West C, et al. Mutation analysis in hereditary hemochromatosis. Blood Cells Mol Dis1996; 22: 187-94.
- Carella M, D'Ambrosiso L, Totaro A, Grifa A, Valentino MA, Piperno A, et al. Mutation analysis of the HLA-H gene in Italian hemochromatosis patients. Am J Hum Genet 1997;60:828-832.
- Jazwinska EC, Cullen LM, Busfield F, Pyper WR, Webb SI, Powell LW. Haemochromatosis and HLA-H. Nature Genet 1996; 14: 149-51.
- Crawford DHG, Jazwinska EC, Cullen LM, et al. Expression of HLA-linked hemochromatosis in subjects homozygous or heterozygous for the C282Y mutation. Gastroenterology 1998; 114: 1003-8.
- Adams PC, Kertesz AE, McLaren CE, Barr R, Bamford A, Chakrabarti S. Population screening for hemochromatosis: a comparison of unbound iron-binding capacity, transferrin saturation, and C282Y genotyping in 5,211 voluntary blood donors. Hepatology. 2000;31:1160-4.
- Olynyk JK, Cullen DJ, Aquilia S, Rossi E, Summerville L, Powell LW. A population-based study of the clinical expression of the hemochromatosis gene. N Engl J Med. 1999;341:718-24.
- Olsson KS. Prevalence of haemochromatosis in Scandinavia. In: 'Iron Nutrition in Health and Disease'. Hallberg L and Asp N-G eds. J. Libbey & Company Ltd. 1996: 273-7.
- Distante S, Berg JP, Lande K, Haug E, Bell H. HFE gene mutation (C282Y) and phenotypic expression among a hospitalised population in a high prevalence area of haemochromatosis. Gut. 2000 Oct;47:575-9.
- Distante S, Berg JP, Lande K, et al. High prevalence of the hemocromatosis associated Cys 282Tyr HFE gene mutation in a healthy Norwegian population in the city of Oslo, and its phenotypic expression. Scand J Gastroenterol 1999; 34: 529-34.
- Merryweather-Clarke AT, Simonsen H, Shearman JD et al. A retrospective anonymous pilot study in screening newborns for HFE mutations in Scandinavian population. Hum Mutat 1999; 13 (2): 154-9.
- Merryweather-Clarke AT, Pointon JJ, Shearman JD, et al. Global prevalence of putative haemochromatosis mutations. J Med Genet 1997; 34: 275-8.
- Bell H, Thordal C, Raknerud N, et al. Prevalence of hemochromatosis among first time and repeat blood donors in Norway. J Hepatol 1997; 26: 272-9.
- Konijn AM & Hershko C. Ferritin synthesis in inflammation. Brit J Haematol 1977; 37: 7-16.
- Finch ST & Finch CA. Idiopathic hemochromatosis, an iron storage disease. Medicine 1955; 34: 381-430.
- Olsson KS, Eriksson K, Ritter B, et al. Screening for iron overload using transferrin saturation. Acta Med Scand 1984; 215: 105-12.
- Moodie SJ, Maxwell JD. Phenotypic expression of the HFE gene mutation (C282Y) among the hospitalised population. Gut. 2001;49:156 (Comment)
- Beutler E, Felitti VJ, Koziol JA, Ho NJ, Gelbart T. Penetrance of 845G--> A (C282Y) HFE hereditary haemochromatosis mutation in the USA. Lancet. 2002 Jan 19;359(9302):211-8.
- McDonnell SM, Hover A, Gloe D, Ou CY, Cogswell ME, Grummer-Strawn L. Population-based screening for hemochromatosis using phenotypic and DNA testing among employees of health maintenance organizations in Springfield, Missouri. Am J Med. 1999 Jul;107(1):30-7.
- Burt MJ, George PM, Upton JD, et al The significance of haemochromatosis gene mutations in the general population: implications for screening. Gut 1998; 43: 830-6.
- Adams PC. Nonexpressing homozygotes for C282Y hemochromatosis: minority or majority of cases Mol Genet Metab. 2000;71:81-6
- Adams P, Brissot P, Powell LW. EASL International Consensus Conference on Haemochromatosis. J Hepatol. 2000 Sep;33(3):485-504. Review.
- Parkkila S, Niemela O, Britton RS, Fleming RE, Waheed A, Bacon BR, Sly WS. Molecular aspects of iron absorption and HFE expression. Gastroenterology 2001 Dec;121(6):1489-96.
- Adams PC. Population screening for hemochromatosis--are we finding people with a disease or a biochemical curiosity Semin Gastrointest Dis. 2002 Apr;13(2):89-94.
- Asberg A, Hveem K, Thorstensen K, Ellekjter E, Kannelonning K, Fjosne U, et al. Screening for hemochromatosis: high prevalence and low morbidity in an unselected population of 65,238 persons. Scand J Gastroenterol 2001 Oct;36(10):1108-15
- Phatak PD, GuzmanG, Woll J. et al. Cost effectiveness of screening for hereditary hemochromatosis. Arch Intern Med 1994; 154: 769-76.
- Adams PC, Gregor JC, Kertesz AE et al. Screening blood donors for hereditary hemochromatosis: decision analysis model based on a 30- years database. Gastroenterology 1995; 109: 177-88.
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC




 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a:

