




 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: Patrocinio y reconocimiento
Patrocinio y reconocimiento
Introducción
La linfadenitis necrotizante de Kikuchi Fujimoto (EKF) y la enfermedad de Hodgkin (EH) muestran ciertas similitudes en sus patrones histológicos que ocasionalmente pueden dificultar el diagnóstico diferencial entre ellas (1,2) (figuras1 y 2).
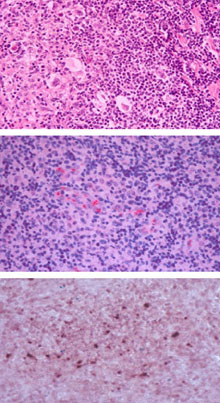
Figura 1. Enfermedad de Hodgkin. Arriba : corte histológico de biopsia de ganglio, tinción con hematoxilina- eosina (250x), tipo nodular esclerosante, mostrando células lacunares de Hodgkin y de Reed-Sternberg. Centro: inmunohistología para HHV-6 en EH (APAAP, 250x). Abajo: hibridación in situ para ADN de HHV-6 (NBT/BCIP, 250x)
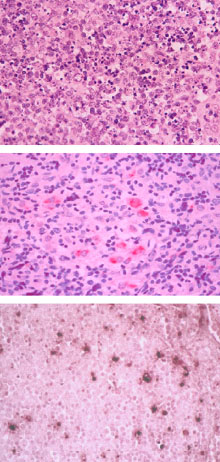
Figura 2. Enfermedad de Kikuchi Fujimoto. Arriba: corte histológico de linfadenítis de KF temprana,observándose grupos de linfocitos apoptósicos y una población difusa de histiocitos. Tinción con hemtoxilina-eosina (250x). Centro: inmunohistología para HHV-6 en EKF (APAAP, 250x). Abajo: hibridación in situ para ADN de HHV-6 en EKF (NBT/BCIP, 250x).
Sin embargo, el curso final de la EH es proliferativo, mientras que el de la EKF es apoptótico y de recuperación espontánea (3,4). Ambas enfermedades muestran una relación aparente de infección con los virus herpes linfotrópicos de Epstein Barr (VEB) y HHV-6; sin embargo, su evidencia patogenética todavía está por confirmarse (5,6). Los virus herpes linfotrópicos infectan e interfieren con el funcionamiento de las células del sitema inmunológico, por lo que es posible que tanto el VEB como el HHV-6 influyan en la EH y EKF (7). Esta suposición está apoyada por estudios preliminares de apoptosis y de proliferación celular relacionados con infección por virus herpes llevados a cabo in vitro e in vivo (8,9). El VEB se encuentra asociado a un número importante de neoplasias linfoides, tales como el linfoma de Burkitt endémico, enfermedades linfoproliferativas de pacientes inmunocomprometidos, linfomas T- periféricos, linfomas T-NK (de células linfoides asesinas) linfomas nasales y en linfoma de Hodgkin (10,11).
La presencia del VEB es variable, y depende no sólo del tipo histológico sino que también influyen otros factores epidemiológicos y tumor-específicos, pues en linfomas T-extraganglionares hay una marcada variación en la presencia del VEB en relación al sitio anatómico, como en los linfomas T-NK nasales, que son universalmente VEB positivos (12,13).La asociación entre el linfoma de Hodgkin y el VEB es muy frecuente en Latinoamérica, incluyendo México, y raro en países industrializados o de raza caucásica (14-17).
El virus herpes humano-6 (HHV-6) es un virus T-linfotrópico con ADN de doble hélice, con tropismo primario para linfocitos T CD4 positivo, y con menor afinidad para linfocitos T CD8 positivos. Este virus es endémico en la población humana en diferentes áreas geográficas. Se lo ha clasificado en dos subgrupos (A y B), sobre la base del patrón restrictivo especifico de endonucleasa, reactividad con antisuero especifico y tropismo celular. La variante B se ha identificado como la más común y se la ha relacionado con el exantema súbitum (18); algunos autores han sugerido que puede jugar un papel importante en el desarrollo de neoplasias linfoides asociadas o no con el síndrome de inmunodeficiencia adquirida, linfomas T tipo linfadenopatía angioinmunoblástica y enfermedades no neoplásicas tales como linfadenitis de Kikuchi (linfadenitis necrosante) y enfermedad de Rosai-Dorfman (hiperplasia sinusal con linfadenopatía masiva) (19).
En México, hay pocos estudios sobre la presencia de estos virus herpes humanos y el linfoma de Hodgkin, donde se ha encontrado una asociación con el VEB que va del 67% al 80% (14,15,20). En las tres series publicadas por diferentes Instituciones de la Ciudad de México (14,15,20) no se menciona la asociación con el HHV-6.
El objetivo de este trabajo es dar a conocer la presencia de estos virus herpes humanos en pacientes con la enfermedad de Hodgkin y la enfermedad de Kikuchi Fujimoto en relación con marcadores de proliferación celular y de apoptosis.
Material y métodos
Los estudios serológicos de inmunofluorescencia indirecta (IFA) para VEB y HHV-6 de acuerdo con métodos previamente descritos (21,22) se realizaron solamente en los pacientes de la Universidad de Colonia, Alemania. De igual manera, las reacciones de PCR para ADN viral se realizaron previamente solo en los casos de Colonia (23).
De los archivos de la Unidad de Patología del Hospital General de México, OD, y de la Facultad de Medicina de la UNAM, se seleccionaron 84 biopsias con diagnóstico de linfoma de Hodgkin, en cualquiera de sus variedades histológicas. Se seleccionaron de igual manera los 26 casos de Alemania, para un total de 110 casos con EH. En cuanto a los 14 casos con EKF, 11 fueron proporcionados por el Prof. M. Kikuchi (Depto. de Patología, Universidad de Fukuoka, Japón) y 3 se obtuvieron del Laboratorio de Inmunopatología de la Clínica de la Universidad de Colonia, Alemania. El tejido fue fijado en formaldehído al 10% e incluido en parafina, los cortes histológicos se tiñeron con hematoxilina-eosina y se clasificaron histológicamente según la nueva versión de la Organización Mundial de la Salud (OMS) publicada en 2001. Se efectuaron además estudios de inmunohistoquímica y de biología molecular en el Instituto de Inmunopatología de la Universidad de Colonia, Alemania. En dicho laboratorio se realizó la técnica de inmunoperoxidasa APAAP (fosfatasa alcalina-antifosfatasa alcalina) y la técnica ABC (avidina-biotina-peroxidasa) para determinar la expresión antigénica de los siguientes anticuerpos monoclonales: CD30 (Ki-1 1:20 DAKO), VEB-LMP1(1:30 DAKO), Ki 67 (MIB1 1:50 DIANOVA), p53(1:30 DAKO), p21 (WAF1 1:20 NOVOCASTRA), oncoproteína Bcl2 (DAKO 1:10), HHV-6 gp 110/60(HAR-2 1:200) (antisueros proporcionados por el Dr.Luka Depto.de Patología, Fac de Medicina, Norfolk Virginia); se efectuó además hibridación in situ (ADN-sonda) (ADN-blanco) (Dianova) y para VEB-ADN (ENZO). Para la determinación de ADN-HHV-6 la pZVH14 fue proporcionada por el Dr. Salahuddin . Además se realizaron tinciones dobles en los casos alemanes para la demostración simultánea de proliferación (PCNA) y de antígenos virales combinando las técnicas de PAP y APAAP . La apoptosis se demostró además utilizando tanto la reacción "in situ end labeling" (ISEL) así como la "TDT mediada por dUTP nick end labeling" (TUNEL). Los datos que se incluyeron para el estudio fueron sólo edad y sexo de cada uno de los pacientes.
Resultados
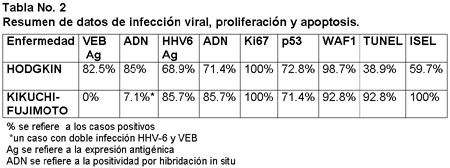
De los 84 casos de México, 67 (79.7%) fueron pacientes del sexo masculino y 19 (22.6%) del sexo femenino. La edad varió de los 8 a los 90 años, con un promedio de 24 años. El subtipo histológico más frecuente fue el de celularidad mixta con 44 casos (46%) de los cuales 31, (70.4%) estuvieron asociados al virus de Epstein-Barr y 7 (15.9%) al HHV6 . Del grupo total de casos 64.2% tuvieron asociación con el VEB y 16.6% con el HHV-6 (tabla 1).
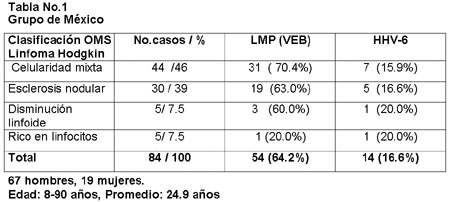
Treinta casos correspondieron al subtipo de esclerosis nodular representando el 39%, en 19 de éstos estuvo presente el VEB (63%) y la asociación con el HHV-6 fue en 5 (16.6%). Entre los subtipos menos frecuentes se encontraron 5 casos, dos de ellos ricos en linfocitos uno de los cuales (20%) estuvo asociado a VEB (20%) y otro a HHV-6 (20%), de 5 casos del subtipo disminución linfoide 3 se asociaron a VEB, 1 a HHV6 y el restante no tuvo asociación viral. El VEB estuvo presente en el núcleo de las células de Hodgkin y en las células de Reed-Sternberg (figura 3), ocasionalmente se le observó en linfocitos e histiocitos.
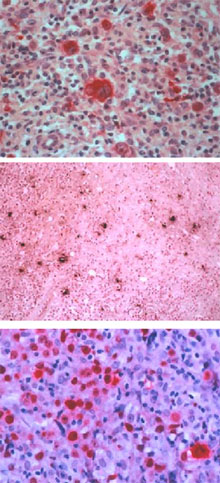
Figura 3. Enfermedad de Hodgkin. Arriba: inmunohistología para determinación del VEB con LMP1 en EH ( APAAP, 250x). Centro: reacción de TUNEL para células apoptósicas en EH (125x). Abajo: inmunohistología con el marcador Ki67 para proliferación celular en EH. Nótese la fuerte positividad en las células gigantes atípicas (APAAP, 250x).
El HHV-6 se encontró principalmente en linfocitos e histiocitos y rara vez en células de Reed-Sternberg (figura 1). En sólo 10 casos (11.9%), ambos virus fueron identificados, 6 de ellos correspondieron al subtipo celularidad mixta y 4 al subtipo esclerosis nodular. El marcador de proliferación celular Ki 67 se encontró raramente en linfocitos e histiocitos y muy frecuentemente en células de Hodgkin y de Reed-Sternberg en 78 casos, (92.8%) (figura 3).
El marcador de apoptosis (Bcl-2) y la proteína p53 se encontraron en 71 casos (84.5%), ocasionalmente en células de Hodgkin y de Reed-Sternberg, y muy frecuentemente en linfocitos e histiocitos.En el grupo de los 26 casos alemanes, las edades variaron de 7 a 96 años con una media de 35.9 años, correspondiendo 3 (3.2%) a LH clásico celularidad mixta, 17 (18.7%) a esclerosis nodular, 1 (1.1%) a disminución linfoide y 5 (5.5%) al tipo rico en linfocitos. La infección viral serológica mediante IFA en los casos alemanes, demostró títulos de anticuerpos anti VEB indicativos de infección previa en todos los casos.
La IFA para HHV-6 fue positiva para IgG (rango 1:40-1:1280) en 24 de 26 casos (92.3%), encontrándose en 20 (77%) títulos mayores a 1:640 (IgM negativos); 24 casos (92.3%) fueron positivos a las reacciones de PCR para ADN de HHV-6. Los resultados de la infección viral, proliferación celular y de apoptosis, considerando al grupo global, se resumen en la tabla 2 y se complementan con las figuras 1 y 3.
El grupo de casos de EKF consistió en 6 hombres y 8 mujeres con edades que variaron de 16 a 46 años. Los títulos de anticuerpos anti-VEB demostraron infección previa en los 3 casos de la Universidad de Colonia mediante la prueba de IFA. Los títulos de IgG de HHV-6 variaron en estos casos de 1:160 a 1:1280. Los tres casos fueron positivos a la reacción de PCR para ADN de HHV-6. De los 14 casos de EKF, solamente en uno se encontraron histiocitos con LMP1-VEB y 12 (85.7%) presentaron expresión antigénica de HHV-6 gp110/60. La hibridación in situ para VEB fue positiva en un caso y para HHV-6 en 12 de los 14 ( 85.7%) (figura 2). El caso que presentó ADN de VEB fue también positivo para HHV-6. El ADN se encontró en células linfoides y con menor frecuencia en histiocitos. Todas las biopsias fueron positivas a Ki67 con expresión antigénica en linfocitos pero con predominio en histiocitos. El marcador de apoptosis WAF1 se expresó en 13 casos (93%). Algunos histiocitos y linfocitos reaccionaron positivamente con la prueba de ISEL en los 14 casos y con TUNEL en 13. En los casos de EKF se encontró el doble de células apoptósicas que en los casos de EH (figura 4).
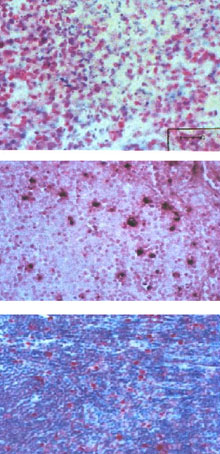
Figura 4. Enfermedad de Kikuchi Fujimoto. Arriba: inmunohistología para determinación de VEB con LMP1 en EKF. Se muestra el caso que presentó doble infección, LMP1 positivo e infección por HHV-6 (APAAP, 250x). Centro: reacción de TUNEL para células apoptósicas en EKF (125x). Abajo: inmunohistología con el marcador Ki67 para proliferación celular en EKF. Nótese la fuerte reacción en los centros germinales con aisladas células positivas en el tejido linfoide difuso.
Discusión
Estudios epidemiológicos en diferentes partes del mundo han demostrado diferencias en los subtipos histológicos del linfoma de Hodgkin. En países en vías de desarrollo los subtipos celularidad mixta y disminución linfoide son más comunes que el subtipo esclerosis nodular, cuya variedad es más frecuente en países desarrollados (16,17,24).En este estudio, con un total de 84 casos mexicanos, los subtipos más frecuentes son el LH clásico celularidad mixta 46% y esclerosis nodular 39%, con predominio en hombres y una edad media de 24 años. Zarate-Osorno y col. estudiaron 27 pacientes con LH, encontrando que el sexo femenino fue discretamente más afectado con edad promedio de 29 años y el subtipo histológico más frecuente fue el de esclerosis nodular 48.1% y el 25.9% correspondió al de celularidad mixta (15).
Quintanilla y col., del Instituto Nacional de la Nutrición, estudiaron un total de 50 pacientes con LH, encontraron una edad bimodal con la primera incidencia a los treinta años y el segundo pico en la 6ª década de la vida, con predominio del sexo masculino. Los subtipos histológicos correspondieron celularidad mixta 44%, esclerosis nodular 40% y el de disminución linfoide 14%, hallazgo que llama la atención con respecto a la proporción de este último subtipo de LH, con respecto a los trabajos anteriores, lo cual probablemente tenga que ver con el nivel socioeconómico de los pacientes que acuden a las diferentes instituciones de la Ciudad de México (14).Existen publicaciones en diferentes poblaciones geográficas y socioeconómicas mundiales (14-17,25) con variaciones en la prevalencia del VEB asociado con LH.
En este estudio, como en los trabajos efectuados en otras instituciones de México, se observa alta prevalencia del VEB (64.2%) en la población que acude al Hospital General de México. La asociación con el HHV-6 en los casos de México fue relativamente importante pues se presentó en el 16.6% del total de los casos estudiados; ambos virus estuvieron presentes en 10 pacientes (11.9%). Los subtipos histológicos más afectados fueron: celularidad mixta y esclerosis nodular. En la actualidad no se habían realizado estudios en México sobre la presencia de ambos virus en linfoma de Hodgkin. En los casos en donde se detectó la presencia por inmunohistoquímica de la LMP (proteína de membrana latente ) del VEB; ésta estuvo presente en el núcleo de las células de Hodgkin y de Reed-Sternberg y rara vez en linfocitos e histiocitos (figura 3). En el estudio del Instituto Nacional de Cancerología, (15) mediante hibridación in situ, se demostró alta prevalencia de las secuencias del VEB en los ganglios afectados (70%). Las secuencias fueron localizadas en el núcleo de las células de Reed-Sternberg y en las células de Hodgkin.
Quintanilla Martínez y col. encontraron un porcentaje similar o igual al trabajo citado previamente, en donde 35 de 50 pacientes (70%) fueron LMP1 positivos detectados por inmunohistoquímica (14).La literatura refiere que los subtipos histológicos que más evidencia de infección por VEB presentan son el de celularidad mixta y el de disminución linfoide en una proporción de 81% y 86% respectivamente, resultados que difieren de este estudio y del realizado en el Instituto Nacional de Cancerología, pues el subtipo disminución linfoide en estas dos últimas instituciones no fue tan frecuente a pesar de que se efectuaron inmunoreacciones correspondientes para confirmar el diagnóstico de linfoma de Hodgkin y se descartó la posibilidad de linfoma anaplásico (15). Hay pocos estudios en la literatura que comparan el pronóstico entre casos de LH/VEB positivos y negativos (26,27). Al parecer no hay diferencia significativa, sin embargo algunos investigadores como Flavell y col. postulan que la positividad del VEB puede ser benéfica en relación a la sobrevida libre de recaídas, particularmente en pacientes masculinos y en adultos jóvenes (25). Esto sería aplicable a los casos de Alemania, ya que en los casos de México, debido a las características socioeconómicas y culturales, la mayor parte de los pacientes con cualquier tipo de linfoma acuden por primera vez a diagnóstico y tratamiento en estadios clínicos avanzados, por lo que la ausencia o presencia del VEB o del HHV-6 tampoco tendría significado estadístico relevante (28). El papel del VEB en la patogénesis de linfoma de Hodgkin aún no ha sido aclarado (5), aunque algunos autores aseveran su participación como virus humano tumoral (29,30).
Un alto porcentaje de pacientes con linfoma de Hodgkin presenta elevados títulos de anticuerpos anti-VEB antes y durante el desarrollo de la enfermedad. Incluso los pacientes con mononucleosis infecciosa tienen altas probabilidades de desarrollar LH, probablemente como cofactor, particularmente en ciertos subtipos histológicos como LH clásico celularidad mixta y clásico esclerosis nodular. En México no existen datos sobre el porcentaje de individuos serológicamente positivos para el VEB y/o mononucleosis infecciosa y LH. Dos de los estudios efectuados en México mencionan que los pacientes provienen de un medio socioeconómico bajo y esto probablemente correlaciona con la alta probabilidad de exposición al VEB en edad temprana. Este mecanismo en cierta manera es similar al postulado para los pacientes con VIH y LH (28,31).
El HHV-6 se ha considerado un virus oncogénico, debido a que se han encontrado fragmentos genómicos virales en líneas celulares transformadas de modelos humanos y animales in vitro (19). La primera oncoproteína especifica del HHV-6, denominada ORF-1 ha sido recientemente identificada. Asimismo se ha aislado de la sangre periférica de pacientes con linfomas. Estudios serológicos y moleculares han sugerido una asociación entre infección por HHV-6 y enfermedades linfoproliferativas. Dicho virus se ha encontrado en células de pacientes con LH (20).En el material estudiado de México, se encontró el HHV-6 en el 16.6% de los casos principalmente en linfocitos e histiocitos y muy rara vez en células de Reed-Sternberg (figura 1). En otros estudios efectuados, sobre la importancia de este virus en diferentes tipos de patología linfoide (32) como linfadenopatía reactiva, linfadenopatía angioinmunoblastica y enfermedad de Rosai-Dorfman, el HHV-6 se presenta ubicado en células plasmáticas, histiocitos, granulocitos y células dendrítico-foliculares.
Con respecto a la asociación del LH y el HHV-6 se ha observado que existe una mayor frecuencia con títulos elevados de anticuerpos contra HHV-6 en pacientes con LH que en pacientes con linfoma no Hodgkin (LNH) o que en donadores sanguíneos. Existe además una correlación entre los títulos de anticuerpos anti HHV-6 y el curso clínico y pronóstico de la enfermedad en los pacientes con LH. Finalmente se ha observado elevada frecuencia de secuencias de HHV-6 detectada por PCR y por análisis de Southern blot en LH con respecto a los casos de LNH (19,33).Por otra parte, la infección por HHV-6 es latente y la célula infectada por el virus es el subtipo de la célula de RS, llamada momificada. Un hecho relevante es que el HHV-6 induce apoptosis en la célula infectada (células T in vitro). Si el efecto apoptótico del HHV-6 sobre las células de RS es confirmado el virus tendría un efecto protector de apoptosis (34) en el papel patogénico de dicha enfermedad. Lo que probablemente indica que el virus no se encuentra directamente involucrado en la patogénesis del LH. El marcador de proliferación celular Ki67 se encontró pronunciadamente en ambas enfermedades (figuras 3 y 4). Histiocitos y linfocitos proliferaban activamente en ambas enfermedades (35) observándose principalmente en células de Hodgkin y de RS y raramente en linfocitos e histiocitos en la mayoría de los casos de EH (>90%). El fenómeno de apoptosis así como la expresión de p53 se observó en más del 70% de los casos de EH, en linfocitos e histiocitos y ocasionalmente en células de Hodgkin y de RS, sin embargo las técnicas de TUNEL e ISEL revelaron franco predominio de apoptosis en los casos de EKF (93%-100%) al contrario de lo que sucede en EH con positividad del 39% al 60% (figuras 3 y 4). Esta observación era esperada, ya que la EFK es una enfermedad apoptósica de inducción viral por excelencia (36-38). Las diferencias entre los rangos de positividad de TUNEL e ISEL se atribuyen a la menor especificidad de ISEL que mide también células necróticas (39).
El grado de infección por HHV-6 en EKF fue del 85.7% que coincide con datos de la literatura (6). En los casos de EKF en cambio, el VEB se encontró presente solamente en uno (7.1%) de 14 casos, y éste mostraba doble infección con HHV-6, lo cual pudo apoyar la inclusión del VEB en las células (40,41).De esta investigación se podría concluir, que a pesar de que los virus de Epstein –Barr y HHV-6 están presentes en las enfermedades de Hodgkin y de Kikuchi Fujimoto, no son abiertamente oncogénicos; sin embargo, parecen influir en el curso de la enfermedad a través de su efecto en las células linforreticulares. El VEB estimula el efecto de proliferación intensificando la producción de varias citocinas, incluyendo IL-1, IL-2, IL-4 e IL-6 (42). El HHV-6 tiene un efecto similar, excepto por la IL-2 y la IL-6, que se encuentran en general reducidas (34,42,43), por lo que un cierto efecto protector de apoptosis está disminuido a través de IL-6 en infecciones por el HHV-6 (34). Las células de Hodgkin y de RS compensan aparentemente la disminución de IL-6 , aumentando la expresión de moléculas receptoras de IL-6 (44,45), reteniendo así su capacidad de proliferación. La infección por VEB de estas células bloquea en forma aparente la apoptosis mediada por p53 através de LMP1 (46).
En la doble infección viral en el caso de LH, el HHV-6 parece apoyar la infectividad del VEB y así el efecto proliferativo predominante de éste, probablemente mediado por citocinas (19,33,40,41).La LMP del VEB es regulada por el HHV-6 (47) y puede asi suprimir la apoptosis inducida por el virus en la EH, que es tan prominente en la EKF sin infección por VEB. Parece, por lo tanto, que la infección de tejido linfático por el HHV-6 favorece el curso apoptótico de la enfermedad después de una proliferación celular inicial, como es el caso de la linfadenitis de KF (48). Dominguez DC y col. hicieron una revisión reciente de 471 casos de EKF de los cuales 32 fueron revisados serológicamente, encontrándose títulos elevados de anticuerpos anti-HHV-6 en el 100% de los casos; 142 casos con linfadenopatías, incluyendo la linfadentis histiocítica necrotizante fueron positivos a HHV-6 mediante PCR y la hibridación in situ fue positiva en 41 casos.Su estudio concluye con la necesidad de realizar en casos de EKF pruebas serológicas y moleculares de mayor consistencia para establecer la posible etiología del HHV-6 en EKF (49). Por otra parte, la infección por VEB, especialmente combinada con la del HHV-6, provoca proliferación sostenida que finalmente puede convertirse en maligna como se observa en la EH. El concepto de "guerra civil linfocitaria" de De Vita, se aclara un poco al considerar este tipo de infecciones virales linfotrópicas y sus efectos (50).