EXPRESION DE P73 EN RELACION CON FACTORES CLINICOS, PATOLOGICOS Y BIOLOGICOS EN TUMORES COLORRECTALES
(especial para SIIC © Derechos reservados)
Recepción del artículo: 4 de febrero, 2004
Aprobación: 0 de , 0000
 Conclusión breve
La expresión de la proteína p73 aumenta durante la evolución de la mucosa colorrectal normal a cáncer.
Conclusión breve
La expresión de la proteína p73 aumenta durante la evolución de la mucosa colorrectal normal a cáncer.
 Resumen
Antecedentes: La p73 puede inhibir el crecimiento celular e inducir apoptosis, lo cual indica que es un supresor de tumores, del tipo de p53. Sin embargo, los estudios demostraron que la pérdida de la heterocigotia (loss of heterozygosity, LOH) o la mutación de p73 no es un evento genético común en el desarrollo tumoral. Material, métodos y resultados: Para confirmar la especificidad del anticuerpo p73 se utilizó inmunotransferencia. Mediante inmunohistoquímica se evaluó la expresión de p73 en 58 muestras de mucosa colorrectal normal, en 221 muestras de cánceres primarios y en 58 muestras de ganglios linfáticos metastásicos. Se usó reacción en cadena de polimerasa y estudio de longitud de fragmentos de restricción para determinar LOH en 52 tumores primarios. Los resultados mostraron que la frecuencia y la intensidad de fijación de p73 aumentaron significativamente desde la evolución de tejido normal a tumores primarios y a metástasis (p 0.05). La expresión exagerada de p73 predijo un pronóstico más desfavorable (p = 0.03) aun después del ajuste por sexo, edad, estadio tumoral, patrón de crecimiento y diferenciación (p = 0.01). No hubo LOH en tumores primarios. Conclusión: La expresión de la proteína p73 estuvo aumentada durante el pasaje de mucosa normal a tumores primarios y a metástasis. Más aun, la mayor expresión de p73 fue un factor predictivo de pronóstico desfavorable en pacientes con cáncer colorrectal. Sin embargo, la LOH del gen no fue un factor importante en la aparición de cáncer colorrectal.
Resumen
Antecedentes: La p73 puede inhibir el crecimiento celular e inducir apoptosis, lo cual indica que es un supresor de tumores, del tipo de p53. Sin embargo, los estudios demostraron que la pérdida de la heterocigotia (loss of heterozygosity, LOH) o la mutación de p73 no es un evento genético común en el desarrollo tumoral. Material, métodos y resultados: Para confirmar la especificidad del anticuerpo p73 se utilizó inmunotransferencia. Mediante inmunohistoquímica se evaluó la expresión de p73 en 58 muestras de mucosa colorrectal normal, en 221 muestras de cánceres primarios y en 58 muestras de ganglios linfáticos metastásicos. Se usó reacción en cadena de polimerasa y estudio de longitud de fragmentos de restricción para determinar LOH en 52 tumores primarios. Los resultados mostraron que la frecuencia y la intensidad de fijación de p73 aumentaron significativamente desde la evolución de tejido normal a tumores primarios y a metástasis (p 0.05). La expresión exagerada de p73 predijo un pronóstico más desfavorable (p = 0.03) aun después del ajuste por sexo, edad, estadio tumoral, patrón de crecimiento y diferenciación (p = 0.01). No hubo LOH en tumores primarios. Conclusión: La expresión de la proteína p73 estuvo aumentada durante el pasaje de mucosa normal a tumores primarios y a metástasis. Más aun, la mayor expresión de p73 fue un factor predictivo de pronóstico desfavorable en pacientes con cáncer colorrectal. Sin embargo, la LOH del gen no fue un factor importante en la aparición de cáncer colorrectal.
 Palabras clave
Proteína p73, LOH, clinicopatológico, biología
Clasificación en siicsalud
Palabras clave
Proteína p73, LOH, clinicopatológico, biología
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/66653
Especialidades
 Principal: Oncología,
Principal: Oncología,
 Relacionadas: Bioquímica, Gastroenterología, Medicina Interna,
Relacionadas: Bioquímica, Gastroenterología, Medicina Interna,
 Enviar correspondencia a:
Enviar correspondencia a:
Xiao-Feng Sun, Associate Prof. MD, PhD, Department of Oncology, Institute of Biomedicine and Surgery, Linköping University, S-581 85 Linköping, Sweden
P73 EXPRESSION IN RELATION TO CLINICOPATHOLOGICAL AND BIOLOGICAL FACTORS IN COLORECTAL CANCERS
 Abstract
Abstract
Background: The p73 can inhibit cell growth and induce apoptosis, indicating that p73 is a p53-like tumour suppressor. However, studies have shown that either loss of heterozygosity (LOH) or mutation of p73 is not a common genetic event in tumour development. Material, methods and results: Western blotting was used for confirming the specificity of the p73 antibody. p73 expression was evaluated by using immunohistochemistry in 58 normal colorectal mucosa samples, 221 primary cancers and 58 lymph node metastases. PCR-restriction fragment length polymorphism was used for determining LOH in 52 primary tumours. The results showed that the frequency and the intensity of p73 immunostaining were markedly increased from normal tissue to primary tumour and to metastasis (p < 0.05). p73 overexpression predicted a worse prognosis outcome (p = 0.03), even after adjustment for patient\'s sex, age, tumour stage, growth pattern, and differentiation (p = 0.01). There was no LOH in primary tumours. Conclusion: The expression of p73 protein was up-regulated during the development from the normal mucosa to primary and to metastatic tumours. Furthermore, the overexpression of p73 was a predictor of poor prognosis in colorectal cancer patients. However, LOH of the gene was not an important factor in colorectal cancer development.
EXPRESION DE P73 EN RELACION CON FACTORES CLINICOS, PATOLOGICOS Y BIOLOGICOS EN TUMORES COLORRECTALES
(especial para SIIC © Derechos reservados)
Artículo completo
Introducción
El gen p73 codifica una proteína que contiene dos polipéptidos distintos: α y β.1 La proteína comparte más de un 60% de los aminoácidos con la región de unión al ADN de la p53, incluso todos los puntos vulnerables para mutaciones de p53 en tumores. La p73 también tiene 38% de identidad con el dominio de tetramerización de p53 y 29% de identidad con el dominio de transactivación.2 La p73 puede inhibir el crecimiento celular e inducir apoptosis, lo cual indica que es un supresor de tumores del tipo de p53. Sin embargo, los estudios mostraron que la pérdida de heterocigotia (loss of heterozygosity, LOH) y la mutación de p73 no son eventos genéticos comunes en el desarrollo tumoral.3 Por el contrario, se encontró mayor expresión de p73 en varios tumores en comparación con el correspondiente tejido normal.4-8 La activación de un alelo silencioso o la expresión exagerada de p73 pueden contribuir con el desarrollo neoplásico. Aún no se sabe si la p73 es un gen supresor de tumores; su significado clinicopatológico no ha sido bien estudiado en pacientes con cáncer colorrectal.
En este estudio, evaluamos la expresión de p73 en tumor colorrectal primario, mucosa normal correspondiente y metástasis ganglionares con la finalidad de determinar si la p73 está involucrada en el desarrollo tumoral y si se asocia con los hallazgos clinicopatológicos y biológicos.
Pacientes y métodos
Pacientes
En total se estudiaron en el Departamento de Patología de la Universidad de Linköping, Suecia, 256 enfermos con adenocarcinoma colorrectal diagnosticado entre 1972 y 1996. Los pacientes fueron seguidos hasta el final de 2003; 103 enfermos fallecieron como consecuencia del tumor. A partir de los registros quirúrgicos y anatomopatológicos se conoció el sexo, la edad, la localización de la neoplasia y el estadio Dukes de cada enfermo. La media de edad fue 70 años (intervalo, 34 a 93). Los tumores localizados a la derecha incluyeron neoplasias en colon ascendente y transverso; los de la izquierda fueron aquellos ubicados en colon descendente, colon sigmoide y recto. El patrón de crecimiento, la diferenciación, la infiltración inflamatoria y la necrosis fueron evaluados por dos investigadores. Mediante inmunohistoquímica se conoció la expresión de ras,9 p53,10 DCC11 y Bax,12 así como la mutación de MBD413 y RIZ14 por estudio de secuencia de ADN, previamente realizado en nuestro laboratorio.
Métodos
Inmunotransferencia: El anticuerpo p73 usado es un anticuerpo policlonal de cabra (Santa Cruz Biotechnology, Santa Cruz, CA, EE.UU.) contra un péptido de la región terminal COOH de la p73β de origen humano; sin embargo, reacciona contra la p73α y la p73β de origen humano. Las proteínas de las líneas celulares de melanoma se separaron mediante electroforesis y luego se transfirieron a la membrana, que cual fue lavada en solución salina de fosfato con Tween (PBS-Tween) y luego incubada y bloqueada con leche. La membrana se incubó con el primer anticuerpo y, luego del lavado, se incubó con el segundo anticuerpo (DAKO, Carpilenta, CA, EE.UU.). Finalmente, después del lavado, se agregó un reactivo ECL Plus con desarrollo de la membrana por exposición de la película, mostrando sólo una banda de 73 kDa (figura 1).

Figura 1. Expresión de p73 en línea celular de melanoma, por inmunotransferencia. La proteína p73 puede verse a los 73 kD.
Inmunohistoquímica: Las secciones de bloques tisulares embebidos en parafina se desparafinaron con xileno y se rehidrataron. La actividad de la peroxidasa endógena se bloqueó con H2O2 al 0.5% en metanol. Con la finalidad de exponer los epitopes enmascarados, las secciones se incubaron con solución citrato (pH 6.0) a 80ºC durante 10 minutos y luego se dejaron a temperatura ambiente. Luego de un lavado con PBS-Tween-20, los cortes se trataron con polvo bloqueante (BioGenex, San Ramon, CA, EE.UU.) durante 10 minutos para suprimir la fijación basal inespecífica. Luego del lavado, el primer anticuerpo diluido 1:150 en el diluyente (Dako Co, Glostrup, Dinamarca) se aplicó a 4ºC durante toda la noche. Posteriormente, las secciones se incubaron con anti-IgG de cabra producida en asno y marcada con biotina durante 30 minutos, seguido de ABC de cabra (Santa Cruz Biotechnology) por otros 30 minutos. La reacción de peroxidasa se efectuó con el agregado de solución de tetrahidrocloruro de 3,3-diaminobencidina al 0.05% (Sigma Chemical Co, St. Louis, MO, EE.UU.) y H2O2 al 0.02% en PBS durante 8 minutos. Luego las secciones fueron teñidas con una segunda tinción de contraste. La mucosa normal análoga, los tumores primarios y las metástasis ganglionares se tiñeron en la misma corrida de inmunofijación para evitar sesgo sobre el patrón e intensidad del teñido. En cada corrida con el primer anticuerpo o con PBS se incluyeron secciones que reaccionan con fuerza con el antip73, como controles positivos o negativos. En todos los procedimientos de fijación, los controles positivos mostraron una fijación manifiesta mientras que hubo ausencia completa de fijación en los controles negativos.
Las muestras fueron analizadas en forma independiente por dos patólogos que desconocían datos clínicos e histológicos. Con la finalidad de evitar artefactos no se contaron las células en los márgenes de las secciones y las regiones con morfología pobre. Se consideró expresión negativa en el caso de ausencia de células tumorales positivas y equívoca cuando hubo menos de 10% de células tumorales positivas. Los casos positivos –con áreas de inmunorreactividad de más del 10%– se clasificaron como débiles, moderados y fuertes en virtud de la intensidad de fijación.
Pérdida de heterocigotia: Se extrajo el ADN del tejido tumoral; el ADN de muestras correspondientes de mucosa normal fue heterocigota. Los productos de la reacción en cadena de polimerasa (PCR) se fragmentaron con Sty I (Fermentas, Vilna, Lituania), se controlaron en gel de agarosa al 3% y se compararon con el genotipo de mucosa normal.
Análisis estadístico: Se usó la prueba de χ2 y el método de McNemar para determinar la significación de la diferencia en frecuencia de p73 entre muestras normales, tumor primario y metástasis, así como la asociación entre la expresión de p73 con otros factores clinicopatológicos. Se empleó el modelo de riesgo proporcional de Cox para estimar la relación entre la expresión de p73 y la supervivencia. Las curvas de descripción de supervivencia se computarizaron según el método Kaplan-Meier. Las pruebas fueron de dos colas y se consideró estadísticamente significativo un valor de p 5%.
Resultados y discusión
Analizamos la LOH en 52 tumores primarios y ninguno de ellos mostró LOH. Recientemente, Bengard y col. revisaron varios tipos de tumores, como cáncer colorrectal, gástrico, esofágico, hepatocelular, de mama, de cabeza y cuello, ovárico, renal, del sistema nervioso central, neoplasias hematológicas, melanoma y neuroblastoma y mostraron que la pérdida alélica (0.6% de 1 426 casos) y las mutaciones (20% de 1 049 casos) del gen p73 no son eventos genéticos principales en la carcinogénesis y el desarrollo tumoral. Todo indica que la p73 no funciona como gen supresor de tumores en la carcinogénesis.
En función de las similitudes clinicopatológicas, en el estudio actual, los casos con tinción negativa o equívoca se consideraron negativos, mientras que los casos con fijación débil, moderada o fuerte se agruparon como positivos. La frecuencia de expresión de p73 aumentó desde mucosa normal (19%) a tumores primarios (67%) y a metástasis (95%, Figura 2). Aun en muestras pareadas, la frecuencia e intensidad de expresión de p73 estuvieron aumentadas desde tejido normal a tumor primario y metástasis (p 0.05, figura 3). Estudios previos mostraron que la transcripción de ARN mensajero de p73 está aumentada en tumores en comparación con el tejido adyacente normal, inclusove en cánceres colorrectales,4 mama,5 vejiga,6 pulmón7 y próstata.8 En conjunto, estos resultados indican que la p73 puede estar involucrada en la aparición y agresividad de los cánceres colorrectales. Sin embargo, la activación de alelos silenciosos o la expresión excesiva de p73, podría contribuir más en la carcinogénesis que con la supresión del tumor.
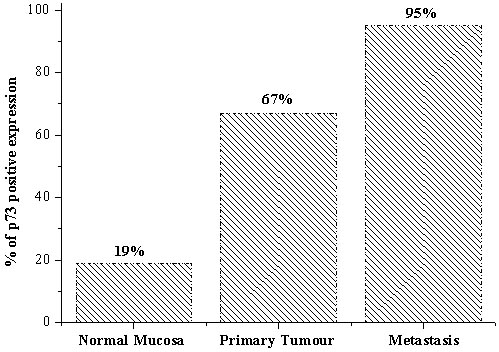
Figura 2. La frecuencia de expresión de p73 aumentó desde mucosa normal a tumor primario y a metástasis en ganglios linfáticos.

Figura 3. La mucosa normal no expresa la proteína p73 (a), las células del tumor primario correspondiente muestran fuerte expresión (b) y las metástasis correspondientes muestran fijación aun más marcada (c). Las secciones se tiñeron también con hematoxilina.
La asociación de la expresión de p73 con variables clinicopatológicas se presenta en la tabla 1. La expresión de p73 se correlacionó con la edad avanzada de los enfermos (p = 0.01). No pudimos encontrar correlación entre la expresión de p73, sexo, localización, estadio Dukes, patrón de crecimiento, diferenciación, infiltración y necrosis (p 0.05). Los pacientes con tumores p73 positivos tuvieron pronóstico significativamente más desfavorable respecto de los enfermos con tumores p73 negativos (p = 0.03, figura 4). En el análisis de variables múltiples, después del ajuste según parámetros clínicos y patológicos, el significado pronóstico de la expresión de p73 se mantuvo (p = 0.01, tabla 2). Liu y col. también encontraron que la mayor expresión de p73, determinada por inmunohistoquímica, se relacionó con sobrevida más corta en pacientes con cáncer colorrectal. Guan y col. revelaron que la expresión de p73 se relacionó con la angiogénesis en carcinomas colorrectales. No encontraron ninguna relación entre la expresión de p73, la diferenciación, el estadio, la localización y el tamaño.15,16
Tabla 1Tabla 2
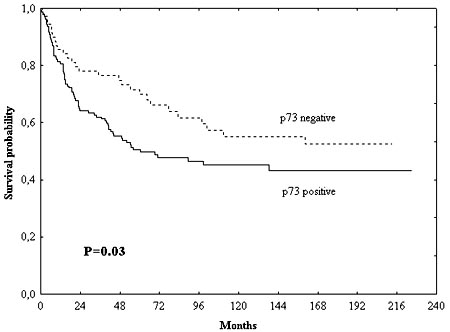
Figura 4. Los pacientes con tumores p73 positivos tuvieron supervivencia más corta que aquellos con tumores p73 negativos.
En el estudio actual la expresión de p73 se correlacionó en forma positiva con la expresión de ras (p = 0.01). Más aun, en los pacientes con tumores ras positivos, la expresión de p73 predijo en forma positiva peor evolución que la negatividad de p73 (p = 0.02). No encontramos correlación entre la expresión de p73 y la expresión de p53, DCC, Bax, mutaciones de MBD4 y RIZ. Recientemente, Petrenko y colaboradores encontraron que la p73 coopera con el ras en la transformación primaria de fibroblastos in vitro y en la inducción de fibrosarcomas derivados de MEF in vivo en ratones sin timo. Aunque la p73 comparte su estructura y composición funcional con p53, existe una diferencia significativa en el desarrollo de tumores.
En conclusión, la expresión de la proteína p73 es mayor durante la evolución de mucosa normal a tumores primarios y metástasis. Más aun, la expresión exagerada de p73 es un factor predictivo de pronóstico desfavorable en pacientes con cáncer colorrectal. Sin embargo, la LOH del gen no fue un factor importante en la aparición tumoral.
El autor no manifiesta conflictos.
 Bibliografía del artículo
Bibliografía del artículo
- Kaghad M, Bonnet H, Yang A et al. Monoallelically expressed gene related to p53 at 1p36, a region frequently deleted in neuroblastoma and other human cancer. Cell 1997; 90: 809-819.
- Moll UM, Erster S, Zaika A. p53, p63 and p73--solos, alliances and feuds among family members. Biochim Biophys Acta 2001; 1552: 47-59.
- Benard J, Douc-Rasy S, Ahomadegbe JC. TP53 family members and human cancers. Hum Mutat 2003; 21: 182-191.
- Sunahara M, Ichimiya S, Nimura Y et al. Mutational analysis of the p73 gene localized at chromosome 1p36.3 in colorectal carcinomas. Int J Oncol 1998; 13: 319-323.
- Zaika AI, Kovalev S, Marchenko ND et al. Overexpression of the wild type p73 gene in breast cancer tissues and cell lines. Cancer Res 1999; 59: 3257-3263.
- Yokomizo A, Mai M, Bostwick DG et al. Mutation and expression analysis of the gene in prostate cancer. Prostate 1999; 39: 94-100.
- Tokuchi Y, Hashimoto T, Kobayashi Y et al. The expression of p73 is increased in lung cancer, independent of p53 gene alteration. Br J Cancer 1999; 80: 1623-1629.
- Takahashi H, Ichimiya S, Nimura Y et al. Mutation, allelotyping, and transcription analyses of the p73 gene in prostatic carcinoma. Cancer Res 58: 2076-2077, 1998.
- Sun X-F, Ekberg H, Zhang H et al. Overexpression of ras is an independent prognostic factor in colorectal adenocarcinoma. APMIS 1998; 106: 657-664.
- Sun X-F, Carstensen JM, Zhang H et al. Prognostic significance of cytoplasmic p53 oncoprotein in colorectal adenocarcinoma. Lancet 1992; 340: 1369-1373.
- Sun X-F, Rütten S, Zhang H et al. Expression of the deleted in colorectal cancer gene is related to prognosis in DNA diploid and low proliferative colorectal adenocarcinoma. J Clin Oncol 1999; 17: 1745-1750.
- Jansson A, Sun X-F. Bax expression decreases significantly from primary tumour to metastases in colorectal cancer. J Clin Oncol 2002; 20: 811-816.
- Evertsson S, Wallin Å, Arbman G et al. The significance of microsatellite instability and MBD4 mutation in unselected colorectal cancer. Anticancer Res 2003; 23: 3569-2574.
- Emterling A, Wallin Å, Arbman G et al. Clinicopathological significance of MSI and RIZ in patients with unselected colorectal cancer. Ann Oncol 2004; 15: 00-00.
- Liu L, Cui X, Sakaguchi T, et al. Expression of p73 in colorectal carcinoma: clinicopathological relevance. J Int Med Res 2001; 29: 297-303.
- Guan M, Peng HX, Yu B et al. p73 Overexpression and angiogenesis in human colorectal carcinoma. Jpn J Clin Oncol 2003; 33: 215-220.
- Petrenko O, Zaika A, Moll UM. deltaNp73 facilitates cell immortalization and cooperates with oncogenic Ras in cellular transformation in vivo. Mol Cell Biol 2003; 23: 5540-5555.
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC





 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a:


