ANALISIS DEL PERFIL DE EXPRESION GENICA INDUCIDO EN MACROFAGOS EXPUESTOS A LDL OXIDADAS Y AL INHIBIDOR DE LA ACAT AVASIMIBE
(especial para SIIC © Derechos reservados)
Coautores
Véronique Noé* Juan Carlos Laguna** Carlos Julián Ciudad*** Marta Alegret****
Doctora en Farmacia. Departamento de Bioquímica y Biología Molecular. Universidad de Barcelona*
Doctor en Farmacia. Departamento de Farmacología y Química Terapéutica. Universidad de Barcelona**
Doctor en Farmacia. Departamento de Bioquímica y Biología Molecular. Universidad de Barcelona***
Doctora en Farmacia. Departamento de Farmacología y Química Terapéutica. Universidad de Barcelona****
Recepción del artículo: 12 de febrero, 2004
Aprobación: 0 de , 0000
 Conclusión breve
La utilización de técnicas de array de ADNc ha pemitido identificar nuevos genes potencialmente implicados en el desarrollo de la aterosclerosis, cuya expresión resulta modulada en macrófagos humanos expuestos a LDL oxidadas y al inhibidor de la ACAT avasimibe
Conclusión breve
La utilización de técnicas de array de ADNc ha pemitido identificar nuevos genes potencialmente implicados en el desarrollo de la aterosclerosis, cuya expresión resulta modulada en macrófagos humanos expuestos a LDL oxidadas y al inhibidor de la ACAT avasimibe
 Resumen
En un artículo reciente de nuestro grupo de investigación (Llaverias y col., Eur J Pharmacol 451:11-17, 2002) demostramos que el inhibidor de la ACAT avasimibe reduce el contenido intracelular de ésteres de colesterol en macrófagos THP-1. En el trabajo que se presenta a continuación se estudió el efecto del avasimibe sobre el perfil de expresión génica en dichas células, con la finalidad de identificar genes regulados por este fármaco que puedan estar implicados en el desarrollo de la lesión aterosclerótica. Para ello se utilizó la tecnología de los arrays de ADNc, útil para el escrutinio de grandes cantidades de genes de manera simultánea. Entre los resultados obtenidos, destacamos el marcado incremento de los niveles de ARNm de la FABP4 tras la exposición de macrófagos a LDL oxidadas, que resulta atenuado cuando se incuban las células con dichas lipoproteínas en presencia de avasimibe. Se ha descrito que la ausencia de FABP4 en el macrófago protege a los ratones apoE-/- del desarrollo de aterosclerosis. Por tanto, la inhibición de la expresión de FABP4 en el macrófago puede representar un nuevo mecanismo de acción antiaterosclerótica directa del avasimibe, que podría dificultar la acumulación de colesterol en el macrófago.
Resumen
En un artículo reciente de nuestro grupo de investigación (Llaverias y col., Eur J Pharmacol 451:11-17, 2002) demostramos que el inhibidor de la ACAT avasimibe reduce el contenido intracelular de ésteres de colesterol en macrófagos THP-1. En el trabajo que se presenta a continuación se estudió el efecto del avasimibe sobre el perfil de expresión génica en dichas células, con la finalidad de identificar genes regulados por este fármaco que puedan estar implicados en el desarrollo de la lesión aterosclerótica. Para ello se utilizó la tecnología de los arrays de ADNc, útil para el escrutinio de grandes cantidades de genes de manera simultánea. Entre los resultados obtenidos, destacamos el marcado incremento de los niveles de ARNm de la FABP4 tras la exposición de macrófagos a LDL oxidadas, que resulta atenuado cuando se incuban las células con dichas lipoproteínas en presencia de avasimibe. Se ha descrito que la ausencia de FABP4 en el macrófago protege a los ratones apoE-/- del desarrollo de aterosclerosis. Por tanto, la inhibición de la expresión de FABP4 en el macrófago puede representar un nuevo mecanismo de acción antiaterosclerótica directa del avasimibe, que podría dificultar la acumulación de colesterol en el macrófago.
 Palabras clave
Macrófagos, LDL oxidadas, avasimibe, expresión génica, arrays
Clasificación en siicsalud
Palabras clave
Macrófagos, LDL oxidadas, avasimibe, expresión génica, arrays
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/66720
Especialidades
 Principal: Cardiología,
Principal: Cardiología,
 Relacionadas: Bioquímica, Farmacología, Genética Humana, Medicina Farmacéutica, Medicina Interna,
Relacionadas: Bioquímica, Farmacología, Genética Humana, Medicina Farmacéutica, Medicina Interna,
 Enviar correspondencia a:
Enviar correspondencia a:
Dra. Marta Alegret. Departamento de Farmacología. Facultad de Farmacia. Universidad de Barcelona, Av. Diagonal 643. 08028 Barcelona (España) Alegret M
ANALYSIS OF GENE EXPRESSION PROFILE IN MACROPHAGES TREATED WITH OXIDIZED LDL AND THE ACAT INHIBITOR AVASIMIBE
 Abstract
Abstract
In a recent article (Llaverias et al., Eur J Pharmacol 451:11-17, 2002) we demonstrated that the ACAT inhibitor avasimibe reduces the intracellular content of cholesteryl esters in THP-1 macrophages. In the present work, we have investigated the effects of avasimibe on the pattern of gene expression in the above mentioned cells, to identify novel genes regulated by this agent that may be involved in atherosclerosis development. To this end, we have used ADNc arrays that allow the simultaneous screening of a huge number of genes. Among the results obtained, it is of special interest the increase in the ARNm levels of FABP4 detected after exposure of the cells to oxidized-LDL, which is attenuated when the cells were treated in the presence of avasimibe. It has been described that the absence of FABP4 in macrophages protects apoE-deficient mice from atherosclerosis development. Therefore, the inhibition of FABP4 expression in macrophages may represent a novel mechanism of action that could explain the direct antiatherosclerotic effects of avasimibe, impairing the accumulation of cholesterol in these cells.
 Key words
Key words
Macrophages, oxidized ldl, avasimibe, gene expression, arrays
ANALISIS DEL PERFIL DE EXPRESION GENICA INDUCIDO EN MACROFAGOS EXPUESTOS A LDL OXIDADAS Y AL INHIBIDOR DE LA ACAT AVASIMIBE
(especial para SIIC © Derechos reservados)
Artículo completo
Introducción
Las enfermedades cardiovasculares son la primera causa de muerte en los países industrializados.1 Entre los factores de riesgo implicados en el desarrollo y progresión de la aterosclerosis se destacan los niveles elevados de colesterol unido a lipoproteínas de baja densidad (LDL).2 En este sentido, las estatinas han demostrado ser muy eficaces para corregir las anomalías lipídicas y reducir la mortalidad asociada.3 Sin embargo, en un porcentaje elevado de casos no se consigue reducir el colesterol LDL a los niveles deseados,4 por lo que resulta necesaria la búsqueda de nuevas aproximaciones terapéuticas. Por otra parte, resulta evidente que el tratamiento y la prevención de la enfermedad aterosclerótica deben implicar no sólo la corrección de los factores de riesgo, sino también el control farmacológico directo de los procesos que tienen lugar dentro de la propia pared arterial. Entre estos procesos resulta fundamental la acumulación de ésteres de colesterol en macrófagos mediada por el enzima acil-CoA:colesterol aciltransferasa (ACAT).5 La inhibición de esta enzima constituye una interesante diana terapéutica. Entre los inhibidores de la ACAT más conocidos se halla el compuesto CI-1011,6 sintetizado originalmente por Parke-Davis, actualmente integrada en Pfizer Global Research and Development. Este compuesto, denominado avasimibe, es el inhibidor de la ACAT que se halla en una fase más avanzada de estudios clínicos (fase III).7
En un estudio reciente de nuestro grupo de investigación8 demostramos en macrófagos de origen humano que la adición de avasimibe durante el proceso de carga lipídica (incubación simultánea con el fármaco y LDL modificadas por acetilación) producía una disminución, dependiente de la concentración, en el contenido intracelular de ésteres de colesterol. Este efecto no se acompañaba de un incremento en el contenido intracelular de colesterol libre. Teniendo en cuenta la citotoxicidad que se deriva de la acumulación de colesterol libre en macrófagos,9-11 los resultados anteriores sugieren un mejor perfil de seguridad para avasimibe, en comparación con otros inhibidores de la ACAT.7
La exposición de macrófagos a LDL modificadas, que constituyen un entorno proaterógeno y proinflamatorio, produce modificaciones en la expresión de un gran número de genes. Esta alteración en el patrón de expresión génica puede ser modificada, o revertida en cierto grado, por la exposición de dichas células a fármacos como los inhibidores de la ACAT. Hasta el momento, los estudios de modificación de la expresión génica se realizaron, en la mayoría de los casos, a través del estudio individual de un determinado gen o proteína. Sin embargo, probablemente existen numerosos genes cuya participación en el proceso aterosclerótico no se ha identificado todavía. A lo largo de los últimos 10 años se desarrollaron progresivamente tecnologías útiles para el escrutinio de grandes cantidades de genes de manera simultánea. Los arrays de ADNc utilizados son comerciales y están constituidos por membranas de nailon en las que se han depositado fragmentos de ADNc que son hibridados a sondas radiactivas [32P] obtenidas de tejidos o células tratadas en diferentes condiciones. La intensidad de las marcas correspondientes a cada gen es proporcional al nivel de expresión de este gen en la célula en una situación determinada.
En el trabajo que se presenta a continuación se estudió el efecto de avasimibe sobre el perfil de expresión génica en macrófagos THP-1 expuestos simultáneamente al fármaco y a LDL oxidadas, con la finalidad de identificar genes regulados por este fármaco que puedan estar implicados en el desarrollo de la lesión aterosclerótica.
Materiales y métodos
Las células monocíticas THP-1 se diferenciaron a macrófagos por exposición a PMA (0.1 μM, 24 h). Los macrófagos se trataron durante 24 h con vehículo, LDL oxidadas (100 μg/ml) o con LDL oxidadas en presencia de avasimibe 2 μM (donación de Pfizer).
El perfil de expresión génica se analizó por hibridación a arrays de ADNc (Atlas Human Cardiovascular Array, BD-Clontech®). Para ello, las células se recogieron y se preparó RNA total mediante el procedimiento recomendado por BD-Clontech®). Las sondas radioactivas de ADNc se prepararon a partir de 5 μg de RNA total. El RNA se hibridó 2 min a 70ºC seguido de 2 min a 50ºC con 1 μl de la mezcla específica de primers, correspondiente a los genes presentes en el array de ADNc. La reacción de RT se llevó a cabo utilizando MMLV RT y 30 μCi de [α-32P]dATP durante 25 min a 50ºC. Después de filtrar los nucleótidos no incorporados a través de columnas de Sephadex G-50, los ADNc marcados se hibridaron a las membranas utilizando ExpressHyb (BD-Clontech®) en un horno de hibridación a 68ºC durante la noche. Al día siguiente, las membranas se lavaron y se contactaron con pantallas de europio durante 10 a 14 días. Las pantallas se escanearon con un Phosphorimager (Modelo Storm, de Molecular Dynamics).
La cuantificación se llevó a cabo mediante el programa Atlas Image 2.01 (Clontech) y el análisis mediante el programa GeneSpring 5.0 de Silicon Genetics. Para cada gen, se calculó la intensidad corregida tras restar el fondo. La normalización global de las membranas se realizó por el método de la mediana, aplicando el percentil 50%. La expresión de cada gen se calcula a partir del cociente (ratio) del valor obtenido para cada tratamiento en relación al control, después de normalizar los datos. Las listas de restricción se generaron descartando aquellos genes cuya expresión diferencial fuera menor que el doble del background mínimo.
Resultados
En primer lugar, con el fin de identificar los genes afectados por la exposición de las células a un entorno proaterógeno, se realizaron incubaciones de los macrófagos con LDL oxidadas (100 μg/ml, durante 24 horas). Se llevaron a cabo 3 cultivos diferentes, con lotes distintos de células y de LDL oxidadas. Únicamente se consideraron aquellos genes cuya expresión resultó inducida o inhibida más de 2 veces de forma significativa (p < 0.05) a partir de los valores de los 3 arrays realizados. La exposición a LDL oxidadas inhibió la expresión de 22 genes, mientras que un total de 5 genes resultaron inducidos (Tabla 1). Para validar los resultados obtenidos se analizó la expresión a ARNm por RT-PCR de una serie de genes seleccionados por su potencial relación con el proceso aterosclerótico. Se confirmó que la exposición a LDL oxidadas incrementó 2.3 veces los niveles de ARNm del receptor scavenger CD68, 8.5 veces los correspondientes a la FABP4 (fatty acid binding protein 4) y redujo un 40% los de la metaloproteinasa 9 (MMP9) (Figura 1).

Tabla 1. Genes diferencialmente expresados en macrófagos THP-1 tratados con oxLDL. La tabla muestra el nombre y el número de Genbank de los genes que resultaron diferencialmente expresados en células expuestas a LDL oxidadas (tratadas) respecto de las células tratadas con vehículo (control). La tercera columna corresponde a la expresión relativa de cada gen, calculada como la relación entre la intensidad ajustada de las células tratadas respecto de las controesl. La última columna indica la categoría funcional a la cual pertenece cada gen. Los resultados son representativos de tres experimentos independientes realizados con diferentes lotes de células y lipoproteínas.

Figura 1. Análisis de los niveles de ARNm de FABP4, CD18 y MMP9 mediante RT-PCR de macrófagos THP-1 tratados con LDL oxidadas durante 24 horas. Se muestra una autorradiografía representativa y la cuantificación de dichos niveles de ARNm normalizados respecto de los del gen de la tubulina 1 (TUBA1). Los resultados se expresan en unidades arbitrarias como la media ± desviación estándar de tres experimentos independientes realizados con diferentes lotes de células y de lipoproteínas. * p < 0.05.
Paralelamente se procedió a determinar el efecto del tratamiento de dichas células con avasimibe. El tratamiento con este fármaco produjo una reducción en la expresión de 13 genes, mientras que un total de 4 resultaron inducidos (Tabla 2). El análisis de los niveles de ARNm de FABP4 por RT-PCR confirmó que el avasimibe produce una reducción del 38% en la expresión de dicho gen (Figura 2).

Tabla 2. Genes diferencialmente expresados en macrófagos THP-1 tratados con avasimibe. La tabla muestra el nombre y el número de Genbank de los genes que resultaron diferencialmente expresados en células expuestas a avasimibe (2 μM durante 24 horas) en presencia de LDL oxidadas (tratadas) respecto de las células incubadas únicamente con estas LDL (control). La tercera columna corresponde a la expresión relativa de cada gen, calculada como la relación entre la intensidad ajustada de las células tratadas respecto a las controles. La última columna indica la categoría funcional a la cual pertenece cada gen. Los resultados son representativos de tres experimentos independientes realizados con diferentes lotes de células y lipoproteínas.
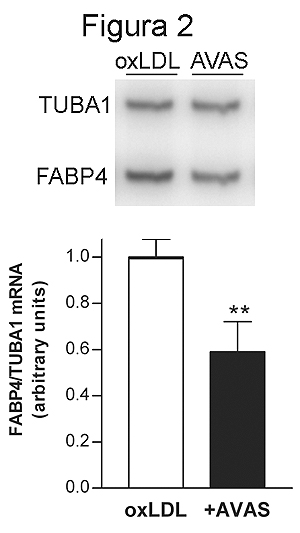
Figura 2. Análisis de los niveles de ARNm de FABP4 mediante RT-PCR de macrófagos THP-1 tratados con avasimibe (2 μM durante 24 horas) en presencia de LDL oxidadas respecto de las mismas células incubadas únicamente con estas LDL. Se muestra una autoradiografía representativa y la cuantificación de dichos niveles de ARNm normalizados respecto de los del gen de la tubulina 1 (TUBA1). Los resultados se expresan en unidades arbitrarias como la media ± desviación estándar de tres experimentos independientes realizados con diferentes lotes de células y de lipoproteínas. ** p < 0.01.
Discusión
El monocito/macrófago es una célula clave en el desarrollo del proceso aterosclerótico.12 En sus fases iniciales, la captación de lipoproteínas oxidadas conduce a la formación de células espumosas en la pared arterial. Uno de los objetivos del presente estudio era investigar el proceso de aterogénesis desde el punto de vista de la regulación de la expresión génica. Para ello, se realizaron los experimentos en monocitos THP-1, diferenciados a macrófagos tras exposición a ésteres de forbol, un tipo de células ampliamente utilizado como modelo de formación de células espumosas.13 El tratamiento de dichas células con LDL oxidadas produjo modificaciones en la expresión de una serie de genes, cuya función podría estar relacionada con la aterosclerosis. Cuando estos genes se clasificaron según su localización celular y su función, se observó que principalmente se producía una inhibición de la expresión de genes que codifican proteínas localizadas en el retículo endoplasmático o dirigidas hacia la zona extracelular (proteínas de membrana o secretadas al medio). Este patrón coincide con el descrito por Andersson y col.14 en un modelo similar al nuestro.
Entre los genes que resultan inducidos tras la exposición a LDL oxidadas, podemos destacar la glucoproteína de membrana CD68. Se trata de un receptor scavenger de clase D, que se expresa únicamente en macrófagos y células dendríticas, capaz de unir e internalizar LDL oxidadas.15 Recientemente se ha propuesto que CD68 desempeña un papel crucial en la progresión de macrófagos a células espumosas.16 Otro de los genes regulados por LDL oxidadas es la fatty acid binding protein 4 (FABP 4), también denominada ap2. Aunque inicialmente fue identificada en adipocitos, la FABP4 se expresa también en macrófagos.17 Su expresión resulta incrementada 17 veces, respecto de macrófagos control, según los resultados obtenidos de los arrays de ADNc, y 8.4 veces en los estudios realizados por RT-PCR (p < 0.05). Nuestros resultados coinciden con los de Fu y col.,18 que sugieren que el mecanismo por el cual las LDL modificadas inducen la expresión de FABP4 en estas células está relacionado con la activación de la vía de NF-κB. Se ha visto que FABP4 se halla altamente expresada en macrófagos de lesiones ateroscleróticas de conejos hipercolesterolémicos.19 Nuestros resultados demuestran que la adición de avasimibe junto con las LDL oxidadas atenúa la inducción de FABP4 producida por dichas lipoproteínas. Así, la relación de la expresión de FABP4 en células tratadas con LDL oxidadas y avasimibe, respecto de células tratadas con LDL oxidadas en ausencia de fármaco es de 0.18 y 0.62 (p < 0.01), según los resultados de los arrays y de los estudios de RT-PCR, respectivamente. La ausencia de FABP4 en el macrófago protege a los ratones apoE-/- del desarrollo de aterosclerosis.20 Por tanto, la inhibición de la expresión de FABP4 en el macrófago puede representar un nuevo mecanismo de acción antiaterosclerótica directa de avasimibe, que dificultaría la acumulación de colesterol en el macrófago.
Otro gen cuya expresión resulta reducida en macrófagos expuestos a avasimibe y LDL oxidadas es la HDL binding protein (HBP) o vigilin. Es una proteína de membrana, capaz de unirse a las HDL, aunque no parece comportarse como un receptor de membrana típico.21 Aunque su función no está clara, se ha propuesto que participa en el metabolismo intracelular de esteroles. Estudios en conejos han mostrado que HBP se expresa en macrófagos cargados de lípidos, colocalizada con apo E.22 Se ha propuesto que factores similares pueden afectar la expresión de ambos genes en macrófagos. De hecho, nuestros resultados muestran una reducción simultánea en la expresión de HBP y de apo E. Así, la relación de la expresión es de 0.45 y 0.35 para HBP y apo E, respectivamente. El hecho de que HBP se halle expresada en macrófagos de lesiones ateroscleróticas indica que su inhibición tras el tratamiento con avasimibe podría constituir un efecto beneficioso, hasta el momento no descrito para ningún otro fármaco, respecto del desarollo de la aterosclerosis. Por lo que respecta a la apo E, en general se considera una proteína antiaterogénica. En concreto, la apo E secretada por los macrófagos actúa como un aceptor de colesterol libre que es liberado hacia el exterior de la célula,23 facilitando el transporte inverso de colesterol. Este papel protector se ha confirmado en estudios en ratones deficientes en apo E, pero cuyos macrófagos sí expresan esta apolipoproteína.24 Estos animales, pese a que presentan niveles circulantes de apo E muy bajos, muestran resistencia al desarrollo de aterosclerosis. La expresión de apo E en el macrófago se halla regulada por los niveles de colesterol.25 Otros autores observaron reducciones en la expresión de apo E en macrófagos tratados con estatinas y atribuyeron este efecto a la reducción del contenido de colesterol intracelular.26 En nuestro caso, el efecto del avasimibe consiste en inhibir la esterificación de colesterol, pero no reduce los niveles de colesterol libre en el interior del macrófago,8 por lo que este mecanismo no explicaría la reducción en los niveles de ARNm de apo E. Puede resultar paradójico que fármacos potencialmente antiaterogénicos como estatinas o inhibidores de la ACAT reduzcan la expresión de una proteína antiaterogénica. Sin embargo, en nuestras condiciones de trabajo, en las que los macrófagos están expuestos a concentraciones muy elevadas de lipoproteínas, la reducción en la secreción de apo E podría representar una respuesta adaptativa destinada a reducir la captación de éstas.
Por último, uno de los procesos implicados directamente en la progresión y desarrollo de la placa de ateroma es la angiogénesis.27 La degradación de la matriz extracelular (ECM) resulta clave en el proceso angiogénico y es llevada a cabo por sistemas proteolíticos como el sistema fibrinolítico (plasminógeno/plasmina) y las metaloproteinasas (MMP).28 Existen puntos de contacto entre ambos sistemas: el activador tisular de plasminógeno (tPA) convierte el plasminógeno en plasmina, la cual puede activar las MMP latentes. Estas son una familia de enzimas encargadas de degradar la ECM, lo cual predispone la placa de ateroma a la ruptura. Todas las células vasculares pueden secretar MMP y, en el caso de los macrófagos, la mayoritaria es la MMP-9.29 La actividad de estos enzimas está regulada no sólo a nivel de expresión génica sino también por los inhibidores tisulares de metaloproteinasas (TIMP), principalmente TIMP-1.30 En el presente estudio se demuestra que el tratamiento con avasimibe reduce la expresión de diversos componentes de estos sistemas, como MMP-9, tPA y TIMP-1. La menor expresión de MMP-9 y de tPA sugiere que el avasimibe podría actuar inhibiendo la angiogénesis, lo cual sería beneficioso en cuanto a limitar el desarrollo de la placa de ateroma. Además, la inhibición d la MMP-9 reduciría la degradación de la ECM, ralentizando el proceso de aterogénesis y aumentando la estabilidad de las placas de ateroma ya formadas. Sin embargo, el efecto final de avasimibe sobre la actividad MMP-9 puede resultar contrarrestado por la reducción en la expresión de su inhibidor TIMP-1.
En conclusión, la utilización de técnicas de array de ADNc ha pemitido identificar nuevos genes potencialmente implicados en el desarrollo de la aterosclerosis, cuya expresión resulta modulada en macrófagos humanos expuestos a LDL oxidadas y al inhibidor de la ACAT avasimibe. Entre los efectos más interesantes obtenidos hasta el momento, se destaca la marcada inducción de la FABP4 por LDL oxidadas, que resulta revertida, al menos en parte, por el tratamiento con avasimibe. La FABP4 presenta altos niveles de expresión en macrófagos de lesiones ateroscleróticas, mientras que la falta de expresión de esta proteína protege respecto del desarrollo de lesiones en modelos animales susceptibles.
 Bibliografía del artículo
Bibliografía del artículo
- Singh BK, Mehta JL. Management of dyslipidemia in the primary prevention of coronary heart disease. Curr Opin Cardiol 2002;17:503-511.
- Executive Summary of the Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). JAMA 2001;285:2486-2497.
- Maron DJ, Fazio S, McRae FL. Current perspectives on statins. Circulation 2000;101:207-213.
- Pearson TA, Laurora I, Chu H et al. The Lipid Treatment Assessement Project (L-TAP): a multicenter survey to evaluate the percentages of dyslipidemic patients receiving lipid-lowering therapy and achieving low-density lipoprotein cholesterol goals. Arch Intern Med 2000;160:459-467.
- Ross R. The pathogenesis of atherosclerosis: an update. N Engl J Med 1986;314:488-500.
- Lee HT, Sliskovic DR, Picard JA, et al. Inhibitors of acyl-CoA: cholesterol O-acyl transferase (ACAT) as hypocholesterolemic agents. CI-1011: an acyl sulfamate with unique cholesterol-lowering activity in animals fed noncholesterol- supplemented diets. J Med Chem 1996;39:5031-5034.
- Llaverias G, Laguna JC, Alegret M. Pharmacology of the ACAT inhibitor avasimibe (CI-1011). Cardiovasc Drug Rev 2003.
- Llaverias G, Jove M, Vazquez-Carrera M, et al. Avasimibe and atorvastatin synergistically reduce cholesteryl ester content in THP-1 macrophages. Eur J Pharmacol 2002;451:11-17.
- Warner GJ, Stoudt G, Bamberger M, et al. Cell toxicity induced by inhibition of acyl coenzyme A:cholesterol acyltransferase and accumulation of unesterified cholesterol. J Biol Chem 1995;270:5772-5778.
- Kellner-Weibel G, Jerome WG, Small D et al. Effects of intracellular free cholesterol accumulation on macrophage viability: a model for foam cell death. Arterioscler Thromb Vasc Biol 1998;18:423-431.
- Perrey S, Legendre C, Matsuura A, et al. Preferential pharmacological inhibition of macrophage ACAT increases plaque formation in mouse and rabbit models of atherogenesis. Atherosclerosis 2001;155:359-370.
- Li AC, Glass CK. The macrophage foam cell as a target for therapeutic intervention. Nat Med 2002;8:1235-1242.
- Auwerx J. The human leukemia cell line THP-1: a multifaceted model for the study of monocyte-macrophage differentiation. Experientia 1991;47:22-31.
- Andersson T, Boräng S, Larsson M, et al. Novel candidate genes for atherosclerosis are identified by representational difference analysis-based transcript profiling of cholesterol-loaded macrophages. Pathobiology 2001;69:304-314.
- Dhaliwal BS, Steinbrecher UP. Scavenger receptors and oxidized low density lipoproteins. Clin Chim Acta 1999;286:191-205.
- Tsukamoto K, Kinoshita M, Kojima K, et al. Synergically increased expression of CD36, CLA-1 and CD68, but not of SR-A and LOX-1, with the progression to foam cells from macrophages. J Atheroscler Thromb 2002;9:57-64.
- Cabrero A, Cubero M, Llaverias G, et al. Differential effects of peroxisome proliferator-activated receptor activators on the ARNm level of genes involved in lipid metabolism in primary human monocyte-derived macrophages. Metabolism 2003;52:652-657.
- Fu Y, Luo N, Lopes-Virella M F. Oxidized LDL induces the expression of ALBP/aP2 ARNm and protein in human THP-1macrophages. J Lipid Res 2000;41:2017-2023.
- Sun L, Nicholson AC, Hajjar DP, et al. Adipogenic differentiating agents regulate expression of fatty acid binding protein and CD36 in the J744 macrophage cell line. J Lipid Res 2003;44:1877-1886.
- Makowski L, Boord JB, Maeda K, et al. Lack of macrophage fatty-acid-binding protein aP2 protects mice deficient in apolipoprotein E against atherosclerosis. Nat Med 2001;7:699-705.
- Fidge N. High density lipoprotein receptors, binding proteins, and ligands. J Lipid Res 1999;40:187-201.
- Chiu DS, Oram JF, LeBoeuf RC et al. High-density lipoprotein-binding protein (HBP)/vigilin is expressed in human atherosclerotic lesions and colocalizes with apolipoprotein E. Arterioscler Thromb Vasc Biol 1997;-2350.
- Zhang W-Y, Gaynor PM, Kruth HS. Apolipoprotein E produced by human monocyte-derived macrophages mediates cholesterol efflux that occurs in the absence of added cholesterol acceptors. J Biol Chem 1996;271:28641-28646.
- Bellosta S, Mahley RW, Sanan DA, Murata J, Newland DL, Taylor JM, Pitas RE. Macrophage-specific expression of human apolipoprotein E reduces atherosclerosis in hypercholesterolemic apolipoprotein E-null mice. J Clin Invest 1995;96:2170-2179.
- Mazzone T, Basheeruddin K. Dissociated regulation of macrophage LDL receptor and apolipoprotein E gene expression by sterol. J Lipid Res 1991;32:507-514.
- Castilho LN, Chamberland A, Boulet L, et al. Effect of atorvastatin on ApoE and ApoC-I synthesis and secretion by THP-1 macrophages. J Cardiovasc Pharmacol 2003;42:251-257.
- O'Brien ER, Garvin MR, Dev R, et al. Angiogenesis in human coronary atherosclerotic plaques. Am J Pathol 1994;145:883-894.
- Lijnen HR. Plasmin and Matrix Metalloproteinases in Vascular Remodeling. Thromb Haemost 2001;86:324-333.
- Winberg JO, Kolset SO, Berg E, Uhlin-Hansen L. Macrophages secrete matrix metalloproteinase 9 covalently linked to the core protein of chondroitin sulphate proteoglycans. J Mol Biol 2000;304:669-680.
- Death AK, Fisher EJ, McGrath KCY, et al. High glucose alters matrix metalloproteinase expression in two key vascular cells: potential impact on atherosclerosis in diabetes. Atherosclerosis 2003;168:263-269.
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC





 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a:


