



 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a:A ND acomete cerca de 35% dos pacientes portadores de DM, tipo 1 ou 2.6 As razões pelas quais alguns indivíduos são acometidos pela doença renal e outros são poupados não são totalmente claras. Dois grandes estudos recentes, um em pacientes com DM tipo 1 (DCCT, Diabetes Control Clinical Trial)7 e outro em pacientes com DM tipo 2 (UKPDS, United Kingdom Prospective Diabetes Study)8 demonstraram que o controle glicêmico rígido reduz em até 50% o desenvolvimento e a progressão da ND, entretanto alguns indivíduos com bom controle glicêmico desenvolveram ND enquanto outros com mau controle foram poupados da doença renal. Essas observações sugerem que a hiperglicemia é o fator necessário mas não suficiente para o desenvolvimento da ND e que outros fatores são necessários para o surgimento dessa complicação crônica do DM. Observações epidemiológicas em pacientes com DM tipo 1 corroboram esta última hipótese. Se a hiperglicemia fosse o único fator responsável pelo desenvolvimento da ND seria esperado que quanto mais tempo o indivíduo vivesse com DM maior a chance de desenvolver ND, mas isso não ocorre. Em pacientes com DM tipo 1 a ND praticamente não ocorre durante os 5 primeiros anos de duração do DM, a partir daí a sua incidência aumenta rapidamente, atingindo o pico com 15 a 17 anos de duração do DM, e então começa a cair, de tal forma que a chance de desenvolvimento da ND em um indivíduo com DM tipo 1 por mais de 30 anos é relativamente pequena.6 Isso sugere que existam indivíduos suscetíveis à ND e que uma vez esgotados esses indivíduos os pacientes remanescentes são relativamente resistentes à ND. Predisposição herdada para nefropatia diabética é fortemente sugerida por estudos que demonstram que esta complicação do DM ocorre com maior frequência em determinadas familias.9-11 A chance de um indivíduo diabético apresentar nefropatia aumenta em 4 a 5 vezes se ele tiver um irmão com nefropatia diabética.9 Por outro lado, filhos de pais diabéticos com proteinúria apresentam risco de desenvolver nefropatia 3 vezes superior aos filhos de pais com normoalbuminúria.10 Entretanto, estes estudos não descartam a possibilidade de que fatores ambientais comuns aos irmãos possam contribuir para suscetibilidade ou proteção à ND, além disso não sugerem possíveis mecanismos envolvidos na suscetibilidade à ND.
Várias linhas de evidências sugerem que a predisposição à hipertensão arterial (HA) poderia aumentar o risco de lesão renal em pacientes com DM. A frequência de HA e os níveis tensionais são maiores em pais de pacientes diabéticos com nefropatia que em pais de indivíduos sem evidências de doença renal.12,13 Além disso, tem sido reportado que pacientes diabéticos com nefropatia apresentam aumento do contratransporte de sódio e lítio (CT Na+/Li+) em hemácias quando comparados a indivíduos sem nefropatia.13,14 O aumento da atividade deste transporte celular de cátions tem sido associado à predisposição à HA essencial e cerca de 80% da sua variabilidade interindividual é explicada por influência genética.15,16 Estudos prospectivos confirmam que em pacientes diabéticos a elevação do CT Na+/Li+ aumenta significativamente o risco de desenvolvimento da ND.17 Embora essas observações sugiram fortemente que a predisposição à HA possa participar na suscetibilidade à ND não apontam quais seriam os possíveis mecanismos envolvidos. A investigação desses mecanismos requer o estudo de indivíduos com predisposição à HA mas ainda normotensos, premissa quase impossível ser atingida em humanos.
Com o objetivo de compreender os mecanismos celulares e moleculares envolvidos na suscetibilidade à ND e predisposição à HA nosso grupo tem estudado ratos espontaneamente hipertensos (SHR) com DM induzido por estreptozotocina. É sabido que estes animais quando tornados diabéticos com estreptozotocina apresentam lesões renais mais intensas que os seus controles geneticamente normotensos, ratos Wistar Kyoto (WKY).18 Os ratos SHR, extensivamente estudados como modelo de HA essencial em humanos, apresentam período de normotensão, 4 primeiras semanas de vida, seguida do desenvolvimento de hipertensão em 100% dos animais.19 Portanto, durante as 4 primeiras semanas estes animais apresentam a genética da hipertensão sem a presença do fenótipo, hipertensão, constituindo interessante modelo para o estudo do efeito de fatôres herdados associados à HA. Tem sido descrito que animais SHR com 4 semanas, ainda normotensos, apresentam menor expressão de RNA mensageiro para fibronectina, acompanhada de redução da proteína, em glomérulos isolados e células mesangiais em cultura, que os seus controles geneticamente normotensos, ratos WKY.20 Estas alterações em um componente da matriz extracelular, implicada na glomerulosclerose diabética, estava acompanhada de maior capacidade de proliferação das células mesangiais em cultura dos ratos SHR.20 Recentemente, confirmamos e extendemos esta última observação demonstrando que, 'in vivo', os ratos SHR com 4 semanas de idade portanto, pré-hipertensão, apresentam aumento da replicação celular renal.21 Além disso, observamos que esta alteração na replicação de células renais não estava limitada ao glomérulo mas extendia-se para região túbulo-intersticial. Essa última observação é importante uma vez que células tubulares em cultura expostas a altas concentrações de glicose apresentam aumento na produção de componentes da matriz extracelular.22 Em relação a isso, recentemente, demonstramos que ratos SHR tornados diabéticos com 4 semananas de idade apresentam, após 20 dias de duração do DM, aumento na expressão glomerular de fibronectina, um componente da matriz extracelular que está elevado na glomerulosclerose diabética (figuras 1 e 2).23 Essa alteração em um componente da matriz extracelular não foi observada nos ratos diabéticos geneticamente normotensos, WKY. Essas observações sugerem que a interação entre predisposição à hipertensão arterial e suscetibilidade a ND possa residir em alterações herdadas na replicação celular e mecanismos que determinam aumento da matriz extracelular. Interessante salientar que o aumento na expressão renal de fibronectina e albuminúria puderam ser totalmente revertidos quando o desenvolvimento da hipertensão arterial nos ratos SHR foi evitado através do emprego de drogas anti-hipertensivas, apesar da manutenção de níveis elevados de glicemia (figuras 3 e 4).24,25 Esses efeitos foram obtidos independentemente da classe de drogas anti-hipertensivas empregadas, inibidores da enzima de conversão da angiotensina I, antagonistas de receptores AT1 da angiotensina II, bloqueadores de canais de cálcio ou um drogas anti-hipertensivas clássicas como: hidroclorotiazída, reserpina e hidralazina.24,25 Esses últimas observações sugerem que o tratamento anti-hipertensivo precoce é uma manobra adequada na prevenção da nefropatia diabética em indivíduos com predisposição à hipertensão arterial.
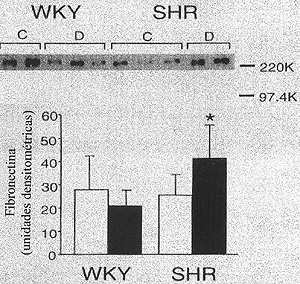
Figura 1. Fibronectina em rim de ratos Wistar Kyoto (WKY) e espontaneamente hipertensos (SHR). (Acima) Detecção imunológica (Western blot) de fibronectina em córtex renal. É apresentado um experimento no qual 20 µg de lisado do córtex renal de ratos (c, controle e D, diabético) foram submetidos à eletroforese e as bandas imunoreativas detectadas com anticorpo anti-fibronectina. (Abaixo) Resumo das análises densitométricas da fibronectina em rins de ratos WKY e SHR controles () e diabéticos (). *p < 0.05 comparado com todos os outros grupos. Os resultados são apresentados como médias ± erro padrão. Dados obtidos da referência 23 com modificações.
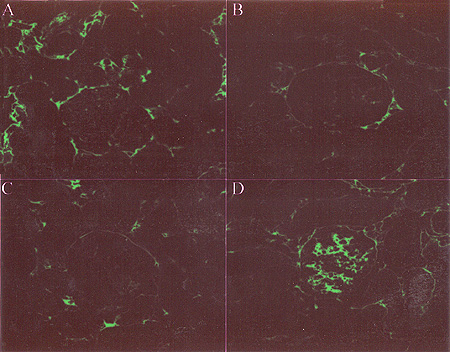
Figura 2. Fotomicrografia fluorescente obtida com microscopia confocal de imunoreatividade para fibronectina em glomérulo de rato WKY controle (A) e diabético (B) e SHR controle (C) e diabético (D). Barra = 50 µm. Dados obtidos da referência 23 com modificações.
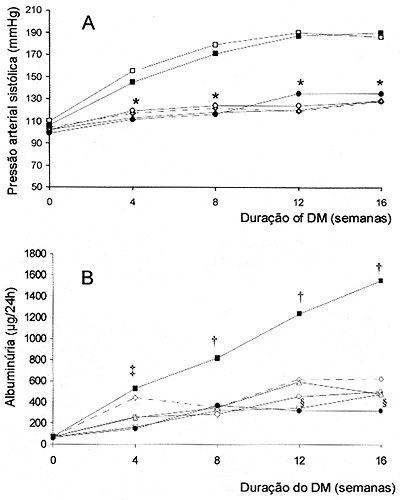
Figura 3. Média da pressão arterial sistólica (mm Hg, A) e excreção urinária de albumina (µg/24 h, B) durante período de observação de 16 semanas em ratos SHR controles (, n = 12), SHR diabéticos (DM) (, n = 11), DM tratados com Losartan (, n = 10), DM tratados com Captopril (, n = 10), DM tratados com esquema tríplice (hidroclorotiazída, hidralazina e reserpina) (, n = 10), e controles normotensos, Wistar Kyoto (WKY) (, n = 7). * p<0,0001 para todos os grupos tratados e ratos WKY vs. SHR controle e DM, † p<0,0001 para SHR DM vs. SHR controle, grupos tratados e ratos WKY nas semanas 8, 12 e 16, ‡ p<0,0001 para SHR DM e DM tratados com Losartan vs. todos os outros grupos na semana 4, p<0,05 para WKY vs. todos grupos tratados nas semanas 12 e 16. Dados obtidos da referência 24 com modificações.
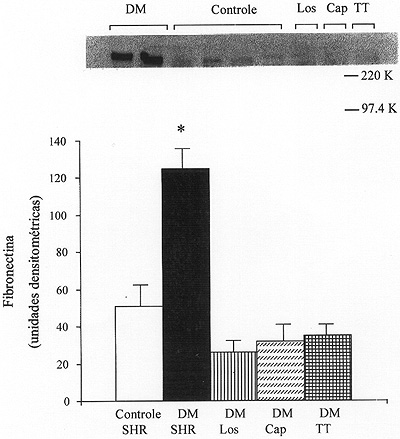
Figura 4. Fibronectina em rim de ratos espontaneamente hipertensos (SHR). (A) Detecção imunológica (Western blot) para fibronectina em 90 µg de proteína extraída de córtex renal de ratos individuais (DM = SHR DM, Controle = SHR controle, Los = DM + losartan, Cap = DM + captopril, TT (DM + terapia tríplice (hidroclorotiazída, hidralazina e reserpina). (B) Análises densitométricas de fibronectina em rins de ratos SHR controles (n = 12), SHR DM (n= 10), DM + losartan (DM + Los) (n = 9), DM + Captopril (DM + Cap (n = 8), e DM + tríplice (DM + TT) (n = 10). * p<0,0001 SHR DM vs. todos os outros grupos na semana 16. Dados obtidos da referência 24 com modificações.
A hipertrofia renal e glomerular é um fenomeno frequente e envolvido na patogênese da ND, tanto em humanos como em modelos experimentais.26,27 Tem sido sugerido que essa hipertrofia se deve aos efeitos da hiperglicemia no ciclo celular promovendo aumento de inibidores da replicação celular, chamados inibidores de Cdk ("cyclin-dependent kinase"), e desvio do ciclo celular da replicação para hipertrofia.26,28 Recentemente, investigamos se a genética da hipertensão arterial modificava a reposta induzida pela hiperglicemia na replicação de células renais e reguladores do ciclo celular. Neste último estudo, demonstramos que a indução do DM em ratos SHR, antes do desenvolvimento da hipertensão arterial, promovia maior hipertrofia renal (tabela 1), redução na replicação de células renais (figuras 5 e 6) e aumento de um inibidor do ciclo celular o p27Kip1 (figuras 7).29 A expressão glomerular de um outro inibidor do ciclo celular o p21Cip1 assim como o número de células em apoptose eram semelhantes nos ratos SHR e WKY diabéticos.29 Essas alterações que têm sido implicadas na patogênese da nefropatia diabética26,28,30,31 não estavam presentes nos ratos geneticamente normotensos (WKY) diabéticos. Portanto, é possível que essas anormalidades possam estar envolvidas nos mecanismos responsáveis pela maior suscetibilidade à nefropatia em indivíduos diabéticos com predisposição à hipertensão arterial.
Tabela1
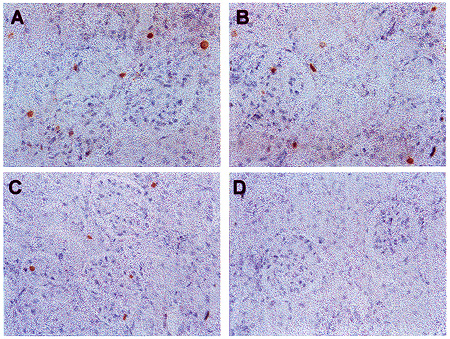
Figura 5. Identificação por imunohistoquímica das células positivas para BrdU (pontos acastanhados) em cortes histológicos de rim. Não houve diferença no número de células em replicação entre os ratos WKY controles (A) e diabéticos (B) e SHR controles (C), entretanto o número de células em replicação foi significativamente reduzido nos ratos SHR diabéticos (D). Aumento de 400 x, contracorado com hematoxilina. Dados obtidos da referência 29 com modificações.
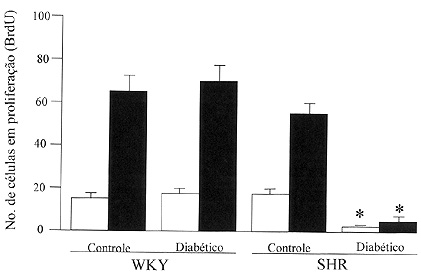
Figura 6. Número de células em proliferação determinadas por coloração com BrdU (bromodeoxiuridina) em glomérulo ( )e região túbulo-intersticial ( ) em ratos WKY e SHR controles e diabéticos. As células positivas foram contadas em 50 glomérulos ou em 50 campos de 0,02 mm2 na região túbulo-intersticial. * p = 0,0002 vs. outros grupos. Dados obtidos da referência 29 com modificações.
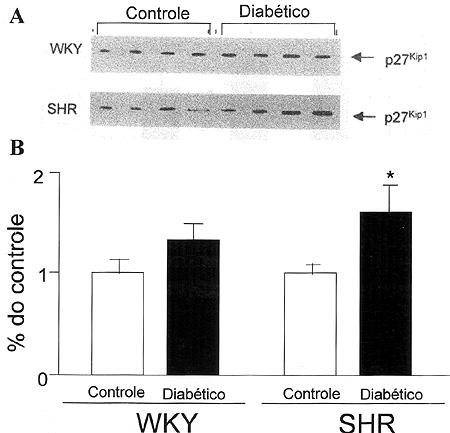
Figura 7. Expressão glomerular de p27Kip1 de ratos espontaneamente hipertensos (SHR) e controles geneticamente normotensos (WKY) controles e diabéticos. (A) Western blot para p27Kip1. (B) Representação gráfica da densitometria das bandas imunoreativas. * p < 0,05 vs. SHR controle. Dados obtidos da referência 29 com modificações.Em conjunto nosso resultados corroboram a hipótese de que a predisposição à hipertensão arterial participa da suscetibilidade à nefropatia diabética. Além disso, sugerem possíveis mecanismos celulares e moleculares envolvidos nesse processo. Esses mecanismos poderão orientar a idenficação precoce dos 35% de indivíduos diabéticos que irão desenvolver nefropatia diabética assim como possibilitar a intervenção precoce nestes indivíduos. Entre as várias alternativas, uma poderia ser a prevenção do desenvolvimento da hipertensão arterial.Agradecimentos Os trabalhos apresentados foram realizados com suporte financeiro da Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP), Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES).