QUIMIOEMBOLIZACION DEL CANCER ORAL: ANALISIS DE 100 PACIENTES CONSECUTIVOS
(especial para SIIC © Derechos reservados)
Recepción del artículo: 17 de febrero, 2004
Aprobación: 0 de , 0000
 Conclusión breve
La quimioembolización superselectiva de los carcinomas de la cavidad oral con una suspensión de cristales de cisplatino tuvo alta efectividad y baja toxicidad aguda sistémica, con una excelente aceptación por parte del paciente.
Conclusión breve
La quimioembolización superselectiva de los carcinomas de la cavidad oral con una suspensión de cristales de cisplatino tuvo alta efectividad y baja toxicidad aguda sistémica, con una excelente aceptación por parte del paciente.
 Resumen
La quimioembolización para el cáncer de cabeza y cuello es un desafío. Debido a las características y riesgos locales fue utilizada raramente en el pasado. La combinación de actividad antineoplásica y efecto embolizante en el mismo fármaco puede hacer posible su uso rutinario. Se preparó una suspensión de cisplatino en solución salina normal (5 mg en 1 ml) con precipitación de cristales de cisplatino microembolizantes. La dosis de cisplatino fue de 150 mg/m2, dosis máxima absoluta 300 mg, máxima cantidad de líquido 60 ml. Se trataron cien pacientes consecutivos con carcinomas de células escamosas de la cavidad oral y orofaringe anterior, sin tratamientos previos con terapia neoadyuvante, con quimioembolización superselectiva con la suspensión de cisplatino. La aceptación fue excelente. La respuesta conjunta (remisión completa más remisión parcial) después de un ciclo fue del 73% con 18.5% de remisión completa anatomopatológica. La toxicidad sistémica aguda cuantificable fue muy baja (grado I de OMS). El síndrome posembolización, especialmente tumefacción, se pesquisó cuidadosamente. Hubo 3.5% de complicaciones relacionadas con la intervención y 9% locales. Estas complicaciones pudieron reducirse significativamente cuando se efectuó la quimioembolización sólo en las neoplasias de la lengua, piso de la boca y borde alveolar mandibular. En conclusión, con este método es posible llevar a cabo la quimioembolización en el área de la cabeza y cuello en forma segura y de rutina, con elevada eficacia. Las dosis altas y bajas de cisplatino sistémico pueden ser confirmadas farmacológicamente. Es necesario la realización de mayores investigaciones para valorar el control local y la sobrevida.
Resumen
La quimioembolización para el cáncer de cabeza y cuello es un desafío. Debido a las características y riesgos locales fue utilizada raramente en el pasado. La combinación de actividad antineoplásica y efecto embolizante en el mismo fármaco puede hacer posible su uso rutinario. Se preparó una suspensión de cisplatino en solución salina normal (5 mg en 1 ml) con precipitación de cristales de cisplatino microembolizantes. La dosis de cisplatino fue de 150 mg/m2, dosis máxima absoluta 300 mg, máxima cantidad de líquido 60 ml. Se trataron cien pacientes consecutivos con carcinomas de células escamosas de la cavidad oral y orofaringe anterior, sin tratamientos previos con terapia neoadyuvante, con quimioembolización superselectiva con la suspensión de cisplatino. La aceptación fue excelente. La respuesta conjunta (remisión completa más remisión parcial) después de un ciclo fue del 73% con 18.5% de remisión completa anatomopatológica. La toxicidad sistémica aguda cuantificable fue muy baja (grado I de OMS). El síndrome posembolización, especialmente tumefacción, se pesquisó cuidadosamente. Hubo 3.5% de complicaciones relacionadas con la intervención y 9% locales. Estas complicaciones pudieron reducirse significativamente cuando se efectuó la quimioembolización sólo en las neoplasias de la lengua, piso de la boca y borde alveolar mandibular. En conclusión, con este método es posible llevar a cabo la quimioembolización en el área de la cabeza y cuello en forma segura y de rutina, con elevada eficacia. Las dosis altas y bajas de cisplatino sistémico pueden ser confirmadas farmacológicamente. Es necesario la realización de mayores investigaciones para valorar el control local y la sobrevida.
 Palabras clave
Quimioembolización, cáncer de cabeza y cuello, terapia neoadyuvante con cisplatino
Clasificación en siicsalud
Palabras clave
Quimioembolización, cáncer de cabeza y cuello, terapia neoadyuvante con cisplatino
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/66834
Especialidades
 Principal: Oncología,
Principal: Oncología,
 Relacionadas: Anatomía Patológica, Cirugía, Diagnóstico por Imágenes, Medicina Interna, Odontología, Oncología,
Relacionadas: Anatomía Patológica, Cirugía, Diagnóstico por Imágenes, Medicina Interna, Odontología, Oncología,
 Enviar correspondencia a:
Enviar correspondencia a:
Dr. Adorján F. Kovács. Uniklinik Haus 21, Theodor-Stern-Kai 7, D – 60590 Frankfurt am Main, Germany.
CHEMOEMBOLIZATION OF ORAL CANCER-ANALYSIS OF 100 CONSECUTIVE PATIENTS
 Abstract
Abstract
Chemoembolization for cancer in the head and neck is a challenge. Due to local characteristics and risks, it was used very rarely in the past. By the combination of antineoplastic activity and embolizing effect in the same pharmacon, a routine usage seemed to be possible. A cisplatin suspension in normal saline (5 mg in 1 ml) with precipitation of microembolizing cisplatin crystals and without additional pharmacons was prepared. Cisplatin dosage was 150 mg/m2, maximum absolute dose 300 mg, maximum amount of fluid 60 ml. Hundred consecutive patients with previously untreated squamous cell carcinomas of the oral cavity and the anterior oropharynx could be treated in a neoadjuvant setting with superselective chemoembolization using the cisplatin suspension. Compliance has been excellent. Overall response (CR + PR) after one cycle has been 73%, with 18.5% pathological complete remissions. Measurable acute systemic toxicity has been very low (grade I WHO). Post-embolization syndrome, especially swelling, had to be observed carefully. There have been 3.5% interventional and 9% local complications. These complications could be significantly reduced when chemoembolization was executed only in cancers of the oral tongue, the floor of the mouth, and the mandibular alveolar ridge. As a conclusion, chemoembolization in the head and neck area can be carried out routinely and safely using this method, and is highly effective. High local and low systemic cisplatin dose could be confirmed pharmacologically. Further investigation is mandatory to assess potential in local control and survival.
 Key words
Key words
Chemoembolization, head and neck cancer, cisplatin, neoadjuvant therapy
QUIMIOEMBOLIZACION DEL CANCER ORAL: ANALISIS DE 100 PACIENTES CONSECUTIVOS
(especial para SIIC © Derechos reservados)
Artículo completo
Introducción
La quimioembolización se utiliza con elevada eficacia principalmente en el carcinoma hepatocelular y las metástasis hepáticas del cáncer colorrectal1. El fundamento es el aumento en la ventaja regional mediante la disminución o cese del flujo sanguíneo con microcápsulas2 o agentes embolizantes,3 lo que produce mayor tiempo de permanencia tumoral, mejora en el efecto de primer paso de la droga y también necrosis hipóxica. La embolización con microcápsulas de drogas o mezclas de drogas y agentes embolizantes es posible y segura debido a que los vasos hepáticos tienen un diámetro bastante grande, alto flujo y las metástasis y el tejido hepático están alimentados por diferentes sistemas circulatorios con bajo riesgo de exposición del tejido sano.4 Además de la desventaja de la producción técnica complicada de agentes embolizantes, hay obstáculos extremos en lo que concierne a la aplicación de este método de detención temporaria completa del flujo sanguíneo en el área de la cabeza y cuello: necrosis local intolerable y daño ocular y de los ganglios nerviosos vía anastomosis. Debido a estos hechos, el uso de quimioembolización fue ocasional en la región de cabeza y cuello hasta la fecha.
Aun sin agentes embolizantes, la quimioterapia local, aunque utilizada por décadas, también tiene muchas desventajas en el área de cabeza y cuello, principalmente por las complicaciones del catéter y los efectos adversos secundarios a la extravasación de los agentes antineoplásicos.5 Un 11% de fracasos en la cateterización (principalmente retrógradas desde la arteria temporal a la arteria carótida externa), 8% de dislocaciones del catéter, 15% de inflamaciones locales y 4% a 6% de complicaciones neurológicas como cefaleas, apoplejías, paresias faciales, tornan la quimioterapia intraarterial poco atrayente. Teóricamente, como se demostró en modelos animales,6 el método tiene no obstante la gran ventaja de lograr concentraciones más altas de las drogas en los tumores. El cisplatino demostró ser el agente más efectivo,7 permite la perfusión rápida debido a su relativa falta de especificidad de fase celular. Robbins y col. traspusieron la denominada "quimioterapia de dos rutas" (cisplatino intraarterial y su neutralización sistémica con tiosulfato de sodio endovenoso) de su uso abdominal a la región de cabeza y cuello.8 El empleo de técnicas modernas más sofisticadas como la cateterización transfemoral con sistemas de catéteres pequeños, control angiográfico y administración superselectiva de altas dosis de cisplatino (150 mg/m2 de superficie corporal), combinadas con la neutralización periférica, redujo las complicaciones y los efectos adversos. Gracias a estos métodos, se incrementan el aclaramiento plasmático y el objetivo de la droga. Los compartimientos sensibles, como hueso, médula ósea, intestino y riñones, están protegidos de los efectos tóxicos de la droga. Dado que las arterias lingual y facial son vasos pequeños tienen un flujo bajo (casi 120 ml/min), lo cual aumenta además el blanco de la droga. El enfoque terapéutico fue la preservación del órgano (combinada con radioterapia paralela) o paliativo.
La alta efectividad y la baja toxicidad aguda sistémica comunicadas de la quimioterapia local intraarterial instan al uso más amplio de este método, especialmente si se considera la elevada mortalidad por cánceres de cabeza y cuello, provocada principalmente por recaídas locales. De este modo, una modalidad terapéutica que se concentre en el problema local suscita gran interés en esta patología. Desde 1996, la quimioterapia intraarterial se utilizó ampliamente (más de 250 pacientes) en el marco de la terapia neoadyuvante preoperatoria en el Departamento de Cirugía Plástica Maxilofacial de Frankfurt am Main, Alemania.9-13 La toxicidad sistémica y local pudieron reducirse a casi cero.
Desde el año 2000 se introdujo un formato de dosificación de cisplatino que combina las ventajas descritas más arriba (altas dosis, quimioembolización, elevada respuesta, baja toxicidad, uso de antagonista) sin las desventajas.12-15 En este artículo se presentan los resultados clínicos y experimentales de esta novel terapéutica, que llevó a la utilización de rutina de la quimioembolización en cien pacientes consecutivos con cáncer de cabeza y cuello.
Pacientes y métodos
Pacientes y diseño del estudio
Se reclutaron en forma prospectiva 100 pacientes con diagnóstico confirmado histológicamente de carcinoma de células escamosas primario, no tratado previamente, de cavidad oral y orofaringe anterior para el tratamiento con quimioembolización intraarterial neoadyuvante (relación hombres/mujeres: 69/31; edad media: 60.5 años; criterios de respuesta de acuerdo con el Eastern Cooperative Oncology Group [ECOG]:16 0 en 41, 1 en 44, 2 en 15 individuos; grados II en 90 y grado III en 10 casos). Se determinó la distribución del tamaño tumoral clínico (cT), la clasificación de ganglios linfáticos regionales clínicos (cN), y estadios clínicos (cST) de acuerdo con el UICC: clasificación de tumores malignos (TNM)17 (figuras 1 a 3). Los sitios de ubicación de los tumores fueron: el piso de la boca (40%), la lengua (27%), el paladar blando (13%), la encía del proceso alveolar mandibular (12%), el sulcus vestibular inferior (4%), el trígono retromolar (2%) y la encía maxilar y labio (cada sitio, 1%). El 43% de estos tumores involucraban la línea media. Los exámenes para la estadificación incluyeron la historia del paciente, inspección, palpación, ecografía y tomografía computada del cuello, radiografía de tórax y tomografía por emisión de positrones (PET) de cuerpo entero; esta última fue decisiva para la estadificación del cuello. Se obtuvieron la aprobación ética por el comité de ética local y el consentimiento informado antes del inicio de la quimioterapia y otros procedimientos terapéuticos (cirugía, quimiorradiación). El único criterio de exclusión fue la presentación de insuficiencia renal grave.
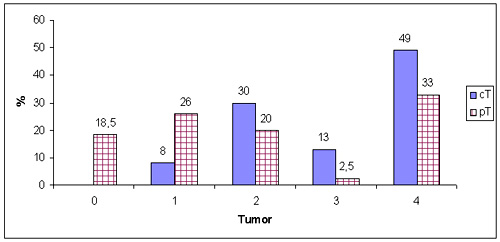
Figura 1. Clasificación tumoral clínica (cT) y anatomopatológica (pT) en 100 pacientes tratados con quimioembolización y 81 pacientes operados.

Figura 2. Clasificación regional ganglionar clínica (cN) y anatomopatológica (pN) en 100 pacientes tratados con quimioembolización y 81 pacientes operados.

Figura 3. Estadificación clínica (cStage = estadio c) y anatomopatológica (pStage = estadio p) en 100 pacientes tratados con quimioembolización y 81 pacientes operados.
Preparación de una suspensión acuosa de cristales de cisplatino para la aplicación intraarterialEl cisplatino (Medac GmbH, Hamburgo, Alemania) está disponible en ampollas monodosis que contienen un polvo liofilizado blanco amarillento estéril con 50 mg de cisplatino (fármaco), 450 mg de cloruro de sodio, 500 mg de manitol y ácido clorhídrico (adyuvantes). La dosis individual para los pacientes fue de 150 mg/m2.18 La superficie corporal se calculó por la fórmula empírica de Du Bois,19 limitada a un valor de 2 m2 referido a 300 mg de cisplatino. Las suspensiones de cisplatino se prepararon en forma individual en un área de preparación centralizada para drogas citotóxicas en el Departamento de Farmacia de Johann Wolfgang Goethe University Medical School, en condiciones asépticas mediante un banco de trabajo de flujo laminar vertical (de acuerdo con DIN 12950) así como un software para controlar la preparación por el peso (Cypro 2.0 ars pharmaceutica Gesellschaft für klinisches Wissenschaftsmanagement und Softwarelösungen mbH, Hamburgo, Alemania). La droga liofilizada se reconstituyó con cloruro de sodio al 0.9% (Isotone Kochsalzlösung, Braun Melsungen, AG, Melsungen, Alemania) produciéndose una mezcla amarilla de 10 ml con una concentración final de 5 mg/ml. La mezcla se agitó hasta que el polvo quedó suspendido sin partículas macroscópicamente visibles. La suspensión del número de ampollas necesarias se transfirió con una cánula (18 G) en dos jeringas estériles descartables de 50 ml (Perfusion Pastipak, Becton Dickinson, Heidelberg, Alemania). Las jeringas se cubrieron para protegerlas de la luz. Si bien los datos fisicoquímicos de las soluciones de cisplatino indican una estabilidad de hasta 28 días,20 se decidió establecer el tiempo máximo de expiración en 8 horas a temperatura ambiente para limitar la producción de cristales no reproducibles. Las jeringas listas para utilizar se etiquetaron con el nombre del paciente, dosis, día de administración, tiempo de expiración y la nota "por favor, agítese antes de usar".
Características farmacológicos de la suspensión acuosa de cristales de cisplatino
El método de preparación dio como resultado un monocomponente, una suspensión acuosa sumamente concentrada de cisplatino con precipitación de cristales. Las propiedades fisicoquímicas (por ejemplo distancias PtPt, análisis de vibración molecular) de los cristales de cisplatino que se forman en soluciones congeladas, se describieron previamente.21 La estabilidad del complejo de cisplatino está farmacológicamente asegurada en una suspensión debido a que el cloruro de sodio es utilizado en una elevada concentración en este tipo de dosificación. El líquido resultante es una solución con cloruro de sodio al 5.4%. Se ha informado que las soluciones hipertónicas de cloruro de sodio no tienen efecto sobre la farmacocinética del cisplatino.22 Se supuso que la osmolalidad fue mayor que la de una solución acuosa (casi 285 mOsm/kg),23 pero no pudo medirse debido a la presencia de precipitados cristalinos. La osmolalidad teórica de la suspensión descrita se calculó en aproximadamente 2 130 mOsm/kg. La valoración microscópica de los diámetros de las partículas en la suspensión acuosa de cristales de cisplatino mostró cristales en forma de varilla de 3 x 8 μg, la aglutinación regular de estos cristales formó partículas de 30 x 50 μg. La relación partículas pequeñas a grandes fue 100/1. En las soluciones donde se formaron precipitados, la redisolución se produjo muy lentamente con el calentamiento a temperatura ambiente.24 A 40ºC, el tiempo de redisolución fue de casi 20 a 30 minutos.25
Tratamiento de quimioembolización
En el primer día de intervención, los pacientes recibieron 74 mg de dolasetron y 500 mg de prednisolona endovenosa por la mañana. Subsecuentemente se administró 1.5 litro de una solución hidroelectrolítica (con 20 mEq de cloruro de potasio) en infusión endovenosa en un período de 2 horas. Luego se realizó la cateterización transcutánea de la arteria femoral derecha con un catéter de 4 french que contenía un microcatéter coaxial. Se efectuó la visualización superselectiva del vaso de alimentación del tumor y se valoró su capacidad en volumen mediante radioscopia con un medio de contraste. No fue necesario llevar a cabo prueba de provocación debido a que la angiografía en estas áreas proporciona generalmente suficiente información. Posteriormente se infundieron 150 mg/m2 de cisplatino (dosis máxima absoluta 300 mg, dosis mínima 225 mg), suspendido como se mencionó anteriormente (máxima cantidad de líquido, 60 ml; cantidad mínima, 40 ml), con presión controlada por medio de una jeringa manual. En todos los casos, la estasis del flujo dentro de los capilares periféricos del tumor pudo evidenciarse mediante radioscopia. Para la analgesia se administraron 0.1 a 0.4 ml de fentanilo y 1 a 2.5 mg de droperidol en forma endovenosa antes del inicio de la terapia. En casos de odontalgias, principalmente observadas durante la perfusión de la arteria maxilar, la aplicación de una inyección de 1 ml de una dilución 1:10 de lidocaína-HCL al 1% en la arteria perfundida fue capaz de bloquear el dolor. Con una demora de 10 segundos, se administró en paralelo una infusión endovenosa de 9 g/m2 de tiosulfato de sodio. La aplicación de la suspensión de cisplatino se completó un máximo de 3 horas después de la preparación. Posteriormente se infundieron nuevamente 1 000 ml de solución hidroelectrolítica con 20 mEq de cloruro de potasio (forma endovenosa, 5 horas luego del tratamiento). Se repitió la administración de 500 mg de prednisolona endovenosa al final de la tarde, con una repetición ulterior por un máximo de 3 días de acuerdo con la tumefacción local. El día posterior a la intervención los pacientes fueron hiperhidratados con 3 000 ml de una solución con dos tercios de electrolitos, recibieron profilaxis para trombosis con heparina subcutánea (y dolasetron endovenoso si fue necesario); se indicó analgesia de rutina con goteo de metamizol. Se efectuaron análisis de laboratorio de rutina en días alternos y se compararon con los valores pretratamiento. Se registraron los efectos adversos de los ciclos acorde con la OMS26 y se decidió suspender el estudio en caso de toxicidad de grados III o IV; se planeó al menos un ciclo. Tres semanas después, se evaluó la magnitud de la respuesta local por medio de la valoración clínica (inspección y palpación) y tomográfica (CR = remisión completa, desaparición completa de la masa tumoral local; PR = remisión parcial, resolución parcial de la masa tumoral local en más del 50%; SD = enfermedad estable, reducción parcial de la masa tumoral local en menos del 50% o estabilidad de ésta; PD = enfermedad progresiva, crecimiento del tumor en más del 25%) y se programó la cirugía.
Debido a que la cirugía se consideró una importante modalidad terapéutica, no necesariamente se pretendió la remisión completa. Las repeticiones regulares de ciclos para lograr este objetivo parecen provocar demasiada presión a los pacientes que deben someterse a tratamientos multimodales. Los individuos se enrolaron para la cirugía si estaban en condiciones de recibir anestesia o la resección no amenazaba órganos vitales. Esta valoración se realizó antes del comienzo de cualquier terapia. Los pacientes que no fueron tratados con cirugía recibieron radiación o quimioterapia. La cirugía se realizó de acuerdo con las reglas generalmente aceptadas (resección radical del tumor primario con márgenes sanos, disección cervical radical modificada ipsilateral [MRND] con preservación de la vena yugular, el músculo esternocleidomastoideo y el nervio accesorio en caso de cuello clínicamente positivo, disección cervical suprahioidea selectiva contraleteral [SHND] de los dos niveles superiores del cuello en caso de localización tumoral en la línea media). Los pacientes con clasificación cN0 fueron sometidos a disección del ganglio centinela (SND). El tratamiento adyuvante posquirúrgico consistió en radiación o quimiorradiación sobre la base del resultado histológico, contraindicaciones para docetaxel y acuerdo del paciente; el régimen preciso se describió en otro lado.11 A los individuos que no pudieron ser operados se les ofreció quimiorradiación con preservación de órgano (71.3 Gy para el tumor primario, 51.3 Gy para el cuello, 5 ciclos de docetaxel a 20 mg/m2 de superficie corporal) o radiación (si había contraindicaciones para el docetaxel).
Durante este estudio se planificó lograr una base farmacológica racional para la quimioterapia intraarterial en seres humanos. Las concentraciones tumorales y plasmáticas de cisplatino y tiosulfato de sodio se compararon por medio de microdiálisis27 en 10 y 6 pacientes con cáncer oral tratados con una perfusión intraarterial de solución de cisplatino (150 mg/m2 en 500 ml de ClNa al 0.9%) o con quimioembolización con una suspensión de cisplatino cristalino (150 mg/m2 en 45-60 ml de ClNa al 0.9%), respectivamente. El catéter para microdiálisis se colocó en el tumor por medio de la vía submentoniana y el catéter intraarterial en la arteria de alimentación del tumor. El cisplatino se administró rápidamente a través del catéter intraarterial y el tiosulfato de sodio (9 g/m2) en forma endovenosa. La infusión de tiosulfato de sodio (STS) comenzó 10 segundos después de la infusión de cisplatino. La principal ventaja del método es la medición continua. No fue necesaria la realización de biopsias. Puede obtenerse más información en el artículo de Tegeder y col.28
Los criterios de valoración principal fueron la remisión clínica e histológica y los efectos adversos de la quimioembolización. El final del seguimiento fue en diciembre de 2003.
Resultados
Aceptación
Todos los pacientes (100%) recibieron un ciclo completo de quimioembolización intraarterial. La aceptación de la terapia fue excelente. La duración de la inyección al final de la intervención neurorradiológica fue de entre 60 y 90 segundos. La tolerancia de la quimioperfusión fue buena y la dosis de analgésicos fue suficiente, aunque los pacientes comunicaron una sensación de dolor quemante corto en el área embolizada. En 12 enfermos, los ciclos se repitieron una vez cuando el tumor no fue operable. Las arterias preferidas para la cateterización superselectiva fueron las linguales y faciales (tabla 1). En la arteria maxilar, se evitó la embolización de la arteria meníngea media. Esto se logró por la colocación cuidadosa del microcatéter distalmente a la bifurcación.

Tabla 1. Arterias utilizadas para la cateterización superselectiva y quimioembolización.
Complicaciones de la intervención
Se realizaron 112 intervenciones con 4 complicaciones relacionadas con la intervención (3.5%). Dos pacientes sufrieron apoplejías causadas probablemente por la movilización de placas ateroscleróticas por el catéter. El tratamiento lítico inmediato produjo remisiones completas después de varios días en ambos casos. Hubo dos complicaciones asociadas con la venopuntura femoral transcutánea: 6 días después de la intervención, un paciente presentó un hematoma escrotal que fue tratado en forma conservadora y experimentó la reabsorción luego de 15 días; un enfermo mostró signos de embolismo de la pierna izquierda el día de la intervención; desde hace tres años tiene una prótesis aortofemoral y el tratamiento con heparina fue rápidamente efectivo.
Respuesta
Las remisiones clínicas locales después de un ciclo de quimioembolización intraarterial se pueden observar en la figura 4. La respuesta global (CR + PR) después de un ciclo fue del 73%. La figura 1 muestra la efectividad del método, especialmente en los tumores T1-T3. En los tumores T4, la respuesta fue limitada por el compromiso óseo. Se logró un 18.5% de remisiones completas anatomopatológicas después de un ciclo. Muchos de los tumores pT1 simplemente mostraron pequeños nidos tumorales siguientes a la quimioembolización. La figura 2 evidencia la superselectividad del método: la clasificación ganglionar no cambió luego de la quimioembolización. La figura 3 evidencia el concepto de "estadios menores". Debido a la efectividad local de la quimioembolización, principalmente los estadios menores tuvieron un beneficio cuantificable, mientras que los estadios que dependían de la clasificación ganglionar (3 y 4) no cambiaron demasiado. Sin embargo, esta consideración, se refiere sólo a los cambios detectables por exámenes clínicos e histológicos.

Figura 4. Respuesta clínica en 100 pacientes luego de un ciclo de quimioembolización. CR = remisión completa, PR = remisión parcial, SD = enfermedad estable, PD = enfermedad progresiva.
Toxicidad aguda
La muy baja toxicidad sistémica aguda de la quimioembolización (principalmente grado 1 de la OMS) se muestra en la figura 5. Se observó leve hiperglucemia hasta 140 mg/dl que desapareció luego de 6 días. Los síntomas locales de dolor y tumefacción combinados con leucocitosis afebril (hasta 19 000 glóbulos blancos/mm3) fueron similares al conocido "síndrome posembolización". La tumefacción de la mejilla y la lengua fue blanda y desapareció después de 10 días. Ante la aparición de deterioro en la deglución, se aseguró la nutrición enteral mediante una sonda gástrica. El dolor moderado (grado II) se trató con goteos de metamizol y tramadol y la superinfección dolorosa de las áreas epidermolíticas tumefactas de la mucosa oral con un antibiótico oral (clindamicina) durante 5 días. La leucocitosis no recibió tratamiento y se normalizó luego de 10 días. La estadía en guardia fue de entre 3 y 17 días (media 9 días) lo cual fue necesario para el financiamiento del proceso de intervención bajo las condiciones de regulación hospitalaria de Alemania. Se aconseja una observación en guardia de 3 días debido a que la tumefacción alcanza su pico en ese momento. El control ambulatorio fue posible generalmente después de ese lapso.

Figura 5. Toxicidad aguda medida en 100 pacientes luego de un ciclo de quimioembolización.Referencias: post-embolization syndrome = síndrome posembolización; leukocytosis = leucocitosis; pain = dolor; acute toxicity = toxicidad aguda; no toxicity = no toxicidad; nausea = náuseas; serum creatinine = creatinina sérica; hyperuremia = hiperuremia; hepatic enzymes = enzimas hepáticas; bilirubine = bilirrubina; LDH = LDH; hypokalaemia = hipokalemia; hyperglycaemia = hiperglucemia; serum ferrum = hierro sérico; hyperuricemia = hiperuricemia; anemia = anemia; leukopenia = leucopenia; thrombocytopenia = trombocitopenia; high tone hypacousia = hipoacusia para tonos altos; regional alopecia = alopecía regional.
Complicaciones locales
Hubo 10 complicaciones locales (9%). En los primeros 49 pacientes con 58 intervenciones de quimioembolización, se encontraron 3 parálisis temporales del nervio facial y 4 necrosis cutáneas faciales (áreas de la mejilla y mentón) ambas debido a la desembocadura de los cristales de cisplatino en la arteria meníngea media (desde la arteria maxilar) o de las colaterales cutáneas de los vasos de alimentación del tumor. La recuperación de la función del nervio tomó 3 meses con pequeñas secuelas de la rama frontal. La necrosis cutánea no produjo daño a los pacientes porque las áreas de la piel debieron ser resecadas durante la cirugía con márgenes sanos de seguridad. La extravasación puede esperarse en los tumores de trígono retromolar, paladar blando y maxilar, en los cuales es necesaria la cateterización de la arteria maxilar. Entre otras complicaciones se mencionan dos traqueotomías debido a tumefacción extrema de la región facial inferior, lengua y cuello al segundo día luego de la quimioembolización; el tubo se removió después de 3 días sin dificultades ni secuelas.
En los siguientes 51 pacientes con 54 intervenciones no se produjeron complicaciones excepto una traqueostomía en una mujer muy obesa con tumefacción moderada submentoniana que fue suficiente como para provocar disnea. En estos enfermos, la quimioembolización se llevó a cabo exclusivamente en tumores de la lengua, piso de la boca, y borde alveolar mandibular, donde se comprobó la seguridad de la quimioembolización (figura 6). Esto significa que la tasa de complicaciones pudo ser reducida de un 15% en la primera mitad de los pacientes a un 2% en la segunda mitad.

Figura 6. Areas de uso seguro para la quimioembolización: lengua, piso de la boca, borde alveolar mandibular (amarillo).
Tratamientos ulteriores y resultados preliminares
Ochenta y uno por ciento de los pacientes fueron operados en forma radical. Las resecciones radicales y las complicaciones posoperatorias no fueron influidas por la quimioterapia preoperatoria. En la figura 7 se muestran los tipos de cirugía del cuello. No fue posible operar al 19% de los enfermos debido a la no resecabilidad de los tumores primarios o a las malas condiciones generales de salud. Seis pacientes presentaron un estado general inicial tan malo que sólo se repitió el tratamiento para el control local, mientras que 13 enfermos que no fueron sometidos a cirugía estuvieron en condiciones de recibir radiación o quimiorradiación. Treinta y cuatro pacientes operados no recibieron terapia adyuvante luego de la cirugía (pequeños tumores primarios, sin evidencia histológica de enfermedad en el cuello, denegación); 47 se sometieron a radiación adyuvante (n = 15) o quimiorradiación adyuvante (n = 32). Los primeros resultados de la quimioradiación adyuvante ya fueron comunicados.11
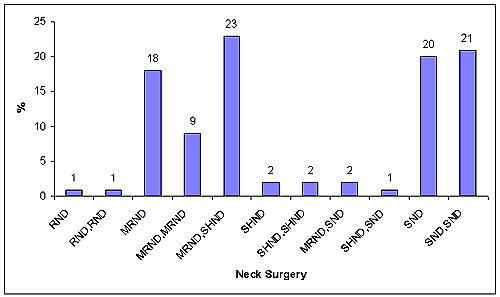
Figura 7. Distribución de la cirugía de cuello en 81 pacientes tratados con quimioembolización. RND = disección cervical (ND) radical, MRND = ND radical tipo III modificada, SHND = ND suprahioidea, SND = disección del ganglio centinela; MRND, SHND = MRND ipsilateral y SHND contralateral y así sucesivamente.
En el período entre mayo de 2000 y diciembre de 2003, fallecieron 36 pacientes (36%), 12 muertes no se relacionaron con la neoplasia. Se produjeron 13 recaídas locales, 3 regionales y 7 a distancia.
Concentración de cisplatino
Luego de la embolización, las áreas bajo la curva (AUC) en el tumor y las concentraciones tumorales máximas del cisplatino fueron casi 5 veces mayores que las alcanzadas después de la perfusión intraarterial con la solución de cisplatino (concentración máxima 180.3 ± 62.3 μM versus 37.6 ± 8.9 μM) mientras que lo opuesto ocurrió para las concentraciones plasmáticas (concentración máxima 0.9 ± 0.2 μM versus 4.7 ± 0.6 μM). Los niveles plasmáticos de tiosulfato fueron casi 3 veces mayores que sus concentraciones tumorales (concentración tumoral máxima 1 685 ± 151 μM, concentración plasmática máxima 5 051 ± 381 μM). Después de la perfusión intraarterial estándar, los índices promedio tiosulfato de sodio/AUC cisplatino para el tumor y plasma fueron 211 ± 75 y 984 ± 139, respectivamente. Luego de la embolización de cisplatino, los índices respectivos fueron 48.5 ± 29.5 y 42 966 ± 26 728.28
Discusión
La quimioembolización para el cáncer de la cavidad oral y orofaringe es un desafío pero a su vez constituye una modalidad terapéutica altamente efectiva. Es obvio que cualquier agente embolizante puede ser extremadamente peligroso en esta localización. Las anastomosis de la arteria oftálmica y de las arterias de alimentación de las estructuras nerviosas no deben ser ocluidas, ni siquiera durante corto tiempo. Aun la oclusión completa por períodos cortos de vasos como las arterias lingual o facial tiene el riesgo de necrosis de tejidos importantes como la lengua y la mejilla, lo cual es intolerable y doloroso. La tumefacción de la base de la lengua puede provocar sofocación. Además, la cantidad de agente embolizante no puede ser completamente valorada antes de la infusión ya que el diámetro exacto de los vasos y capilares perfundidos se desconoce y la administración debe continuarse hasta que se consiga la oclusión. En las áreas de cabeza y cuello, el objetivo de la oclusión completa debe lograrse muy cuidadosamente.
Hay razones por las cuales la quimioembolización fue utilizada raramente en el pasado. Los informes de otros investigadores se muestran en la tabla 2. La fabricación de partículas y el encapsulamiento de las drogas en estos casos fue complicado y oneroso. Las bajas dosis de agentes antineoplásicos fueron consecuencia del pequeño diámetro de los vasos de la cabeza que fueron ocluidos demasiado pronto. El riesgo de extravasación de émbolos provocó que los investigadores cesaran el uso luego de un pequeño número de pacientes. De acuerdo con las referencias bibliográficas, sólo 77 enfermos con cáncer de cabeza y cuello fueron tratados con regímenes de embolización en los últimos 20 años en todo el mundo. La efectividad no fue convincente. Los efectos adversos fueron ignorados en estos informes hasta ahora.

Tabla 2. Lista de otros informes sobre quimioembolizaciones para el cáncer de cabeza y cuello. Nótense las bajas dosis de drogas, las pequeñas poblaciones de pacientes y la limitación o ausencia de comunicaciones sobre los efectos adversos. El trabajo de Song y col. en China, no tiene más información disponible.
El nuevo método de quimioembolización por medio de una suspensión de cristales de cisplatino se utilizó rutinariamente en 100 pacientes desde mayo 2000 hasta la fecha. Fue muy efectivo (las remisiones se evaluaron en un ciclo), los efectos sistémicos fueron bajos y las complicaciones locales tempranas cesaron después de restringir las indicaciones a las áreas dentro de la cavidad oral. Las áreas cubrieron más del 60% de los carcinomas de la cavidad oral, lo que garantiza un amplio uso de este método. El empleo es útil en estas circunstancias.
¿Qué es lo novedoso de este método Hasta la fecha, la embolización se logró con drogas encapsuladas (microcápsulas)2 o con la liberación concomitante de sustancias embolizantes tales como alcohol polivinílico, lipiodol, albúmina, microesferas de almidón degradables con mezclas, algunas veces, de diversas drogas.1,36,37 Estos protocolos presentan ciertas ventajas: las microcápsulas brindan buena reproducibilidad del producto con buen control del diámetro de las partículas y un tiempo ajustado farmacológicamente de liberación de la droga. Las sustancias embolizantes ocluyen los vasos de alimentación del tumor por un cierto período de tiempo y detienen el flujo intratumoral antes de que se disuelvan. Las ventajas compiten con graves desventajas: la producción de las microcápsulas es un proceso complicado y costoso, que a menudo requiere un 900% más de material para la cobertura que de droga. El paciente es sometido a la presión de recibir sustancias adicionales, lo que también es una desventaja de la combinación de diversas drogas (poliquimioterapia) justificado principalmente en el tratamiento paliativo. En el caso de sustancias auxiliares (puede ser una suspensión viscosa como lipiodol o micropartículas diferentes más grandes) también existe el problema de la producción que implica mayores costos, tiempo y esfuerzo. Por el contrario, la nueva técnica presentada tiene muchas ventajas. Provee un monocomponente (cisplatino disponible como lo elabora el productor) que sirve como agente microembolizante por sí mismo. Esta nueva forma de dosificación del cisplatino (suspensión de cristales) combinó tanto los efectos antineoplásicos como embolizantes en un solo agente.15 Para la preparación de la infusión de una solución de cisplatino el fabricante recomienda la dilución de la dosis del cisplatino a su concentración máxima de 1 mg/ml.20 A concentraciones mayores a 1 mg/ml se produce la precipitación del cisplatino (suspensión). El cisplatino liofilizado se reconstituyó con cloruro de sodio al 0.9%, lo que produjo una mezcla amarillenta con una concentración final de 5 mg/ml. La valoración microscópica de los diámetros de los cristales mostró cristales de cisplatino en forma de varilla de 3 x 8 μm, su aglutinación formó partículas de 30 x 50 μm, tamaño ideal para los vasos de cabeza y cuello. No fue necesaria la embolización extra de partículas como microesferas de almidón degradables. La tasa de respuesta del tumor y los resultados farmacológicos son factores indicadores claros del mejor efecto logrado comparado con el empleo de una solución. Puede considerarse que la razón para esta tasa de respuesta no sólo es la mayor concentración de la droga en suspensión sino la presunta disolución intratumoral más lenta de los cristales.
Es obligatoria la administración superselectiva del agente en los vasos de alimentación del tumor. Los vasos más grandes normalmente no pueden ocluirse debido a los diámetros de las partículas. No sólo la respuesta es mejor sino que la toxicidad aguda es más baja. Esto puede deberse a las siguientes razones. Es probable que las mayores concentraciones intratumorales sean consecuencia de un mayor efecto de primer paso o de atrapamiento. El detalle técnico contribuye a los hallazgos favorables de mayor respuesta y menor toxicidad sistémica. La liberación intraarterial de una pequeña cantidad de líquido (máximo 60 ml de la suspensión acuosa de cisplatino) mediante una jeringa manual permite un mejor manejo del tiempo con consideración de la infusión endovenosa paralela de tiosulfato de sodio. En cambio, la gran cantidad de líquido empleada para la solución de cisplatino (500 ml) algunas veces lleva al espasmo del vaso y la interrupción de la perfusión. La duración de la administración fue más prolongada (5 minutos), las bombas utilizadas brindaron un flujo estandarizado pero fueron difíciles de manejar. Actualmente, la capacidad del vaso puede valorarse mediante la inyección inicial de solución salina controlada manualmente, seguida por la inyección de la suspensión con la misma presión. La inyección puede administrarse rápidamente en menos de 2 minutos sin reflujo de sangre y posiblemente de tiosulfato de sodio; es posible lograr un flujo adecuado con la exposición total del lecho tumoral al cisplatino. El tiosulfato de sodio alcanzó la periferia cuando el cisplatino llegó ahí.
Los efectos adversos locales pudieron ser superados fácilmente y sin problemas por los cuidados de rutina maxilofaciales. No obstante, es importante aclarar que el método es peligroso si es utilizado en áreas perfundidas por la arteria maxilar. Las complicaciones locales tales como parálisis facial y necrosis pueden evitarse si el método es usado en las áreas seguras mostradas en la figura 6. En los casos donde pueden esperarse tales complicaciones debe emplearse en su lugar la solución de cisplatino que no tiene efecto embolizante. Lo mismo es valedero para los pacientes obesos.
Por ahora, no hay quimioterapias disponibles con agentes múltiples que tengan tasas de respuesta locales altas después de un ciclo y similares tasas bajas de efectos adversos agudos. La aceptación global fue excelente. La quimioterapia intraarterial como tratamiento adyuvante encaja perfectamente dentro de un régimen multimodal.11 A diferencia de otras modalidades terapéuticas como la electroporación, la terapia fotodinámica o las inyecciones de geles quimioterapéuticos, la quimioterapia intraarterial puede ser utilizada en todos los estadios tumorales sin efectos adversos limitantes.
Se requieren índices molares de tiosulfato de sodio/cisplatino mayores de 500 fuera del tumor para neutralizar el cisplatino, mientras que los índices dentro del tumor deben ser menores de 100 para evitar una pérdida de destrucción de las células neoplásicas.38,39 Ambas metas pueden lograrse con la embolización con cisplatino. Esto brinda una base racional definitiva para la quimioembolización con una suspensión de cristales de cisplatino en seres humanos. Son necesarias más investigaciones para valorar su potencial en el control local y la sobrevida.
Los autores no manifiestan conflictos.
 Bibliografía del artículo
Bibliografía del artículo
- Tellez C, Benson AB, Lyster MT, et al. Phase II trial of chemoembolization for the treatment of metastatic colorectal carcinoma to the liver and review of the literature. Cancer 1998;82:1250-1259.
- Kato T, Sato K, Sasaki R, et al. Targeted cancer chemotherapy with arterial microcapsule chemoembolization: review of 1013 patients. Cancer Chemother Pharmacol 1996;37:289-296.
- Araki T, Hihara T, Kachi K, et al. Newly developed transarterial chemoembolization material: CDDP-lipiodol suspension. Gastrointest Radiol 1989;14:46-48.
- Breedis C, Young G. The blood supply of neoplasms of the liver. Am J Pathol 1954;30:969-985.
- Molinari R, Chiesa F, Cantù G, et al. Prognostic factors in cancer of the oral cavity and anterior oropharynx treated with preliminary neoadjuvant intra-arterial chemotherapy followed by surgery. In Eckardt A (ed). Intra-arterial Chemotherapy in Head and Neck Cancer – Current Results and Future Perspectives. Reinbek: Einhorn-Presse Verlag, 1999. pp 148-161.
- Harker GJS, Stephens FO. Comparison of intra-arterial versus intravenous 5-fluorouracil in sheep bearing epidermal squamous carcinoma. Eur J Cancer 1992;28:1437-1441.
- Harker GJS. Intra-arterial infusion chemotherapy in a sheep squamous cell carcinoma model. In Eckardt A (ed). Intra-arterial Chemotherapy in Head and Neck Cancer – Current Results and Future Perspectives. Reinbek: Einhorn-Presse Verlag, 1999. pp 54-63.
- Robbins KT, Storniolo AM, Kerber C, et al. Rapid superselective high-dose cisplatin infusion for advanced head and neck malignancies. Head Neck 1992;14:364-371.
- Kovács AF, Turowski B, Ghahremani TM, et al. Intra-arterial Chemotherapy as neoadjuvant treatment of oral cancer. J Cranio-Maxillofac Surg 1999;27:302 - 307.
- Kovács AF, Schiemann M, Turowski B. Introduction of a new complex 4-modality treatment for oral and oropharyngeal cancer. In Roodenburg JLN, Varma AK (eds). Oral Oncology Volume VII. New Delhi: Macmillan India Ltd, 2001. pp. 237-239.
- Kovács AF, Schiemann M, Turowski B. Combined modality treatment of oral and oropharyngeal cancer including neoadjuvant intraarterial cisplatin and radical surgery followed by concurrent radiation and chemotherapy with weekly docetaxel - three year results of a pilot study. J Cranio-Maxillofac Surg 2002;30:112-120.
- Kovács AF. Intraarterial chemotherapy and chemoembolization in head and neck cancer. Establishment as a neoadjuvant routine method. Cancer Therapy 2003;1;1-9.
- Kovács AF. Mundhöhlen- und Oropharynxkarzinome. Neue Mittel und Wege der Therapie. Norderstedt: Books on Demand GmbH, 2003.
- Kovács AF, Turowski B. Chemoembolization of oral and oropharyngeal cancer using a high-dose cisplatin crystal suspension and degradable starch microspheres. Oral Oncology 2002;38:87-95.
- Kovács AF, Obitz P, Wagner M. Monocomponent chemoembolization in oral and oropharyngeal cancer using an aqueous crystal suspension of cisplatin. Br J Cancer 2002;86:196-202.
- Oken MM, Creech RH, Tormey DC, et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol 1982;5:649-655.
- Sobin LH, Wittekind C (eds). UICC: TNM Classification of Malignant Tumours New York: John Wiley & Sons, Inc., 1997.
- Robbins KT, Storniolo AM, Kerber C, et al. Phase I study of highly selective supradose cisplatin infusions for advanced head and neck cancer. J Clin Oncol 1994;12:2113-2120.
- Du Bois D, Du Bois EF. A formula to estimate the approximate surface area if height and weight be known. Arch Intern Med 1916;17: 863-871.
- Trissel LA. Handbook on injectable drugs 10th edn. Bethesda, Maryland: American Society of Health-System Pharmacists' Product Development, 1998. p 310.
- Milburn GHW, Truter MR. The crystal structures of cis- and transdichlorodiammineplatinum (II). Inorg Phys Theor J Chem Soc (A) 1966;11:1609-1616.
- medac (ed). Fachinformation medac Cisplatin medac. Hamburg: medac, 2000. p 5.
- McEvoy GK (ed). American hospital formulary service drug information 91. Bethesda, Maryland: American Society of Hospital Pharmacists, 1991.
- Greene RF, Chatterji DC, Hiranaka PK, et al. Stability of cisplatin in aqueous solution. Am J Hosp Pharm 1979;36:38-43.
- Kristjansson F, Sternson LA, Lindenbaum S. An investigation on possible oligomer formation in pharmaceutical formulations of cisplatin. Int J Pharm 1988;41:67-74.
- Miller AB, Hoogstraaten B, Staquet M, et al. Reporting results of cancer treatment. Cancer 1981;47:207-214.
- Ungerstedt U. Microdialysis--principles and applications for studies in animals and man. J Intern Med 1991;230:365-373.
- Tegeder I, Bräutigam L, Seegel M, et al. Cisplatin tumor concentrations after intra-arterial cisplatin infusion or embolization in patients with oral cancer. Clinical Pharmacology & Therapeutics 2003;73:417-426.
- Okamoto Y, Konno A, Togawa K, et al. Microcapsule chemoembolization for head and neck cancer. Arch Otorhinolaryngol 1985;242:105-111.
- Okamoto Y, Konno A, Togawa K, et al. Arterial chemoembolization with cisplatin microcapsules. Br J Cancer 1986;53:369-375.
- Tomura N, Kobayashi M, Hirano J, et al. Chemoembolization of head and neck cancer with carboplatine microcapsules. Acta Radiol 1996 ;37:52-56.
- Tomura N, Kato K, Hirano H, et al. Chemoembolization of maxillary tumors via the superficial temporal artery using a coaxial catheter system. Radiat Med 1998;16:157-160.
- Li H, Wang C, Wen Y, et al. Treatment of squamous cell carcinoma of the tongue using arterial embolism with cisplatin-loaded albumin microspheres: a microstructural and ultrastructural investigation. Chin J Dent Res 1999;2:61-66.
- Suvorova IuV, Tarazov PG, Korytova LI, et al. [Arterial chemoembolization in the combined treatment of malignant tumors of the tongue and maxilla: preliminary results] Vestn Rentgenol Radiol 2002;2:23-28.
- Song M, Chen FJ, Zeng ZY, et al. [Clinical value of inducing chemotherapy for patients with advanced tongue cancer]. Ai Zheng. 2002;21:68-70.
- Vogl TJ, Trapp M, Schroeder H, et al. Transarterial chemoembolization for hepatocellular carcinoma: volumetric and morphologic CT criteria for assessment of prognosis and therapeutic success – results from a liver transplantation center. Radiology 2000;214:349-357.
- Yamamoto K, Shimizu T, Narabayashi I. Intraarterial infusion chemotherapy with lipiodol-CDDP suspension for hepatocellular carcinoma. Cardiovasc Intervent Radiol 2000;23:26-39.
- Abe R, Akiyoshi T, Tsuji H, et al. Protection of antiproliferative effect of cis-diamminedichloroplatinum (II) by sodium thiosulfate. Cancer Chemother Pharmacol 1986;18:98-100.
- Abe R, Akiyoshi T, Baba T. Inactivation of cis-diamminedichloroplatinum (II) in blood by sodium thiosulfate. Oncology 1990;47:65-69.
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC





 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a:







