




 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: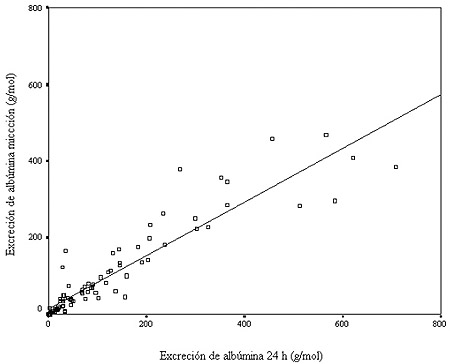
Figura 1. Comparación entre las excreciones de albúmina (g/mol creatinina) en orina de 24 horas y de una micción en varones.
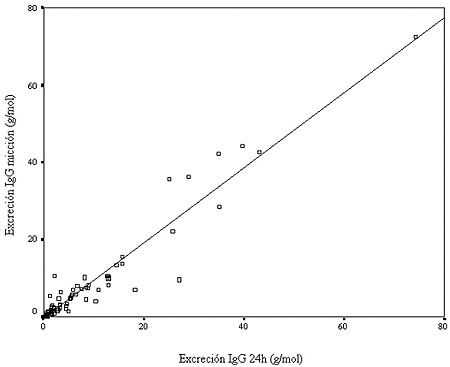
Figura 2. Comparación entre las excreciones de IgG (g/mol creatinina) en orina de 24 horas y de una micción en varones.
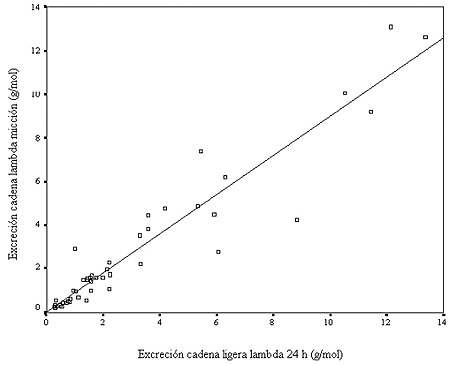
Figura 3. Comparación entre las excreciones de cadena ligera lambda (g/mol creatinina) en orina de 24 horas y de una micción en varones.

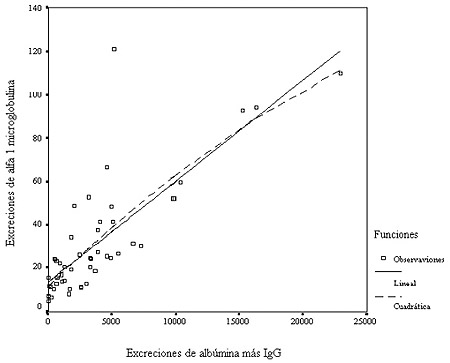
Figura 4. Excreciones de α1-microglobulina (mg/24 horas) por sobrecarga tubular en pacientes sin daño histológico tubular (n = 50).Finalmente, queda el punto de quizá más difícil resolución: la estimación de la selectividad de proteinuria glomerular. Con los procedimientos electroforéticos, mucho menos sensibles que los inmunoquímicos para estimar proteínas específicas, se admitía que una proteinuria era de tipo glomerular no selectivo cuando, además de la banda de la albúmina, aparecía el barrido producido por la gammaglobulina, principalmente IgG. La cuantificación inmunoquímica de proteínas específicas seguramente provocará un replanteo conceptual sobre la selectividad de una proteinuria.20 Hasta ahora, un incremento de la excreción de albúmina se asociaba con la pérdida de la selectividad de carga de la membrana glomerular y un incremento de proteínas de mayor masa molar, fundamentalmente IgG, se relaciona con una pérdida de la selectividad de tamaño.21 La medición de proteínas específicas en orina ha objetivado que el incremento de la excreción de albúmina va asociado a un incremento en la excreción de IgG,22 posiblemente secundaria a una reorganización de la matriz proteica de la membrana basal. La pérdida de cargas negativas en la membrana glomerular produciría una reorganización de la matriz que favorecería el paso de moléculas de mayor tamaño.23 Así pues, quizás haya que replantearse el concepto de la selectividad de tamaño de una proteinuria y definir a partir de qué excreción de IgG se considera que el glomérulo ha perdido la selectividad de tamaño, o utilizar otras alternativas.24,25 Existen múltiples propuestas de estudio de la selectividad de la proteinuria,24-26 todo ello fruto de la ausencia de una referencia irrefutable. En la tabla 2 se muestran los rangos de selectividad de una proteinuria (expresada con % de IgG con respecto a la albúmina) que se observaron en nuestros pacientes con diferentes diagnósticos anatomopatológicos y sin lesiones morfológicas tubulointersticiales. Resulta difícil atribuir a las diversas entidades anatomopatológicas distintos grados de pérdida de selectividad de tamaño de la membrana glomerular por el importante solapamiento que existe entre ellas. El porcentaje de IgG/albúmina del 26.5% en las nefropatías por cambios mínimos corresponde al paciente descrito anteriormente con frecuentes moldes hialinos intratubulares y que, quizá, tenga lesión tubular, funcional o morfológica, no evidenciada en el estudio anatomopatológico. Hay que tener presente que un daño tubular proximal produce incrementos de las excreciones de las proteínas que normalmente se reabsorben a este nivel y, por tanto, de la albúmina e IgG. Así pues, se debe descartar una alteración funcional o morfológica tubular para poder estudiar la selectividad de tamaño del glomérulo y clasificar una proteinuria glomerular como no selectiva.3