LA L-ASPARAGINASA ACTUA COMO AGREGANTE PLAQUETARIO EN LA LEUCEMIA LINFOBLASTICA AGUDA DE LA INFANCIA
(especial para SIIC © Derechos reservados)
Coautor
David Gómez-Almaguer.*
Académico Profesor de Hematología. Facultad de Medicina y Hospital Universitario "Dr. José E. González" de la Universidad Autónoma de Nuevo León, Monterrey, México*
Recepción del artículo: 5 de marzo, 2004
Aprobación: 0 de , 0000
 Conclusión breve
La L-asparaginasa actúa como agonista plaquetario in vitro y podría conducir a un estado de hiperreactividad plaquetaria, que en conjunto con la disminución de anticoagulantes naturales podría desencadenar el estado hipercoagulable en la leucemia linfoblástica aguda.
Conclusión breve
La L-asparaginasa actúa como agonista plaquetario in vitro y podría conducir a un estado de hiperreactividad plaquetaria, que en conjunto con la disminución de anticoagulantes naturales podría desencadenar el estado hipercoagulable en la leucemia linfoblástica aguda.
 Resumen
Antecedentes. La leucemia linfoblástica aguda (LLA) constituye el 30% de los cánceres en la infancia. La enzima L-asparaginasa se incluye en todos los esquemas de tratamiento, pero su administración puede acompañarse de complicaciones tromboembólicas graves. Diversos estudios documentaron una disminución de las proteínas anticoagulantes C, S y antitrombina III (ATIII). En esta investigación postulamos la posibilidad de que la L-asparaginasa tenga un efecto agonista plaquetario que contribuya al estado hipercoagulable en la LLA. Pacientes y métodos. Se estudiaron quince pacientes menores de 12 años con el diagnóstico de LLA de la infancia, sometidos a un protocolo que incluyó la administración de L-asparaginasa, 10 000 U/m2/6 semanas. El grupo control fue integrado por 15 individuos sanos con tiempo de sangrado y cuenta plaquetaria normales. Se efectuó agregometría plaquetaria utilizando varias concentraciones de L-asparaginasa, junto con los agonistas ADP, adrenalina, colágeno y ristocetina. Resultados. La agregometría demostró un efecto proagregante de la L-asparaginasa en plaquetas de pacientes con LLA y en las de voluntarios normales. Conclusión. La L-asparaginasa actúa como agonista plaquetario in vitro y podría conducir a un estado de hiperreactividad plaquetaria, que en conjunto con la disminución de anticoagulantes naturales podría desencadenar el estado hipercoagulable en la LLA.
Resumen
Antecedentes. La leucemia linfoblástica aguda (LLA) constituye el 30% de los cánceres en la infancia. La enzima L-asparaginasa se incluye en todos los esquemas de tratamiento, pero su administración puede acompañarse de complicaciones tromboembólicas graves. Diversos estudios documentaron una disminución de las proteínas anticoagulantes C, S y antitrombina III (ATIII). En esta investigación postulamos la posibilidad de que la L-asparaginasa tenga un efecto agonista plaquetario que contribuya al estado hipercoagulable en la LLA. Pacientes y métodos. Se estudiaron quince pacientes menores de 12 años con el diagnóstico de LLA de la infancia, sometidos a un protocolo que incluyó la administración de L-asparaginasa, 10 000 U/m2/6 semanas. El grupo control fue integrado por 15 individuos sanos con tiempo de sangrado y cuenta plaquetaria normales. Se efectuó agregometría plaquetaria utilizando varias concentraciones de L-asparaginasa, junto con los agonistas ADP, adrenalina, colágeno y ristocetina. Resultados. La agregometría demostró un efecto proagregante de la L-asparaginasa en plaquetas de pacientes con LLA y en las de voluntarios normales. Conclusión. La L-asparaginasa actúa como agonista plaquetario in vitro y podría conducir a un estado de hiperreactividad plaquetaria, que en conjunto con la disminución de anticoagulantes naturales podría desencadenar el estado hipercoagulable en la LLA.
 Palabras clave
Agregometría plaquetaria; L-asparaginasa, leucemia linfoblástica aguda; trombosis en le
Clasificación en siicsalud
Palabras clave
Agregometría plaquetaria; L-asparaginasa, leucemia linfoblástica aguda; trombosis en le
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/67148
Especialidades
 Principal: Hematología, Oncología,
Principal: Hematología, Oncología,
 Relacionadas: Farmacología, Medicina Interna, Pediatría,
Relacionadas: Farmacología, Medicina Interna, Pediatría,
 Enviar correspondencia a:
Enviar correspondencia a:
Dr. Med. José Carlos Jaime Pérez. Edificio "Dr. Rodrigo Barragán Villarreal", 2° piso, Avenida Madero y Gonzalitos, Colonia Mitras Centro, CP: 64460. Monterrey, Nuevo León, México Jaime-Pérez, José Carlos
 Patrocinio y reconocimiento
Patrocinio y reconocimiento
Investigación apoyada por el Consejo Nacional de Ciencia y Tecnología (CONACYT, México), proyecto # 30930-M.
 Abstract
Abstract
Background and objectives. Acute lymphoblastic leukemia (ALL) accounts for 30% of all childhood malignancies. The enzyme L-asparaginase (L-aspar) constitutes a fundamental component of modern chemotherapeutic regimens for the treatment of ALL. Its administration however, can be associated with severe thromboembolic complications. Diverse studies have documented a decrease in the natural anticoagulant proteins C, S and antithrombin III (ATIII) in children receiving the enzyme. We postulate the hypothesis that L-asparaginase could have a platelet agonist effect, thus contributing to the hipercoagulable state observed in ALL. Patients and methods. Fifteen children under thirteen years of age with a new diagnosis of ALL were included. The treatment protocol included L-asparaginase, 6 000 UI/m2, twice a week per 6 weeks. Platelet aggregometry included adenosin diphosphate, adrenaline, collagen and ristocetin. Saline dilutions of L-asparaginase were assayed as additional agonists. The control group consisted of 15 normal donors. Results. Platelet aggregometry documented a direct in vitro agonist effect of L-asparaginase on platelets from children with ALL as well as on those of normal donors. Conclusion. L-asparaginase can act as a potent platelet agonist in vitro. This effect could be one additional procoagulant factor and could contribute to the prothrombotic state observed in ALL.
 Key words
Key words
Acute lymphoblastic leukemia; childhood leuke
LA L-ASPARAGINASA ACTUA COMO AGREGANTE PLAQUETARIO EN LA LEUCEMIA LINFOBLASTICA AGUDA DE LA INFANCIA
(especial para SIIC © Derechos reservados)
Artículo completo
Introducción
La leucemia linfoblástica aguda (LLA) es el cáncer mas común en la infancia. Con una frecuencia de 3.3 casos por cada 100 000 niños, constituye el 30% de todos los cánceres en esa edad.1 La variedad más frecuente es la que se origina en los linfocitos B, que comprende casi el 90% de los casos.1 Con tratamiento óptimo la tasa de curación esta aproximándose al 80% en los países con mayor desarrollo en sus sistemas de salud.2 La L-asparaginasa es parte fundamental del tratamiento, se la incluye en diversas dosis en todos los esquemas terapéuticos.3,4 Su uso intensivo ha resultado en mejores tasas de respuesta,5,6 aunque puede acompañarse de formación de anticuerpos anti-asparaginasa7 y de reacciones de hipersensibilidad, que pueden o no implicar el desarrollo de resistencia al efecto de la enzima,8 pero que obligan a cambiar a una asparaginasa de origen diferente a la de E. coli, como la obtenida de Erwinia carotobora.
La administración de L-asparaginasa puede acompañarse, además, de eventos tromboembólicos graves, los cuales se presentan con una incidencia del 2.4% al 36.7%.9,10 Diversos estudios documentaron una disminución del fibrinógeno y de las proteínas anticoagulantes C, S y antitrombina III (ATIII) en niños que reciben tratamiento para la LLA.11,12 Recientemente se identificaron mutaciones en estas proteínas, así como en la protrombina y el factor V.9 Sin embargo éstas tienen la prevalencia esperada en la población, por lo que por sí mismas no explican los eventos tromboembólicos, de lo que se deduce la existencia de factores procoagulantes adicionales relacionados al tratamiento, factores ambientales o manbos.9,12 En esta investigación postulamos la hipótesis de que la L-asparaginasa tiene un efecto agonista plaquetario, que podría contribuir al estado hipercoagulable y al riesgo de desencadenar eventos trombóticos en niños con LLA.
Pacientes y métodos
En el estudio se siguieron los principios establecidos en la Declaración de Helsinki y se obtuvo el consentimiento informado de ambos padres. El protocolo fue aprobado por el Comité de Etica de la institución. Se estudiaron veinte pacientes menores de 12 años con el diagnóstico de LLA de la infancia de riesgo estándar, sometidos a un protocolo de inducción de la remisión que incluyó vincristina, 1.4 mg/m2/i.v., prednisona, 60 mg/m2/día/v.o., y L-asparaginasa 6 000 U/m2 / 2 veces por semana. El grupo control incluyó 15 individuos sanos, no fumadores, sin ingestión de anti-inflamatorios no esteroides y con tiempo de sangrado y cuenta de plaquetas normales.
En los pacientes los estudios de agregometría plaquetaria se realizaron durante la fase de inducción de la remisión, cuando se habían recibido al menos cuatro dosis de L-asparaginasa y la cuenta de plaquetas era > 100x109/l, utilizando un método publicado previamente.13 Se empleó un agregómetro óptico automatizado (Chronolog modelo 530VS, Haverton, PA, EE.UU.) que lleva a cabo la integración del proceso por medio de una interfase y software específicos (Aggrolink, Haverton, PA, EE.UU.).
Se obtuvieron 20 ml de sangre venosa, descartando los primeros 5 ml, sin aplicación de torniquete o utilizando éste con una compresión ligera, en tubos de plástico conteniendo citrato de sodio al 3.8%, en una relación 1:9 v/v. La muestra se obtuvo dentro de las 24 horas posteriores a la administración de la cuarta dosis de L-asparaginasa, cuya vida media es de 26 horas.14 Las plaquetas se obtuvieron preparando un plasma rico en plaquetas a 135 g por 15 minutos a temperatura ambiente. Durante una segunda centrifugación a 1 500 g por 15 minutos se obtuvo el plasma pobre en plaquetas para emplearlo en la dilución y ajuste de la muestra a una cuenta de 250 000 plaquetas x 109/l, y para establecer la lectura basal de agregación en 0%. Se estudiaron las respuestas a 37°C a 1 000 revoluciones por minuto (rpm) a los siguientes agonistas:13 ristocetina, 1.5 mg/ml, adenosin difosfato (ADP) 10 μM, epinefrina 10 μM y colágeno 2.5 μg/ml. Diluciones salinas de L-asparaginasa (Leunase, Kyowa Hakko Kogyo Co. Ltd, Tokio, Japón) en concentraciones de 2 500, 5 000, y 10 000 unidades en solución fisiológica al 0.9%, con un pH de 7.3, fueron empleadas como agonistas en ensayos independientes. Se agregó cada agonista en un volumen de 50 μl a una cubeta conteniendo 450 μl de la muestra y se procedió al ensayo; cada ensayo incluyó un control de voluntarios normales. El resultado, expresado como porcentaje de agregación, se analizó en la gráfica correspondiente. Se procedió a comparar las diferentes curvas generadas.
Resultados
Las características clínicas e iniciales de laboratorio de los niños con LLA, expresados como la mediana y el rango, incluyeron las siguientes: edad: 6.0 años (2-13); hemoglobina: 62 g/l (48-89); leucocitos totales: 23 200 por microlitro (948-105 000); plaquetas: 31 300 por microlitro (1 170-259 000); albúmina: 3.5 g/l (2.4-4.8); proteínas totales: 6.5 g/l (5.9-7.5); inmunoglobulina G sérica: 945 mg/dl (400-1 209). La agregometría demostró un claro efecto proagregante de la L-asparaginasa, tanto en plaquetas de pacientes con LLA en fase de inducción (figura 1), como en las de voluntarios normales (no mostrada). El porcentaje de agregación con las diluciones de la L-asparaginasa varió de 28% con una concentración de 2 500 UI, 52% cuando se empleó la concentración de 5 000 UI (figura 1), hasta un 100%, en el caso de la dilución de 10 000 UI, presentándose como una potente onda de agregación primaria en menos de un minuto del ensayo. El porcentaje de desagregación fue menor al 5% a los 7 minutos de registro. Se apreció una correlación entre la concentración de la L-asparaginasa y el porcentaje de agregación plaquetaria en ambos grupos. No se detectaron diferencias en la agregometría entre las plaquetas de individuos sanos y de pacientes con LLA, ni con agonistas usuales ni con las diferentes concentraciones de L-asparaginasa; en la figura 2 se muestra el resultado normal de la agregometría efectuada en el mismo paciente utilizando colágeno, 2.5 microgramos por ml.

Figura 1. Agregación plaquetaria (52%) determinada en plasma rico en plaquetas de un paciente con leucemia aguda linfoblástica de la infancia, después de estimulación con una dilución de L-asparaginasa de 5 000 UI/ml. Es de notarse la velocidad acelerada de la reacción durante los primeros segundos, progresando después lentamente hasta alcanzar una fase de meseta ligeramente superior al 50% de la agregación.
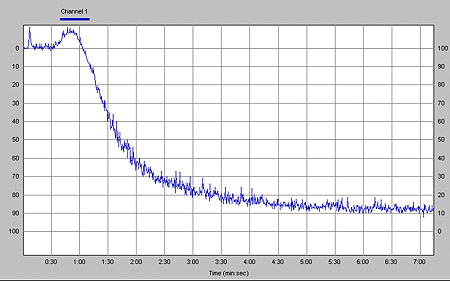
Figura 2. Agregación plaquetaria (90%) determinada en plasma rico en plaquetas por agregometría óptica en el mismo paciente de la figura 1, después de estimulación con un reactivo estándar de colágeno, 2.5 μg/ml.
Uno de los pacientes, una niña de 4 años, desarrolló trombosis en el hemisferio cerebral derecho, documentada por tomografía axial computarizada, después de la administración de la tercera dosis de L-asparaginasa, cuando su cuenta plaquetaria era de solamente 20x109/l. Su patrón de respuesta en la agregometría resultó similar al de los otros pacientes, con respuesta de agregación in vitro al estímulo de la L-asparaginasa.
Discusión
La disminución de las proteínas anticoagulantes C, S y ATIII ha sido reconocida como una de las causas principales del estado hipercoagulable en niños con LLA.9 Dicho estado puede conducir a eventos trombóticos graves y se cree que es el resultado de la quimioterapia administrada,11 y de otros factores todavía no identificados.9 Como ejemplo, en un estudio reciente se encontró una asociación entre el desarrollo de eventos tromboembólicos y la aparición de anticuerpos antifosfolípidos, más que con la presencia de los factores protrombóticos hereditarios previamente citados.10 La naturaleza inherentemente compleja de este estado de desequilibrio hemostático en la LLA, así como los múltiples factores que pueden influir en el desencadenamiento de eventos trombóticos, ha sido recientemente revisada, contemplándose la posible participación de, entre otros, la liberación de micropartículas celulares conteniendo factor tisular activado, así como la inducción de formación de trombos secundaria a infección bacteriana.15
La L-asparaginasa en dosis elevadas forma parte integral del tratamiento exitoso de la LLA de la infancia y se la ha relacionado con el estado hipercoagulable durante la fase de inducción de la remisión16 y con el desarrollo de anticuerpos específicos y reacciones de hipersensibilidad17 que obligan a utilizar una asparaginasa de origen diferente del de E. coli,8 un protocolo de desensibilización o ambas medidas.18 La L-asparaginasa ha sido estudiada con relación al desarrollo del estado hipercoagulable de la LLA en asociación con la disminución de las proteínas C, S y ATIII. Sin embargo, la L-asparaginasa no ha sido, hasta donde sabemos, estudiada o involucrada en la activación de la fase plaquetaria de la coagulación ni empleada como agonista en estudios de los efectos proagregantes de otros agentes.
En este estudio se demostró claramente que la L-asparaginasa puede actuar como un potente agonista plaquetario in vitro, en forma proporcional a su concentración, lo mismo en plaquetas de niños con LLA que en las de individuos sanos, libres de patología plaquetaria. Aunque este efecto proagregante no ha sido documentado in vivo, su administración podría ser uno de los factores protrombóticos no identificados relacionados con el tratamiento, y cuya existencia se sugirió en estudios previos.9 En conjunto con la disminución de las proteínas anticoagulantes naturales, un efecto proagregante de la enzima podría contribuir al estado hipercoagulable observado en la fase inicial del tratamiento de la LLA.11Recientemente se informó que el alcaloide de la vinca, vincristina, utilizado junto con la L-asparaginasa en la fase de inducción de la remisión de la LLA, es capaz de inducir apoptosis in vivo de células mononucleares malignas, con un índice apoptótico de hasta 40%.19 La apoptosis participa en un numeroso grupo de fenómenos biológicos, entre ellos, de manera notable, la trombogénesis, probablemente a través de la activación del factor tisular,20 se sabe que la interacción de las plaquetas con las células mononucleares en otras enfermedades, como el lupus eritematoso sistémico, acelera la producción del factor tisular por los monocitos activados,21 algo similar podría suceder por medio de la interacción entre plaquetas y linfoblastos apoptóticos. La formación de estos complejos heterotípicos circulantes, que podrían contribuir al estado hipercoagulable, ha sido documentada entre plaquetas y neutrófilos,22 y entre plaquetas y células mononucleares,23 por lo que cabe la posibilidad de su formación entre plaquetas y linfoblastos leucémicos.
Es posible que un estado de agregación plaquetaria aumentada debido a un efecto proagregante asociado con la administración de L-asparaginasa, como se documentó in vitro en este estudio, en combinación con la disminución en la síntesis de las proteínas anticoagulantes naturales C, S y ATIII, aunada a los fenómenos apoptóticos procoagulantes secundarios a la utilización de vincristina, ayude a explicar de manera más completa el desencadenamiento de fenómenos trombóticos en la fase de inducción de la remisión de la LLA de la infancia. Es también evidente, a la luz de éstos y otros hallazgos, que diferentes protocolos para el tratamiento de la LLA pueden conducir a diferentes tasas de tromboembolismo,9,10 probablemente debido a diferencias en las dosis, esquemas y rutas de administración de los agentes quimioterapéuticos. A este respecto, las combinaciones de los diferentes agentes utilizados, particularmente cuado se emplea prednisona en sustitución de la dexametasona durante la fase de inducción de la remisión, puede conducir a diferencias dramáticas en la incidencia de eventos trombóticos.24 Una agregometría plaquetaria ha sido previamente sugerida en pacientes con trastornos mieloproliferativos y eventos trombóticos25 y podría estar indicada, utilizando diluciones de la L-asparaginasa como agonista adicional, para identificar el subgrupo de niños en riesgo de sufrir eventos trombóticos, con el fin de evaluar la administración de anticoagulantes de manera profiláctica, como se ha propuesto para el uso de la heparina de bajo peso molecular en aquellos pacientes en los que se identifica una disminución significativa de proteínas anticoagulantes C, S y ATIII.9 Adicionalmente, debe estudiarse la posibilidad de que la enzima contribuya de manera directa a la deficiencia de estas proteínas, ya que se ha documentado la disminución de la actividad de diversas proteínas involucradas en el control de la coagulación después de breves intervalos de incubación del plasma con diversas concentraciones de L-asparaginasa.26
Los autores no manifiestan conflictos
 Bibliografía del artículo
Bibliografía del artículo
- Pui CH. Acute lymphoblastic leukemia, in Williams Hematology, 6th ed, Beutler E, Lichtman M, Coller B, and Selighson U (eds), p 1141-1161. McGraw Hill, New York, 2001.
- Greaves M. Science, Medicine and the Future. Childhood leukemia. Br Med J 2002;324:283-7.
- Felix CA, Lange BJ, Chessells JM. Pediatric acute lymphoblastic leukemia. Hematology 2000;**:285-302.
- Richards S, Burrett J, Hann I, Chessells J, Hill F, Bailey C. Improved survival with early intensification: combined results from the Medical Research Council childhood ALL randomized trials, UKALL X and UKALL XI. Medical Research Working Party on Childhood Leukemia. Leukemia 1998;12:1031-1036.
- Nachman JB, Sather HN, Sensel MG, Triggh ME, Cherlow JM, Lukens JN. Augmented post-induction therapy for children with high-risk acute lymphoblastic leukemia and a slow response to initial therapy. N Eng J Med 1998;338:1663-1671.
- Amylon MD, Shuster J, Berard C, Link MP, Wharam M. Intensive high-dose asparaginase consolidation improves survival for pediatric patients with T cell acute lymphoblastic leukemia and advanced stage lymphoblastic lymphoma: a Pediatric Oncology Group study. Leukemia 1999;13:335-342.
- Woo MH, Hak LJ, Storm MC, Sandlund JT, Rivera GK, et al. Anti-asparaginase antibodies following E. coli asparaginase therapy in children with acute lymphoblastic leukemia. Leukemia 1998;12:1257-1533.
- Larson RA, Fretzin MH, Dodge RK, Schiffer CA. Hypersensitivity reactions to L-asparaginase do not impact on the remission duration of adults with acute lymphoblastic leukemia . Leukemia 1998;12:660-665.
- Nowak-Gotti U, Wermes C, Junker R, Koch HG, Schobess R, Fleischhack G. Prospective evaluation of the thrombotic risk in children with acute lymphoblastic leukemia carrying the MTHFR TT 667 genotype, the prothrombin G20210A variant, and further prothrombotic risk factors. Blood 1999;93:1595-1599.
- Mitchell L, Andrew M, Hanna K, Abshire T, Chait P, Halton J, et al. A prospective cohort study determining the prevalence of thrombotic events in children with acute lymphoblastic leukemia and a central venous line who are treated with L-asparaginase: results of the Prophylactic Antithrombin Replacement in Kids with ALL Treated with Asparaginase Group (PARKAA). Cancer 2003;97:508-16.
- Mitchell LG, Sutor AH, Andrew M. Hemostasis in childhood acute lymphoblasitic leukemia : coagulopaty induced by disease or treatment. Semin Thromb Hemost 1995;21:390-401.
- Corso A, Castagnola C, Bernasconi C. Thrombotic events are not exclusive to the remission induction period in patients with acute lymphoblastic leukemia: a report of two cases of cerebral sinus trombosis. Ann Hematol 1997;75:117-119.
- McCabe WM, Jennings LK. Laboratory evaluation of platelet function, in: Platelet Protocols, Research and Clinical Laboratory Procedures, McCabe WM and Jennings LK, (eds) p. 40-50. Academic Press, San Diego, CA, 1999.
- Avramis VI, Sencer S, Periclou AP, sather H, Bostrom BC, Cohen LJ, Ettinger AG, Ettinger LJ, franklin J, gaynon OS, Hilden JM, Lange B, Majlessipour F, Mathew P, Needle M, Neglia J, Reaman G, Holsenberg JS. A randomized comparison of native Escherichia coli asparaginase and polyethylene glycol conjugated asparaginase for treatment of children with newly diagnosed standard-risk acute lymphoblastic leukemia: a Children´s Cancer Group study. Blood 2002;99:1986-1994.
- Jaime-Pérez JC, Gómez-Almaguer D. The complex nature of the prothrombotic state in acute lymphoblastic leukemia of childhood. Haematologica 2003;88:(07)ELT25
- Castaman G, Rodeghiero F, Dini E. Thrombotic complications during L-asparaginase treatment for acute lymphoblastic leukemia. Haematologica 1990;75:567-569.
- Woo MH, Hak LI, Storm MC, Sandlund JT, Ribeiro RC, Rivera GK, Rubnitz JE, Harrison PL, wang B, Evans WE, Pui CH, Relling MV. Hypersensitivity or development of antibodies to asparaginase does not impact treatment outcome of acute lymphoblastic leukemia. J Clin Oncol 2000;18:1525-1532.
- Bonno M, Kawasaki H, Hori H, Umemoto M, Sakurai M,. Rapid desensitization for L-asparaginase sensitivity. J Aller Clin Immunol 1998;101:497-502.
- Groninger E, de Graaff SSN, Meeuwesen-de-Boer GJ, Sluiter WJ, Poppema S. Vincristine induced apoptosis in vivo in peripheral blood mononuclear cells of children with acute lymphoblasatic leukemia. Br J Haematol 2000;111:875-878.
- Wang J, Weiss I, Svoboda K, Kwaan C. Thrombogenic role of cells undergoing apoptosis. Br J Haematol 2001;115:382-391.
- Silverstein RL, Nachman RL. Thrombospondin binds to monocytes-macrophages and mediates platelet-monocyte adhesion. J Clin Invest 1987;79:867-874.
- Peters MJ, Dixon G, Kotowicz KT, Hatch DJ, Heyderman RS, Klein NJ. Circulating platelet-neutrophil complexes represent a subpopulation of activated neutrophils primed for adhesion, phagocytosis and intracellular killing. Br J Haematol 1999:106:391-399.
- Larsen E, Celi A, Gilbert GE, Furie BC, Erban JK, Bonfanti R, Wagner DD, Furie B. PADGEM protein: a receptor that mediates the interaction of activated platelets with neutrophils and monocytes. Cell 1989; 59:305-312.
- Nowak-Göttl U, Alkhe E, Fleischhack G, Schwabe D, Schobess R, Schumann C, Wermes C, Junker R. Thromboembolic events in children with acute lymphoblastic leukemia (BFM protocols): prednisone versus dexamethasone administration. Blood 2003;101:25-29-33.
- Manoharan A, Gemmell R, Brighton T, Dunkley S, Lopez A, Kkyle P. Thrombosis and bleeding in myeloproliferative disorders: identification of at-risk patients with whole blood platelet aggregation studies. Br J Haematol 1999;105:618-625.
- Nowak-Gottl U, Boos J, Wolff JE, Lill H, Veltmann H, Werber G, Ahlke E, Jurgens H. Asparaginase decreases clotting factors in vitro: a possible pitfall Int J Clin Lab Res. 1995;25(3):146-8.
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC






 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: Patrocinio y reconocimiento
Patrocinio y reconocimiento

