REACCION EN CADENA DE POLIMERASA PARA EL DIAGNOSTICO PRECOZ DE LA INFECCION POR HERPES ZOSTER
(especial para SIIC © Derechos reservados)
Coautores
S. W. Wassilew* M. H. Wolff**
Dermatology Department, Klinikum Krefeld, Lutherplatz 40, D-47805 Krefeld, Germany*
Institute of Microbiology and Virology, University of Witten/Herdecke, Stockumer Str. 10, D-58448 Witten, Germany**
Recepción del artículo: 15 de marzo, 2004
Aprobación: 0 de , 0000
 Conclusión breve
La reacción en cadena de polimerasa es el método de elección para el diagnóstico viral de la infección por herpes zóster antes de la erupción de las vesículas.
Conclusión breve
La reacción en cadena de polimerasa es el método de elección para el diagnóstico viral de la infección por herpes zóster antes de la erupción de las vesículas.
 Resumen
La infección por herpes zóster es una patología común provocada por el virus varicela zóster. El uso de agentes virostáticos lo más tempranamente posible es necesario para el acortamiento de la duración del dolor asociado al virus. El diagnóstico rápido es esencial para lograr una óptima eficacia de la terapia antiviral, pero el diagnóstico en etapas tempranas de la infección es a menudo dificultoso. En el presente estudio se analizaron las biopsias cutáneas de los pacientes con herpes zóster y con cambios inespecíficos en la piel para la detección de ADN viral mediante reacción en cadena de polimerasa (PCR) a fin de amplificar las estructuras de lectura abierta (ORF) 14, 29 y 63. El ADN del virus varicela zóster podría detectarse por PCR de las tres ORF, no sólo a partir de las vesículas sino también de la piel eritematosa. La PCR es el método de elección para el diagnóstico viral en el herpes zóster antes de la erupción de las vesículas.
Resumen
La infección por herpes zóster es una patología común provocada por el virus varicela zóster. El uso de agentes virostáticos lo más tempranamente posible es necesario para el acortamiento de la duración del dolor asociado al virus. El diagnóstico rápido es esencial para lograr una óptima eficacia de la terapia antiviral, pero el diagnóstico en etapas tempranas de la infección es a menudo dificultoso. En el presente estudio se analizaron las biopsias cutáneas de los pacientes con herpes zóster y con cambios inespecíficos en la piel para la detección de ADN viral mediante reacción en cadena de polimerasa (PCR) a fin de amplificar las estructuras de lectura abierta (ORF) 14, 29 y 63. El ADN del virus varicela zóster podría detectarse por PCR de las tres ORF, no sólo a partir de las vesículas sino también de la piel eritematosa. La PCR es el método de elección para el diagnóstico viral en el herpes zóster antes de la erupción de las vesículas.
 Palabras clave
Herpes zóster, virus varicela zóster, diagnóstico viral
Clasificación en siicsalud
Palabras clave
Herpes zóster, virus varicela zóster, diagnóstico viral
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/67332
Especialidades
 Principal: Dermatología, Infectología,
Principal: Dermatología, Infectología,
 Relacionadas: Diagnóstico por Laboratorio, Medicina Interna,
Relacionadas: Diagnóstico por Laboratorio, Medicina Interna,
 Enviar correspondencia a:
Enviar correspondencia a:
Dra. H. Martina Lilie. Dermatology Department, Klinikum Krefeld, Lutherplatz 40, D-47805 Krefeld, Germany Lilie, H Martina
POLYMERASE CHAIN REACTION FOR EARLY DIAGNOSIS OF HERPES ZOSTER
 Abstract
Abstract
Herpes zoster is a common disease caused by the varicella-zoster virus. The use of virostatic agents as early as possible is necessary in shortening zoster-associated pain. Rapid diagnosis is necessary for the optimal efficacy of antiviral therapy. The diagnosis in the early stage of infection is often difficult. In the present study skin biopsies of patients with herpes zoster and unclear skin changes were analysed by detecting viral DNA using the polymerase chain reaction (PCR) in order to amplify open reading frames (ORF) 14, 29 and 63. Varicella-zoster virus DNA could be detected with PCR of all three ORF not only from blisters but also from erythematous skin. PCR is the method of choice for the viral diagnosis in herpes zoster before blister eruption.Abstract en alemánZUSAMMENFASSUNGDer Herpes zoster ist eine häufige Erkrankung, hervorgerufen durch das Varizella-zoster Virus. Durch einen frühzeitigen Einsatz der Virostatika wird der Krankheitsverlauf insbesondere im Hinblick auf die zosterassoziierten Schmerzen am günstigsten beeinflußt. Eine schnelle Diagnose ist notwendig für den optimalen Effekt der antiviralen Therapie, obwohl die Diagnose gerade in diesem Stadium oft schwierig ist. In der vorliegenden Studie wurde versucht, in Hautproben von Patienten mit Herpes zoster und unklaren Hautveränderungen die VZV-DNA mittels Polymerasekettenreaktion (PCR) nachzuweisen. Dies erfolgte mit den ORF\'s 14, 29 und 63. Die Varizella-zoster Virus-DNA konnte mit der PCR mit allen drei ORF nicht nur in den Bläschen, sondern auch in erythematöser Haut nachgewiesen werden. Die PCR ist die Methode der Wahl für die Diagnose des Herpes zoster vor Auftreten der typischen Effloreszenzen.Schlüsselwörter: Herpes zoster – Varizella-zoster Virus – Virale Diagnose – Polymerasekettenreaktion (PCR)
REACCION EN CADENA DE POLIMERASA PARA EL DIAGNOSTICO PRECOZ DE LA INFECCION POR HERPES ZOSTER
(especial para SIIC © Derechos reservados)
Artículo completo
El herpes zóster es una enfermedad neurodérmica causada por el virus varicela zóster (VVZ), la cual puede ser definida como una recaída endógena de la infección primaria por varicela. Se caracteriza típicamente por la erupción en las regiones de inervación de los nervios craneales o espinales. Como regla, el diagnóstico es obvio cuando aparece la erupción cutánea; el cuadro clínico característico consiste en vesículas agrupadas sobre una base eritematosa, la localización (enrojecimiento, vesículas, costras en un segmento) y el antecedente de dolor segmentario.
El problema más frecuente de la terapia para el herpes zóster no es el uso de agentes virostáticos en general, sino su utilización adecuada durante la replicación viral temprana, es decir antes de la aparición de las vesículas y del comienzo del dolor o los síntomas prodrómicos. El diagnóstico precoz es absolutamente necesario para la eficacia del tratamiento antiviral. Desafortunadamente, en esta etapa es difícil el diagnóstico de herpes zóster. Los pacientes evidencian en su mayoría diversos tipos de dolor, sensibilidad y eritema que incluyen distintos diagnósticos clínicos diferenciales tales como infecciones por virus herpes simple (HSV), erisipela, sarcoidosis aguda, dermatitis de contacto aguda, picaduras de insectos y abscesos. Todas estas patologías comienzan con un eritema edematoso, poco dolor y algunas veces fiebre. Por el contrario, el diagnóstico clínico y virológico es sencillo luego de la aparición de la erupción vesicular típica.
La detección de anticuerpos séricos en los pacientes es inútil para diferenciar entre estas enfermedades y el herpes zóster de reciente comienzo. Actualmente sólo los controles diarios del enfermo y la detección de ADN-VVZ por PCR en las vesículas posibilitan el diagnóstico temprano de la infección por herpes zóster y el inicio de la terapia antiviral. La localización de las estructuras de lectura abierta (ORF) utilizada para la detección por PCR se muestra en la figura 1. El genoma del VVZ es una molécula de doble cadena linear de 124 884 bp. La secuencia completa de nucleótidos está formada por 70 genes, localizados en regiones únicas largas (UL), únicas cortas (US), repetidas terminales largas y cortas (TRL y TRS) e internas largas y cortas (IRL e IRS).2,3
Los objetivos de este estudio fueron: primero, examinar la posibilidad de detección de ADN-VVZ en diferentes tipos de tejidos, y segundo, la identificación de ADN-VVZ antes de la aparición de la erupción cutánea típica.
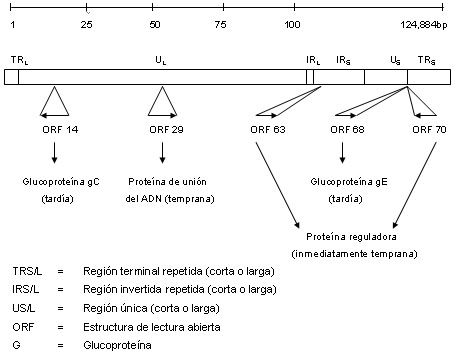
Figura 1. Panorama del genoma VVZ.
Material y métodos
Población de estudio
Se obtuvieron biopsias cutáneas en sacabocados de 2 mm en 48 pacientes con diagnóstico clínico de herpes zóster (vesículas, eritema y piel sin cambios del mismo segmento), cambios cutáneos poco claros y de individuos con otras enfermedades inflamatorias y tumores malignos (utilizados como controles negativos).
Reacción en cadena de polimerasa
Para la detección de ADN-VVZ en las muestras de los pacientes se utilizó la reacción en cadena de polimerasa (PCR). Se amplificaron las ORF VVZ 14, 29 y 63. Con relación a la división de las proteínas en inmediatamente tempranas, tempranas y tardías codificadas por el VVZ, la ORF 14 se clasifica como un gen tardío (glucoproteína C), la ORF 29 pertenece al grupo de genes tempranos y la ORF 63 al de los genes inmediatamente tempranos. La glucoproteína C (GC) codificada por ORF 14 tiene un peso molecular de 95-105 kD y está involucrada en la adherencia del VVZ a las células del huésped.2,12,13 La ORF 29 codifica una proteína de 130 kD, la proteína principal de unión del ADN (MDBP).3,9 La ORF 63 codifica la proteína IE del VVZ y es una fosfoproteína de 45 kD. La IE 63 se expresa durante la infección lítica en los cultivos celulares y las lesiones cutáneas.4,10,16
La PCR se realizó bajo condiciones de reacción estándar.18 Los primers y sondas se enumeran en la tabla 1.
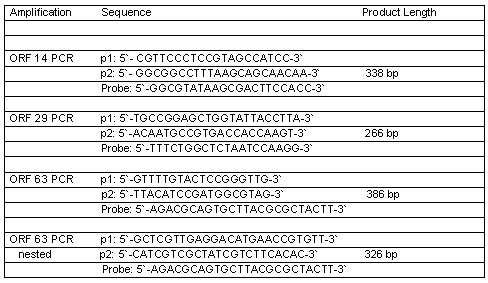
Tabla 1. Pares de primers y sondas para PCR-VVZ.
Para la obtención de resultados óptimos la concentración de MgCl2 se ajustó a 1.4 mM (ORF 14), 1.0 mM (ORF 29) y 1.5 mM (ORF 63), respectivamente. El ADN se amplificó en un volumen de reacción total de 50 μl (PCR ORF 29) o 100 μl (PCR ORF 14, PCR ORF 63) con un contenido apropiado de MgCl2, 50 mM de KCl, 10 mM Tris-HCl (pH 8.8), 0.1% NP 40, 10 μg/100 μl BSA, 200 μM de dNTP (Pharmacia, Suecia), 40 pmol de cada primer y 2.5 U Taq PNA polimerasa (MBI Fermentas, Lituania).
La muestra se adicionó a un volumen de 10 μl que contenía 1 μg de ADN genómico. La amplificación se realizó con un termosecuenciador Trio Thermocycler (Biometra, Alemania) de la siguiente forma: desnaturalización inicial por 2 minutos a 94ºC, repetición del ciclo por 1 minuto a 94ºC (paso 1); 1.40 minutos a 54ºC (PCR ORF 14), 1.30 minutos a 64ºC (PCR ORF 29) y 1.30 minutos a 49ºC (PCR ORF 63) (paso 2) y 1.45 minutos a 72ºC (paso 3). Los pasos 1 a 3 fueron repetidos 40 veces (PCR ORF 14), 35 veces (PCR ORF 29) y 38 veces (PCR ORF 63), respectivamente. Se realizó la PCR anidada para ORF 63 mediante la transferencia de alícuotas de 10 μl después de 26 ciclos dentro de 90 μl de una reacción mixta que contenía los primers interiores (véase tabla 1) y la realización de 26 ciclos de 1 minuto a 94ºC, 1.12 minutos a 54ºC y 1.30 minutos a 72ºC.
Los productos de la PCR se analizaron mediante electroforesis en gel de agarosa (1.8%) seguida por tinción con bromuro de etidium y Southern blotting (figura 2).
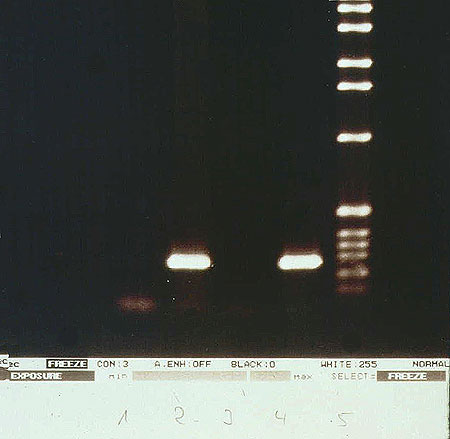
Figura 2. Gelelectroforesis. Detección de ADN-VVZ en los tejidos mediante PCR: positivo. Diagnóstico: herpes zóster. Línea 1: control negativo de la PCR; línea 2: PCR del ADN del tejido examinado; ORF 29; línea 3: control negativo de la piel no afectada; línea 4: control positivo (ADN del VVZ de los fibroblastos embriológicos humanos infectados); línea 5: 1 kb marcador de AND.
Resultados
Hasta ahora, hemos sido capaces de detectar las tres ORF de las vesículas de 13 pacientes (tabla 2), lo cual concuerda con los hallazgos de otros autores.5,6,13,14,17,19,20 La especificidad de este ensayo se demostró mediante la amplificación del ácido nucleico del VVZ preparado a partir de las células infectadas con la cepa VVZ Ellen u OKA, la amplificación inespecífica se controló a partir del ácido nucleico aislado de la cepa HSV-1 F de las células infectadas.

Tabla 2. Resultados de las biopsias cutáneas (vesícula): PCR en pacientes con manifestaciones clínicas de herpes zóster.
En dos casos las tres ORF fueron negativas en las biopsias cutáneas obtenidas de zonas de eritema o piel normal del dermatoma afectado (tabla 3: paciente Nº 8 [M.P.] y tabla 4: paciente Nº 1 [A.S.]). Esto probablemente se deba al hecho de que la biopsia por sacabocados se obtuvo 6 días después del comienzo de la erupción. Una explicación posible es que el eritema producido 6 días luego del inicio de la erupción no haya sido provocado por la replicación viral, sino que se deba a la inflamación secundaria de larga duración.
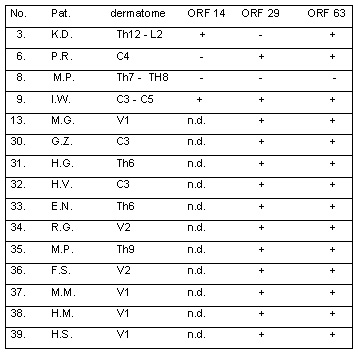
Tabla 3: Resultados de las biopsias cutáneas (eritema): PCR en pacientes con manifestaciones clínicas de herpes zóster.

Tabla 4: Resultados de las biopsias cutáneas (piel normal): PCR en pacientes con manifestaciones clínicas de herpes zóster.
En casos seleccionados fuimos capaces de probar o excluir herpes zóster en la piel no comprometida o eritematosa sin vesículas: en 19 casos con sospecha inicial de herpes zóster, la infección se diagnosticó en el seguimiento clínico mediante la positividad de PCR ORF 14, 29 y 63 (figuras 3.1, 3.2, 3.3 y 3.4; tablas 5, 6 y 7).
Figura 3.1. Eritema doloroso leve en un paciente de 69 años luego de varios días de dolor prodrómico. Comienzo de la terapia antiviral. Paciente Nº 18 (I.B), Tablas 5,7.

Figura 3.2. El mismo paciente 24 horas después, cuadro clínico típico de la infección temprana por herpes zóster.
Figura 3.3. El mismo paciente 48 horas después, progresión de las lesiones cutáneas.
Figura 3.4. El mismo paciente 72 horas después, progresión de las lesiones cutáneas.
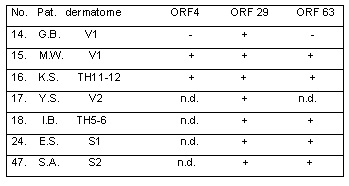
Tabla 5. Resultados de las biopsias cutáneas (vesículas): PCR en pacientes con cambios cutáneos poco claros, sospecha inicial de herpes zóster, confirmada durante el seguimiento clínico. Diagnóstico diferencial. Nº 14: picadura de insecto; Nº 17, 18: dermatitis de contacto; Nº 15, 16, 24, 47: infección por HSV.
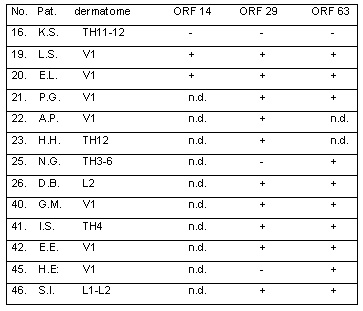
Tabla 6: Resultados de las biopsias cutáneas (eritema): PCR en pacientes con cambios cutáneos poco claros, sospecha inicial de herpes zóster confirmada durante el seguimiento clínico. Diagnóstico diferencial. Nº 16, 23, 46: infección por HSV; Nº 19, 40, 42: picadura de insecto; Nº 41: dermatitis; Nº 20 21, 22, 25, 26, 45: erisipelas.

Tabla 7: Resultados de las biopsias cutáneas (piel normal): PCR en pacientes con cambios cutáneos poco claros, sospecha inicial de herpes zóster confirmada durante el seguimiento clínico. Diagnóstico diferencial. Nº 18: dermatitis de contacto; Nº 21, 25: erisipelas; Nº 23, 24, 26: infección por HSV.
En 6 pacientes con sospecha de herpes zóster no fue posible la detección de la infección debido a la negatividad de PCR ORF 14, 29 y 63 (tabla 8).
En los sujetos utilizados como controles (pacientes con melanoma y carcinoma basocelular) las tres PCR ORF fueron negativas.
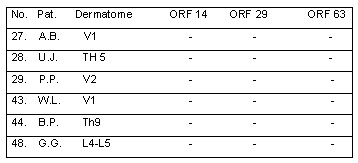
Tabla 8: Resultados de las biopsias cutáneas: PCR en pacientes con cambios cutáneos poco claros, sospecha inicial de herpes zóster, confirmado durante el seguimiento clínico. Diagnóstico diferencial. Nº 27, 28: picadura de insecto/infección por HSV; Nº 29, 44: dermatitis de contacto; Nº 43: parálisis facial; Nº 48: erisipela.
Discusión
El herpes zóster es una patología de personas mayores. Debido al incremento de pacientes de edad avanzada, la infección por este virus constituye un problema médico importante.1,8 Los agentes virostáticos disponibles para el tratamiento del herpes zóster son: aciclovir, valaciclovir, famciclovir y, en Alemania, también brivudin.21
El uso de PCR para el diagnóstico de herpes zóster no se emplea de rutina, aunque esta prueba tiene elevada sensibilidad y especificidad. Los resultados están disponibles en un día.15,17
El ADN viral pudo ser detectado en pacientes con herpes zóster no sólo en las vesículas, sino también en el eritema en 26 de 28 sujetos y en la piel sin compromiso clínico en el dermatoma involucrado en 16 de 18 individuos, lo cual concuerda con los hallazgos de otros autores.5-7,13,14,17,19,20
En los pacientes afectados por otras patologías que clínicamente se asemejan al herpes zóster no pudo detectarse el ADN-VVZ por el método utilizado. Esto debe ser confirmado por ulteriores investigaciones, especialmente en pacientes con eritema solamente, por ejemplo aquellos con erisipela.
En conclusión, los métodos moleculares de PCR fueron capaces de confirmar el diagnóstico clínico, como la detección de ADN viral en las vesículas de los pacientes con herpes zóster. Además, la PCR es el método de elección para el diagnóstico viral al principio de la infección, cuando los enfermos sólo evidencian eritema o en la piel no comprometida y sín vesículas. En pacientes afectados con otras patologías que se asemejan clínicamente al herpes zóster, el ADN-VVZ no pudo detectarse por el método utilizado.
Los autores no manifiestan conflictos.
 Bibliografía del artículo
Bibliografía del artículo
- Balfour HH. Varicella-zoster virus infections in immunocompromised hosts. Am J Med 1988; 85: 68-73.
- Cohen JI. Genomic Structure and Organization of Varicella-Zoster Virus. in: Contributions to Microbiology (Wolff MH, Schuenemann S, Schmidt A eds), Vol 3, Karger 1999; 10-20.
- Davison AJ, Scott JE. The Complete DNA Sequence of Varicella-Zoster Virus. J gen Virol 1986; 67: 1759-1816.
- Debrus S, Sadzot-Delvaux C, Nikkels AF et al. Varicella-zoster virus gene 63 encodes an immediate-early protein that is abundantly expressed during latency. J Virol 1995; 69: 3240-3245.
- Devlin ME, Gilden DH, Mahalingam R et al. Peripheral Blood Mononuclear Cells of the Elderly Contain Varicella-Zoster Virus DNA. J Inf Dis 1992; 16:, 619-622.
- Eis-Hübinger AM, Kaiser R, Kleim JP et al. Nachweis von Varizella-Zoster-Virus-Infektionen mittels Polymerasekettenreaktion. Hautarzt 1992; 43: 767-771.
- Grant AD, Fox JD, Brink NS, Miller RF. Detection of varicella-zoster virus DNA using the polymerase chain reaction in an immunocompromised patient with transverse myelitis secondary to herpes zoster. Genitourin Med 1993; 69: 273-275.
- Hope-Simpson RE. The nature of herpes zoster: a long-term study and a new hypothesis. Proc R Soc Med 1965; 58: 9-20.
- Kinchington PR, Inchauspe G, Subak-Sharpe JH et al. Identification and characterization of a varicella-zoster virus DNA-binding protein by using antisera directed against a predicted synthetic oligonucleotide. J Virol 1988; 62: 802-809.
- Kinchington PR, Bookey D, Turse SE. The transcriptional regulatory protein encoded by varicella-zoster virus open reading frames (ORF) 4 and 63, but not ORF 61 are associated with purified virus particles. J Virol 1995; 69: 4274-4282.
- Kinchington PR, Ling P, Pensiero M et al. A possible role for gpV in the pathogenesis of varicella-zoster virus. Advances in Experimental Medicine and Biology. New York, Plenum Press 1990; vol 278: 83-92.
- Moffat JF, Zerboni L, Kinchington P et al. Attenuation of the vaccine Oka strain of varicella-zoster virus and role of glycoprotein C in alphaherpesvirus virulence demonstrated in the SCID-hu mouse. J Virol 1998; 72: 965-974.
- Nahass, GT, Goldstein BA, Zhu WY et al. Comparison of Tzanck Smear, Viral Culture, and DNA Diagnostic Methods in Detection of Herpes Simplex and Varicella-Zoster Infection. JAMA 1992; 268, 18: 2542-2544.
- Nahass GT, Penneys NS, Leonardi CL. Analysis of the Polymerase Chain Reaction in the Detection of Herpesvirus DNA From Fixed and Stained Tissue Sections. Arch Dermatol 1995; 131: 805-808.
- Nahass GT, Mandel MJ Cook S, Fan W et al. Detection of herpes simplex and varicella-zoster infection from cutaneous lesions in different clinical stages with the polymerase chain reaction. J Am Acad Dermatol 1995; 32: 730-733.
- Nikkels AF, Bebrus S, Sadzot-Delvaux C et al. Immunhistochemical identification of varicella-zoster virus gene 63 encoded protein (IE 63) and late (GE) protein on smears and cutaneous biopsies. Implications for diagnostic use. J Med Virol 1995; 47: 342-347.
- Rübben A, Baron JM, Grussendorf-Conen EI. Routine detection of herpes simplex virus and varicella zoster virus by polymerase chain reaction reveals that initial herpes zoster is frequently misdiagnosed as herpes simplex. Br J Dermatol 1997; 137: 259-261.
- Saiki RK, Gelfand DH, Stoffel S et al. Primer-directed enzymatic amplification of DNA with a thermostable DNA polymerase. Science 1988; 239: 487-491.
- Sauerbrei A, Sommer M, Wutzler P. Virologische Diagnostik des Herpes zoster. Der Hautarzt 1999; 50: 873-878.
- Schaller J, Rohwedder A, Breier B et al. Nachweis einer ungewöhnlichen Varizella-Zoster-Virusinfektion unter Immunsuppression mit der Polymerase-Kettenreaktion. Der Hautarzt 1994; 45: 335-338.
- Wutzler P, Doerr HW. Antivirale Therapie des Zoster. Deutsches Ärzteblatt 1998; 95: 379-81.
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC





 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a:












