APLICACION DE HERRAMIENTAS MOLECULARES EN LOS ESTUDIOS EPIDEMIOLOGICOS DE LA LEISHMANIASIS CUTANEA EN VENEZUELA
(especial para SIIC © Derechos reservados)
Coautores
Héctor De Lima, MD* Olga Zerpa, MD*
Ministerio de Salud y Desarrollo Social*
Recepción del artículo: 17 de marzo, 2004
Aprobación: 0 de , 0000
 Conclusión breve
El uso de las herramientas moleculares diseñadas, así como la aplicación de técnicas moleculares y el análisis de restricción e hibridación molecular con sondas específicas, permiten conocer la distribución geográfica de las especies de Leishmania que ocasionan la leishmaniasis humana en las diferentes zonas del país.
Conclusión breve
El uso de las herramientas moleculares diseñadas, así como la aplicación de técnicas moleculares y el análisis de restricción e hibridación molecular con sondas específicas, permiten conocer la distribución geográfica de las especies de Leishmania que ocasionan la leishmaniasis humana en las diferentes zonas del país.
 Resumen
En este trabajo se presentan resultados obtenidos con aplicación de herramientas moleculares diseñadas en nuestro laboratorio y utilizadas para el estudio epidemiológico de la leishmaniasis cutánea en Venezuela. Las herramientas aplicadas fueron derivadas tanto de ADN nuclear como de ADN de cinetoplasto. A partir de ambos ácidos nucleicos se elaboraron primers (oligonucleótidos) y sondas para el diagnóstico parasitológico e identificación de las especies de Leishmania que ocasionan la leishmaniasis cutánea, así como de sus respectivos vectores y reservorios. Se estudiaron 2 784 muestras obtenidas de pacientes con lesiones sospechosas de leishmaniasis cutánea, provenientes de 20 estados del país, así como 496 animales silvestres y 2 700 flebótomos. El uso de las herramientas moleculares diseñadas, así como la aplicación de técnicas moleculares tales como PCR, el análisis de restricción e hibridación molecular con sondas específicas, permiten conocer la distribución geográfica de las especies de Leishmania que ocasionan la leishmaniasis humana en distintas áreas endémicas del país. Asimismo se logró la identificación de vectores y reservorios silvestres que mantienen la transmisión de Leishmania (V) braziliensis en su ambiente natural.
Resumen
En este trabajo se presentan resultados obtenidos con aplicación de herramientas moleculares diseñadas en nuestro laboratorio y utilizadas para el estudio epidemiológico de la leishmaniasis cutánea en Venezuela. Las herramientas aplicadas fueron derivadas tanto de ADN nuclear como de ADN de cinetoplasto. A partir de ambos ácidos nucleicos se elaboraron primers (oligonucleótidos) y sondas para el diagnóstico parasitológico e identificación de las especies de Leishmania que ocasionan la leishmaniasis cutánea, así como de sus respectivos vectores y reservorios. Se estudiaron 2 784 muestras obtenidas de pacientes con lesiones sospechosas de leishmaniasis cutánea, provenientes de 20 estados del país, así como 496 animales silvestres y 2 700 flebótomos. El uso de las herramientas moleculares diseñadas, así como la aplicación de técnicas moleculares tales como PCR, el análisis de restricción e hibridación molecular con sondas específicas, permiten conocer la distribución geográfica de las especies de Leishmania que ocasionan la leishmaniasis humana en distintas áreas endémicas del país. Asimismo se logró la identificación de vectores y reservorios silvestres que mantienen la transmisión de Leishmania (V) braziliensis en su ambiente natural.
 Palabras clave
Leishmaniasis, epidemiología, diagnóstico, Leishmania braziliensis, reservorios, vectores, Venezuela
Clasificación en siicsalud
Palabras clave
Leishmaniasis, epidemiología, diagnóstico, Leishmania braziliensis, reservorios, vectores, Venezuela
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/67368
Especialidades
 Principal: Dermatología, Genética Humana,
Principal: Dermatología, Genética Humana,
 Relacionadas: Atención Primaria, Bioquímica, Diagnóstico por Laboratorio, Epidemiología, Infectología,
Relacionadas: Atención Primaria, Bioquímica, Diagnóstico por Laboratorio, Epidemiología, Infectología,
 Enviar correspondencia a:
Enviar correspondencia a:
Dra. Noris Rodríguez . Instituto de Biomedicina Apdo postal 4043, Caracas 1010 A Caracas, Venezuela. Rodriguez, Noris Marcela
 Abstract
Abstract
In this work we present results obtained with the application of molecular tools, developed in our laboratory and used for epidemiological studies of cutaneous leishmaniasis in Venezuela. The tools were derived from nuclear and kinetoplast DNA. Primers and probes were derived from both nucleic acids for diagnosis and identification of the different Leishmania species producing cutaneous leishmaniasis as well as the vectors and reservoirs. We studied 2 784 samples obtained from patients with suspicious lesions of cutaneous leishmaniasis from 20 states of the country as well as 496 wild animals and 2 700 sandflies. The use of the molecular tools designed and molecular techniques such as PCR, restriction analysis and molecular hybridisation with specific probes has allowed to know the geographic distribution of Leishmania species producing human leishmaniasis, also the identification of vectors and reservoirs implicated in the transmission of L. (V) braziliensis in the natural environment.
 Key words
Key words
Leishmaniasis, epidemiology, diagnosis, Leishmania braziliensis, reservoirs, vectors, Venezuela
APLICACION DE HERRAMIENTAS MOLECULARES EN LOS ESTUDIOS EPIDEMIOLOGICOS DE LA LEISHMANIASIS CUTANEA EN VENEZUELA
(especial para SIIC © Derechos reservados)
Artículo completo
Introducción
La leishmaniasis es considerada como un grave problema de salud pública a nivel mundial, se registran alrededor de 1.5 millón de casos al año de leishmaniasis cutánea y 500 000 casos de la forma visceral.1 La enfermedad afecta principalmente el sistema fagocítico mononuclear a nivel de la piel, mucosas y otros órganos internos como el hígado y el bazo. Se presenta en diferentes manifestaciones clínicas: leishmaniasis cutánea –que se presenta en cuatro formas distintas: leishmaniasis cutánea localizada (LCL), leishmaniasis cutáneo mucosa (LCM), leishmaniasis difusa (LD) y leishmaniasis intermedia (LI)–2,3 y leishmaniasis visceral, que es la forma más mortal de la enfermedad, sobre todo en los niños menores de 5 años.4 Se considera que al menos 20 especies de parásitos son responsables de las distintas manifestaciones clínicas, sin embargo, el curso de la infección depende tanto de la especie infectante como del estado inmunológico del huésped.2,5,6 El diagnóstico de la enfermedad se basa en la clínica, así como en las características epidemiológicas, inmunológicas y parasitológicas, sin embargo el diagnóstico parasitológico es definitivo y se basa en la demostración del parásito en una muestra biológica, los métodos más comúnmente utilizados son la observación directa al microscopio después de la tinción de un frotis con Giemsa, inoculación en animales experimentales y cultivo en medios artificiales. Más recientemente, la reacción en cadena de polimerasa (PCR) con primers específicos para especie, ha demostrado ser una técnica más sensible y específica que las anteriores para el diagnóstico parasitológico de la leishmaniasis así como para la identificación de la especie que causa la enfermedad. En Venezuela se reportan alrededor de 2 400 casos de leishmaniasis cutánea cada año en áreas endémicas donde coexisten otras patologías como la lepra y algunas micosis, por lo que se hace indispensable un diagnóstico preciso de la enfermedad para su debido tratamiento. El interés en nuestro laboratorio ha sido el desarrollo y aplicación de algunas herramientas moleculares, entre ellas, primers y sondas específicas para especie,7,8,9 que nos han permitido el estudio parasitológico de muestras provenientes de humanos, animales silvestres y vectores y conocer el ciclo biológico y la importancia epidemiológica de Leishmania (V) braziliensis y Leishmania (L) mexicana en las distintas áreas endémicas de Venezuela.
Materiales y métodos
Previo consentimiento informado, se tomaron biopsias de humanos con lesiones sospechosas de leishmaniasis, animales silvestres, así como pooles de flebótomos se colocaron en un tubo de 1.5 ml conteniendo 100 μl de buffer TE (Tris-EDTA, pH 8) + 5 μg/ml de proteinasa K; posteriormente las muestras fueron incubadas a 56º C durante 1 hora y una vez lisadas se procedió a la extracción del ADN utilizando el método de extracción con fenol/cloroformo. El ADN es precipitado de la fase acuosa con 2.5 volúmenes de etanol a –20º C durante 2 horas y luego recolectado mediante centrifugación y finalmente resuspendido en buffer TE. Un μl (100 ng) de ADN es utilizado en la reacción de PCR en una mezcla de reacción que contiene 2.5 mM desoxinucleótidos (dNTP), 5 Unidades de Taq polimerasa, 10 μl de agua estéril y 200 ng de cada primer (3J1 = 5'-TACCTGATGACTCCAC-3'; 3J2 = 5'- CCTCATCATACCGTTGATC-3'). La mezcla es protegida con 20 μl de aceite mineral y colocada en un termociclador (PT 100 MJ Research) para su amplificación, utilizando el siguiente programa: 5 min a 95º C para desnaturar el ADN y luego 35 ciclos que constan de 1 min a 94º C, 1 min a 60º C, 1 min a 72º C. El producto final obtenido es visualizado mediante electroforesis en geles de agarosa al 1% teñidos con bromuro de etidio 0.5 μg/ml.
Hibridación de ADN en dot blot
Diez μl del producto amplificado por PCR fueron aplicados directamente sobre papel de nitrocelulosa; después de secar al aire el ADN fue desnaturado sobre el papel con 10 μl de NaOH 1 N, inmediatamente se realiza la neutralización con 10 μl de acetato de amonio 2N. La nitrocelulosa se seca en horno de vacío durante una hora a 80º C; luego se procede a la prehibridación durante toda la noche en buffer que contiene (5XSSC; 1% SDS; 5X Denhardt; 50 μg/ml de esperma de salmón y 50% formamida. La hibridación se realiza durante 12 horas utilizando el mismo buffer en presencia de la sonda marcada con digoxigenina (Boehringer-Manhein).

Figura 1. Electroforesis en gel de agarosa al 1% de los productos de PCR obtenidos con primers 3J1, 3J2, después de 35 ciclos de amplificación. Líneas 1-16 corresponden a muestras de pacientes; línea 17 es el control negativo (mezcla de reacción sin DNA), línea 18, control positivo (DNA de L. (V) braziliensis); línea 19, marcadores de peso molecular.

Figura 2. Hibridación molecular en dot blot, utilizando la sonda LbJ38 específica para L. (V) braziliensis. Muestras 1-13 fueron positivas por PCR para L. braziliensis; muestra 14, PCR positivo para L. mexicana; muestra 15, control positivo para L. (V) braziliensis; muestra 16, control negativo (mezcla de reacción sin DNA).

Figura 3. Porcentaje de L. braziliensis y L. mexicana obtenido después de realizar la PCR en 2 784 muestras humanas.
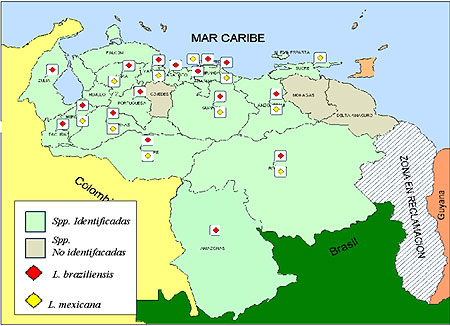
Figura 4. Distribución geográfica de L. mexicana y L. braziliensis en diferentes áreas endémicas de Venezuela.
Resultados
La figura 1 es una muestra del producto de PCR obtenido a partir de biopsias de pacientes con lesiones sospechosas de leishmaniasis. El producto esperado de aproximadamente 605 pares de bases, el cual diagnostica la presencia de Leishmania (V) braziliensis fue observado en 80% de las muestras estudiadas; estos mismos productos fueron hibridados utilizando la técnica de dot blot con la sonda específica (LbJ38) marcada con digoxigenina (Genius kit, Boerinhger-Manhein). La figura 2 muestra el resultado obtenido después de la hibridación donde se puede observar la alta señal de homología con la sonda (LbJ38) específica en la detección de L. (V) braziliensis. La misma metodología permitió la identificación de Lu. panamensis y Lu. Gomezi (tabla 1), como vectores de esta especie de Leishmania en un área endémica. En cuanto al estudio en animales silvestres (tabla 2), se pudo confirmar la presencia de Leishmania (V) braziliensis en muestras de Rattus rattus y Sigmodon hispidus en varias áreas endémicas del país. Asimismo se detectó la existencia en muy bajo porcentaje (0.5%) de Leishmania (V) guyanensis tanto en muestras humanas como en animales silvestres en un área endémica del estado de Mérida. En la figura 3 se muestra la distribución porcentual de las dos especies más importantes que causan la leishmaniasis cutánea en el país (80% L. (V) braziliensis y 20% L. (L) mexicana) en los casos humanos estudiados. La figura 4 muestra la distribución geográfica de ambas especies de Leishmania en los distintos estados; la leishmaniasis cutánea está ampliamente distribuida en Venezuela, se detectó en todos los estados, con la sola excepción del estado Nueva Esparta.

Tabla 1. Porcentaje de Lutzomyia sp. positivas para L. (V) braziliensis después de realizar la PCR con primers 3J1, 3J2.

Tabla 2. Distintas especies y número de animales capturados con los respectivos porcentajes de positividad para Leishmania sp.
Discusión
Los resultados que se informan constituyen un importante aporte al conocimiento de la epidemiología de L. (V) braziliensis en Venezuela. El uso de las técnicas moleculares simplifica los estudios epidemiológicos, sobre todo en vectores, donde se hace necesario procesar un gran número de muestras para encontrar un solo individuo positivo. Los primers 3J1 y 3J2 son sumamente recomendables para este tipo de estudio debido a su alta sensibilidad y especificidad en la detección de L. (V) braziliensis. La PCR mediante primers específicos para especie resulta la vía más sensible en el diagnóstico parasitológico de la leishmaniasis cutánea cuando se compara con el frotis (72% ) y el cultivo (42%). Asimismo queda demostrado el papel de L. (L) mexicana en la transmisión de la leishmaniasis cutánea localizada, la cual coexiste en un mismo foco con L. braziliensis donde se encuentra incluso una sola especie de vector, como es el caso de un área endémica del estado de Miranda,10 donde previamente fue reportada la existencia de ambas especies de Leishmania en el vector Lu. ovallesi.
Por otro lado, el desarrollo de herramientas específicas para la detección de otras especies de Leishmania, como es el caso de L. guyanensis, cuya presencia en humanos y reservorios ya ha sido demostrada (manuscrito en preparación), nos permitirá conocer en un futuro cercano la epidemiología de esta especie en áreas endémicas del país.
El estudio taxonómico en aislados de diversas lesiones clínicas, así como de animales silvestres nos permitió demostrar que L. (V) braziliensis en Venezuela es un grupo heterogéneo de parásitos sumamente polimórficos,11,12 cuya asociación con las distintas áreas geográficas y respuesta al tratamiento se encuentra en estudio.
Este trabajo constituye la primera demostración en Venezuela del ciclo epidemiológico de L.(V) braziliensis, en su ambiente natural, logrado con la ayuda de las herramientas moleculares desarrolladas en nuestro laboratorio, las cuales demostraron sensibilidad y especificidad en la detección de esta especie en muestras de biopsias humanas. Un trabajo similar se encuentra en ejecución relacionado con el estudio epidemiológico de la leishmaniasis visceral en Venezuela. En algunas áreas estudiadas se tiene la confirmación de L. (L) infantum como responsable de esta patología tanto en humanos como en perros domésticos.13Agradecimientos: Esta investigación ha sido parcialmente financiada por el proyecto Iniciativa Científica Millenium No: 4572-VE.Los autores no manifiestan conflictos.
 Bibliografía del artículo
Bibliografía del artículo
- WHO (1993). Control of leishmaniasis. Report of a WHO wxpert committee. Technical report Series 739.
- Convit J, Ulrich M, Fernández C.T, y col (1993). The clinical and inmunlogical spectrum of American Cutaneous Leishmaniasis. Trans. R. Soc. Trop. Med. Hyg. 87:444-448.
- Convit J (1996). Leishmaniasis: Inmunological and clinical aspects and vaccine in Venezuela. Clin. Dermatol 14(5): 479-87.
- Zerpa O, Ulrich M, Benitez M y Col (2002). Epidemiological and inmunological aspects of human visceral leishmaniasis on Margarita Island, Venezuela. Mem. Inst. Oswaldo Cruz. 97(8): 1079-83.
- Alexander J y Russell D.G (1992). The interaction of Leishmania species with macrophages. Advances in Parasitology 31: 175-254.
- Alvar JP (1997). La Leishmaniasis: De la Biología al control. Laboratorio de referencia para la leishmaniasis (OMS, 1993). Madrid, pp 151
- Rodríguez N; Guzmán B, Rodas A y Col (1994). Diagnosis of cutaneous leishmaniasis ad species discrimination of parasites by PCR and hybridisation. J. Clin. Microbiol. 32: 2246-2252.
- Rodriguez N, De Lima H, Rodriguez A y Col (1997). Genomic DNA repeat from Leishmania (V) braziliensis (Venezuelan strain) containing simple repeats and microsatellites. Parasitology 15: 349-358.
- Rodriguez N, Rodriguez, A, Cardona M y Col. (2000). Leishmania (V) guyanensis: A new minicircle class exclusive to this specie isolated from a DNA cosmic library usefull for taxonomic purposes. Experimental Parasitology. 94: 143-149.
- Barrios M.A, Rodriguez N, Feliciangeli M.D y Col (1994). Coexistence of two species of Leishmania in the digestive tract of the vector Lu. ovallesi. Am. J. Trop. Med. Hyg 51 (1): 66-675.
- Sosa A, Fernández A y Rodríguez N (2002) Variabilidad Genetíca de aislados de Leishmania provenientes de distintos focos del estado Miranda, Venezuela. Acta Científica Venezolana 53: 212-213.
- Zerpa O, Ulrich M, Negron E y Col (2000). Canine visceral leishmaniasis on Margarita Island (Nueva Esparta, Venezuela). Trans. R. Soc. Trop. Med. Hyg. 94(5): 484-87.
- Zerpa O, Pratlong F, Ulrich M y Col (2001) Isolation of Leishmania infantum, Zymodeme MON-1 from canine and human visceral leishmaniasis on Margarita Island, Venezuela 96(7): 901-02.
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC





 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a:




