NIVELES PLASMATICOS DE ENDOTELINA INCREMENTADOS EN EL HIPOGONADISMO MASCULINO Y EN EL HIPERCORTISOLISMO
(especial para SIIC © Derechos reservados)
Coautores
Analia Tomova, MD, PhD;* Georgi Kirilov, MD, PhD* Lilya Dakovska, MD, PhD*
Clinical Center of Endocrinology and Gerontology, Medical University, Sofia, Bulgaria*
Recepción del artículo: 26 de marzo, 2004
Aprobación: 0 de , 0000
 Conclusión breve
Los valores plasmáticos de endotelina en varones con hipogonadismo están incrementados, sin correlación significativa entre los niveles de endotelina y las concentraciones de gonadotrofinas, prolactina y testosterona.
Conclusión breve
Los valores plasmáticos de endotelina en varones con hipogonadismo están incrementados, sin correlación significativa entre los niveles de endotelina y las concentraciones de gonadotrofinas, prolactina y testosterona.
 Resumen
Antecedentes: Se ha planteado que la endotelina tiene participación en algunas enfermedades suprarrenales. La endotelina tiene efectos variados sobre el sistema reproductivo. Para aclarar la relación entre la endotelina y el eje hipotalámico-hipofisario-testicular y suprarrenal efectuamos dos estudios consecutivos. Material, métodos y resultados: Las concentraciones plasmáticas de endotelina fueron determinadas por radioinmunoensayo de alta sensibilidad. En 18 hombres con hipogonadismo los valores basales de endotelina (0.95 ± 0.53 fmol/ml) fueron significativamente mayores que los de 8 controles compatibles (0.54 ± 0.06 fmol/ml, p < 0.05). Los hombres con hipogonadismo hipergonadotrófico tenían concentraciones de endotelina significativamente aumentadas, mientras que aquellos con hipogonadismo hipogonadotrófico tenían valores no significativamente elevados. No se encontró correlación significativa entre los niveles plasmáticos de endotelina y las concentraciones de gonadotrofina y testosterona. Los valores de endotelina en plasma se determinaron en 13 individuos no tratados con síndrome de Cushing (10 con enfermedad de Cushing y 3 con adenomas suprarrenales). La endotelina fue más elevada en el grupo de pacientes que en los controles sanos (n = 13): 1.59 ± 0.78 versus 0.46 ± 0.20 fmol/ml, respectivamente, p < 0.001. Se encontró correlación positiva entre el colesterol total (6.94 ± 1.75 mmol/l) y los niveles de endotelina entre los pacientes con síndrome de Cushing: r = +0.73, p < 0.02. Conclusión: Nuestros resultados demuestran claramente que el sistema de la endotelina está activado en el síndrome de Cushing y los valores de endotelina en el plasma se encuentran incrementados en hombres con hipogonadismo.
Resumen
Antecedentes: Se ha planteado que la endotelina tiene participación en algunas enfermedades suprarrenales. La endotelina tiene efectos variados sobre el sistema reproductivo. Para aclarar la relación entre la endotelina y el eje hipotalámico-hipofisario-testicular y suprarrenal efectuamos dos estudios consecutivos. Material, métodos y resultados: Las concentraciones plasmáticas de endotelina fueron determinadas por radioinmunoensayo de alta sensibilidad. En 18 hombres con hipogonadismo los valores basales de endotelina (0.95 ± 0.53 fmol/ml) fueron significativamente mayores que los de 8 controles compatibles (0.54 ± 0.06 fmol/ml, p < 0.05). Los hombres con hipogonadismo hipergonadotrófico tenían concentraciones de endotelina significativamente aumentadas, mientras que aquellos con hipogonadismo hipogonadotrófico tenían valores no significativamente elevados. No se encontró correlación significativa entre los niveles plasmáticos de endotelina y las concentraciones de gonadotrofina y testosterona. Los valores de endotelina en plasma se determinaron en 13 individuos no tratados con síndrome de Cushing (10 con enfermedad de Cushing y 3 con adenomas suprarrenales). La endotelina fue más elevada en el grupo de pacientes que en los controles sanos (n = 13): 1.59 ± 0.78 versus 0.46 ± 0.20 fmol/ml, respectivamente, p < 0.001. Se encontró correlación positiva entre el colesterol total (6.94 ± 1.75 mmol/l) y los niveles de endotelina entre los pacientes con síndrome de Cushing: r = +0.73, p < 0.02. Conclusión: Nuestros resultados demuestran claramente que el sistema de la endotelina está activado en el síndrome de Cushing y los valores de endotelina en el plasma se encuentran incrementados en hombres con hipogonadismo.
 Palabras clave
Endotelina, hipogonadismo masculino, gonadotrofinas, síndrome de Cushing
Clasificación en siicsalud
Palabras clave
Endotelina, hipogonadismo masculino, gonadotrofinas, síndrome de Cushing
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/67615
Especialidades
 Principal: Endocrinología y Metabolismo,
Principal: Endocrinología y Metabolismo,
 Relacionadas: Diagnóstico por Laboratorio, Farmacología, Geriatría, Urología,
Relacionadas: Diagnóstico por Laboratorio, Farmacología, Geriatría, Urología,
 Enviar correspondencia a:
Enviar correspondencia a:
Prof. Philip Kumanov, MD, PhD. Clinical Centre of Endocrinology and Gerontology, 6, Damian Gruev Str, Sofia 1303. Bulgaria Kumanov, Philip
INCREASED PLASMA ENDOTHELIN LEVELS IN MALE HYPOGONADISM AND IN HYPERCORTISOLISM
 Abstract
Abstract
Background: The role of endothelin has been presumed in some of the adrenal diseases. Endothelin has also various effects on reproductive system. In order to reveal the relationship of endothelin with the hypothalamo-pituitary-testicular and adrenal axis, we undertook two consecutive studies. Material, methods and results: Plasma endothelin concentrations were determined by highly sensitive radioimmunoassay. The basal endothelin levels in eighteen males with hypogonadism (0.95 ± 0.53 fmol/ml) were significantly higher than those of eight age-matched controls (0.54 ± 0.06 fmol/ml, p < 0.05). Males with hypergonadotrophic hypogonadism had significantly increased endothelin concentrations, whereas those with hypogonadotrophic hypogonadism had nonsignificantly elevated levels. No significant correlation was found between plasma endothelin levels and gonadotrophin and testosterone concentrations. Plasma levels of endothelin were measured in thirteen untreated subjects with Cushing\'s syndrome (10 with Cushing\'s disease and 3 had adrenal adenomas). Endothelin was higher in the patient group than in healthy controls (n = 13): 1.59 ± 0.78 vs. 0.46 ± 0.20 fmol/ml, respectively, p < 0.001. A positive correlation was found between the total cholesterol (6.94 ± 1.75 mmol/l) and endothelin levels in the patients with Cushing\'s syndrome: r = +0.73, p < 0.02. Conclusion: Our results clearly demonstrate that the endothelin system is activated in Cushing\'s syndrome and plasma endothelin levels are increased in males with hypogonadism.
NIVELES PLASMATICOS DE ENDOTELINA INCREMENTADOS EN EL HIPOGONADISMO MASCULINO Y EN EL HIPERCORTISOLISMO
(especial para SIIC © Derechos reservados)
Artículo completo
Introducción
Los datos recientemente obtenidos sugieren una relación entre las funciones testiculares y el péptido vasoactivo endotelina (ET), que es producido localmente en los testículos,1 principalmente por las células de Sertoli pero también por las de Leydig.2 La endotelina participa en la regulación del flujo sanguíneo testicular3 y estimula la secreción de testosterona a partir de las células de Leydig.4 Las células testiculares contienen receptores ET-A considerados como mediadores del efecto estimulante de la ET-1 sobre las células de Leydig.5-7 Al igual que la hormona liberadora de gonadotrofina (GnRH), la ET-1 estimula in vitro la producción de hormona luteinizante (HL) y de hormona foliculoestimulante (FSH) de la hipófisis.8,9 Por otra parte, se publicaron muchos estudios clínicos y experimentales que confirman el papel de la ET como estimulante y modulador del eje hipotalámico-hipofisario-suprarrenal.11-14 La ET-1 estimula la liberación hipotalámica de hormona liberadora de corticotrofina (HLC), y la secreción hipofisaria de hormona adrenocorticotrófica (ACTH) por la vía específica de los receptores ET-A y ET-B.15 Se encontró que la ET es un regulador local de la médula y la corteza suprarrenales16 y, por lo tanto, la ET estimula directamente la secreción de cortisol y aldosterona y por potenciación de la acción de la ACTH. Las hormonas esteroides, sin embargo, parecen modular sus niveles plasmáticos.17,18 En varones sanos, los valores de ET son más elevados que en las mujeres embarazadas y no embarazadas. Los niveles plasmáticos de ET son menores en las embarazadas que en las mujeres no embarazadas. En una cantidad de patologías suprarrenales, como el hiperaldosteronismo primario y la insuficiencia suprarrenal, los valores de la ET en plasma presentan cambios significativos.19-21
El objetivo de nuestro estudio fue examinar los niveles de endotelina en distintas formas de hipogonadismo masculino, prestando especial atención a la relación entre la endotelina y las gonadotrofinas en esos pacientes. Luego procedimos a evaluar los niveles plasmáticos inmunorreactivos de ET en pacientes con síndrome de Cushing endógeno.
Material y métodos
Pacientes
Investigamos inicialmente 18 hombres cuya media de edad era 21.72 ± 4.06 años (DE) con distintas formas de hipogonadismo (4 con síndrome de Klinefelter, 1 con síndrome XYY, 1 con atrofia y 1 con hipotrofia testicular; en los dos últimos, posterior a intervención quirúrgica por criptorquidia). Entre los 11 pacientes con hipogonadismo hipogonadotrófico, 3 tenían síndrome de Kallmann, 5 presentaban hipogonadismo hipogonadotrófico idiopático aislado (HHA) y 3 tenían hipopituitarismo parcial: hipogonadismo hipogonadotrófico y deficiencia de la hormona de crecimiento (HHDHC). El diagnóstico se efectuó sobre la base de los antecedentes médicos, los signos clínicos, las concentraciones séricas de gonadotrofinas, los valores séricos de testosterona y el cariotipo. Ocho varones sanos compatibilizados por edad se utilizaron como controles. Fueron estudiados 13 individuos con síndrome de Cushing no tratado: 8 mujeres y 5 hombres con edad media de 44.2 años ± 9.5 (DE). En 10 de ellos se había diagnosticado enfermedad de Cushing (síndrome de Cushing dependiente de la ACTH) y 3 tenían adenomas suprarrenales. El diagnóstico se basó en los signos clínicos, los datos hormonales (valores elevados de cortisol, concentraciones aumentadas de ACTH en pacientes con enfermedad de Cushing y disminuidas en aquellos con adenomas suprarrenales) y escaneo por tomografía computada de las suprarrenales y de la hipófisis. El estudio se completó durante el estadio activo de la patología y con hipercortisolismo manifiesto y ausencia de medicación durante por lo menos una semana. La función renal no se modificó en ninguno de los pacientes. Se utilizaron como controles 13 individuos sanos con edad de 41 ± 6.5 años (5 hombres y 8 mujeres).
Métodos
Los valores plasmáticos de ET se determinaron en muestras de sangre extraídas por la mañana, entre las 8.30 y las 9, luego de una noche de ayuno. Antes de que se extrajeran las muestras de sangre los pacientes descansaron en posición acostada durante por lo menos 30 minutos. Luego de la centrifugación, los sueros se congelaron a -20ºC. Los valores de ET-1 en el plasma se determinaron por radioinmunoensayo sensible (Biomedica, Viena, Austria) luego de procedimiento de extracción por cartuchos Sep-Pak C18 (Waters, Milford, MA, EE.UU.). Los coeficientes de variación intraensayo e interensayo son de 3% y 11.9%, respectivamente. La sensibilidad de la prueba es de 0.1 fmol/tubo; la reactividad cruzada con la endotelina 2 es de 142%, y con la endotelina 3, de 98%. Todas las muestras de plasma fueron examinadas en la misma tirada y por lo menos por duplicado. Los valores séricos de HL, FSH, prolactina y testosterona se determinaron por fluoroinmunoensayo de resolución temporal (Pharmacia, Turku, Finlandia). Los niveles de cortisol plasmático y la excreción de cortisol libre urinario en las 24 horas se evaluaron por análisis espectrofluorométrico, y la ACTH por prueba radioinmunométrica bidimensional. La evaluación estadística de los datos se efectuó por computación, empleando análisis no paramétricos mediante la prueba de Mann-Whitney y la t de Student. Los coeficientes de correlación lineal se calcularon para describir la asociación entre las variables continuas y esos resultados se expresaron como las medias ± DE. Un valor de p < 0.05 fue considerado estadísticamente significativo.
Resultados
Los valores basales de endotelina en los pacientes con hipogonadismo (0.95 ± 0.53 fmol/ml) fueron significativamente mayores que entre los controles (0.54 ± 0.06 fmol/ml; p < 0.05; tabla 1 y figura 1). Los hombres con hipogonadismo hipergonadotrófico tenían concentraciones de ET significativamente elevadas (1.05 ± 0.57 fmol/ml; p < 0.05), mientras que aquellos con hipogonadismo hipogonadotrófico (0.89 ± 0.53 fmol/ml; p < 0.05) tenían valores elevados, aunque no tan significativos. Solamente el grupo de pacientes con síndrome de Kallmann mostró diferencia significativa en comparación con los controles (1.13 ± 0.71 fmol/ml; p < 0.05). No se encontró correlación significativa entre los valores de endotelina plasmática y las concentraciones de gonadotrofinas, prolactina y testosterona. Esto fue similar para la ET y el índice de masa corporal, colesterol total, triglicéridos y el azúcar en sangre.

Tabla 1. Características clínicas y hormonales de pacientes con hipogonadismo hipogonadotrófico (A) y con hipogonadismo hipergonadotrófico (B).

Figura 1. Niveles de endotelina en pacientes e individuos sanos.
Los niveles de endotelina estuvieron más elevados en los pacientes con síndrome de Cushing que en los controles sanos compatibilizados por edad (n = 13): 1.59 ± 0.78 versus 0.46 ± 0.20 fmol/ml, respectivamente, p < 0.001, tabla 2 y figura 1. Los pacientes con adenomas suprarrenales tenían mayores valores de ET que aquellos con enfermedad de Cushing (n = 10), si bien la diferencia no fue significativa (1.84 ± 0.67 versus 1.51 ± 0.83 fmol/ml, p < 0.05). Se encontró correlación positiva entre el colesterol total sérico (6.94 ± 1.75 mmol/l) y los valores de ET en los pacientes con síndrome de Cushing: r = +0.73, p < 0.02. Sin embargo, la correlación entre la endotelina y la presión arterial, el cortisol plasmático y la excreción urinaria de cortisol libre no fue estadísticamente significativa. En 3 pacientes que fallecieron subsecuentemente a complicaciones cardiovasculares graves, la endotelina plasmática fue significativamente mayor que en el resto de los pacientes (2.34 ± 0.35 fmol/ml, p < 0.05). La excreción urinaria de cortisol en el subgrupo de 7 individuos tratados exitosamente disminuyó en forma significativa. La ET plasmática también demostró tendencia hacia la disminución: 1.34 ± 0.69 versus 0.73 ± 0.53 fmol/ml, p > 0.05. Se observaron reducciones importantes, de 2 a 4 veces, en los valores plasmáticos de ET en 4 de los pacientes tratados.
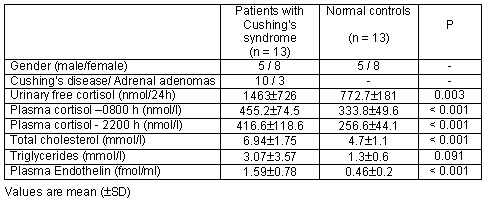
Tabla 2. Características clínicas y de laboratorio en pacientes con síndrome de Cushing y en controles normales.
Discusión
De acuerdo con nuestro conocimiento, éste es el primer estudio que proporciona datos sobre los valores en el plasma de ET en hombres con hipogonadismo hipogonadotrófico e hipergonadotrófico. Los valores obtenidos en el presente ensayo indican que los pacientes con hipogonadismo tienen mayores concentraciones plasmáticas de ET. Polderman y col. encontraron que la ET era mayor en los varones que en las mujeres e informaron aumento de ET en transexuales masculinos luego de 4 meses de tratamiento con testosterona.17 Debido a eso, nuestros resultados son bastante sorprendentes. Atribuimos esa diferencia al hecho de que Polderman y col. compararon hombres y mujeres sanos, y estudiaron a los transexuales en tratamiento con hormonas sexuales. Nosotros comparamos varones sanos con hombres hipogonadales no tratados. Algunos autores4,6 han sugerido que la ET estimula la producción de testosterona. Los elevados valores de ET en el hipogonadismo pueden compensar las bajos niveles de testosterona. Es improbable que los valores incrementados de HL y de FSH estén directamente relacionados con la concentración aumentada de ET. Estos datos están más sustentados por la tendencia encontrada en nuestro ensayo con valores más elevados de ET en pacientes con hipogonadismo hipogonadotrófico, en quienes las concentraciones de gonadotrofinas son bajas. La liberación de HL y de FSH es estimulada por la ET-3.22-24 Se demostró que las neuronas humanas que segregan GnRH producen y responden a la ET-1, y que este péptido regula positivamente la secreción de GnRH.25 El aumento de la ET en hombres con hipogonadismo encontrado en nuestro estudio quizá debería ser considerado como un hecho destinado a compensar la insuficiencia testicular por medio de ET y gonadotrofinas. Fue demostrado el efecto aditivo de la ET-1 y la GnRH para la estimulación de la producción de testosterona.6 Se cree que la dislipoproteinemia produce vasoconstricción a través del incremento de la producción vascular de ET.26 Los valores aumentados de ET pueden hacer a los hombres hipogonadales más propensos a la enfermedad cardiovascular. Teniendo en cuenta nuestros hallazgos sobre la potenciación de la ET en hombres con hipogonadismo, parece que los valores óptimos de testosterona no producen riesgo aumentado de enfermedad cardiovascular entre los hombres en edad reproductiva. La terapia de reemplazo con testosterona, si bien antifisiológica, no se asoció con cambios desfavorables en los perfiles lipídicos.28
De acuerdo con lo que conocemos, éste es el primer estudio que demuestra que la ET, el péptido vasoconstrictor más potente con importantes efectos hipertensivos, mitogénicos y aterogénicos, se encuentra significativamente elevado en pacientes con síndrome de Cushing activo no tratado. No podemos determinar, sin embargo, que exista correlación definitiva entre hipercortisolismo e hiperendotelinemia en un trastorno tan heterogéneo como el síndrome de Cushing, que se asume como modelo natural del envejecimiento vascular temprano. Los valores persistentemente elevados de ET luego del logro de la remisión en ciertos pacientes son probablemente debidos a lesión vascular persistente. El efecto catabólico del hipercortisolismo produce lesión endotelial e incrementa la permeabilidad vascular, lo que a su vez lleva a hipersecreción de ET en la circulación. Podría sugerirse que los valores aumentados en el plasma de ET en tal situación reflejan la disfunción endotelial del síndrome de Cushing típico y pueden ser considerados un marcador bioquímico para este último. La correlativa significación observada entre la ET elevada y el colesterol sérico en el síndrome de Cushing lleva a un hipotético papel de la ET como factor aterogénico potenciador de los procesos ateroescleróticos y de la disfunción endotelial en el hipercortisolismo. Los valores elevados de ET entre los pacientes que fallecieron apoyan la idea de que la endotelina es factor de riesgo y un predictor de complicaciones cardiovasculares graves y aun mortales. Los glucocorticoides estimulan la liberación de ET por las células musculares lisas de los vasos, ejerciendo efecto favorecedor para la acción aterogénica local e hipertensiva de la ET.26 La falta de correlación entre la ET y la hipertensión arterial en nuestro estudio se debe probablemente a la compleja patogénesis de la hipertensión relacionada con el síndrome de Cushing y a la diversidad clínica, bioquímica y patomorfológica del síndrome. Se observó que la infusión de ET-1 en voluntarios sanos aumenta los valores de cortisol en el plasma en forma paralela a los de la presión arterial diastólica, lo que apoya la idea de un papel mediador de la ET-1 sobre el eje hipotalámico-hipofisario-suprarrenal.14 Se ha sugerido que las concentraciones plasmáticas de ET no reflejan exactamente la producción local de las células endoteliales, ya que la secreción de endotelina es predominantemente extraluminal y no principalmente hacia la luz vascular.24 Debido a esto, algunos autores han efectuado una interpretación cauta de las concentraciones plasmáticas aumentadas.24,32
Los resultados de este estudio sugieren que los valores en el plasma de ET en hombres con hipogonadismo están incrementados, sin que se encuentre correlación significativa entre los valores plasmáticos de ET, por un lado, y las concentraciones de gonadotrofinas, prolactina y testosterona, por el otro. Se requieren más estudios para explicar el aumento de la ET en el hipogonadismo y el próximo paso será la determinación de la ET en plasma, antes de iniciar la terapia de reemplazo con testosterona en los hombres hipogonadales y después de iniciado el tratamiento. La endotelina plasmática se encuentra también significativamente elevada en el síndrome de Cushing, lo que refleja posiblemente la activación del sistema de la endotelina en el hipercortisolismo. Nuestro estudio no permitió determinar si dicha elevación es primaria o secundaria, aunque existen razones para asumir que los valores elevados de ET son mediadores de la ateroesclerosis temprana acelerada y de la hipertensión clásica de este trastorno.
Los autores no manifiestan conflictos.
 Bibliografía del artículo
Bibliografía del artículo
- Sakurai T, Yanagisawa M, Takuwa Y. et al. Cloning of a cDNA encoding a non-isopeptide-selective subtype of endothelin receptor. Nature 1990; 348:732-735.
- Fantoni G, Morris PL, Forti G. et al. Endothelin-1: a new autocrine/paracrine factor in rat testis. Am J Physiol 1993; 265:E267-E274.
- Collin O, Damber J-E, Bergh A. Effects of endothelin-1 on the rat testicular vasculature. J Androl1996; 17:360-366.
- Conte D, Questino P, Fillo S. et al. Endothelin stimulates testosterone secretion by rat Leydig cells. J Endocrinol 1993; 136:R1-R4.
- Sakaguchi H, Kozuka M, Hirose S. et al. Properties and localization of endothelin-1-specific receptors in rat testicles. Am J Physiol 1992; 263:R15-R18.
- Romanelli F, Fillo S, Isidori A. et al. Stimulatory action of endothelin-1 on rat Leydig cells: involvement of endothelin-A subtype receptor and phospholipase A2-arachidonate metabolism system. Life Sci1997; 61:557-566.
- Ergun S, Harneit S, Paust H J. et al. Endothelin and endothelin receptors A and B in the human testis. Anat Embryol 1999; 199:207-214.
- Stojilkovic SS, Balla T, Fukuda S. et al. Endothelin ETA receptors mediate the signaling and secretory actions of endothelins in pituitary gonadotropins. Endocrinology 1992; 130:465-474.
- Vierhapper H. Effect of endothelin-1 in man - impact on basal and stimulated concentrations of luteinizing hormone, follicle-stimulating hormone, thyrotropin, growth hormone, corticotropin, and prolactin with and without pretreatment with nifedipine. Metabolism 1996; 45:658-661..
- Samson WK, Skala KK, Alexander BA et al. Possible neuroendocrine actions of endothelin-3. Endocrinology 1991; 128:1465-1473.
- Haak T, Jungmann E, Haak E. et al. Clinical evidence for a neuromodulator action of endothelin in the hypothalamic-pituitary-adrenal axis in man. Exp Clin Endocrinol Diabetes, 1997; 105: 46-52.
- Hinojosa-Laborde C, Lange D: Endothelin regulation of adrenal function. Clin Exp.Pharmacol Physiol 1999; 26: 995-999.
- Nussdorfer GG, Rossi GP, Malendovicz LK et al. Autocrine-paracrine endothelin system in the physiology and pathology of steroid-secreting tissues. Pharmacol Rev 1999; 51: 403-438.
- Kiefer F, Kellner M, Jahn H. et al. Comparison of the effects of endothelin- 1 and- 3 on secretion of pituitary hormones in healthy male volunteers. Exp Clin Endocrinol Diabetes 2000; 108: 378-381.
- Vierhapper H, Novotny P, Waldhausl W. et al. Effect of endothelin-1 in man:impact on basal and adrenocorticotropin-stimulated concentrations of aldosterone. J Clin Endocrinol Metab 1995; 80:948-951.
- Rossi GP, Belloni AS, Nussdorfer GG et al. Endothelin-1 and the adrenal gland. J Cardiovasc Pharmacol 2000; 35 (Suppl 2): S17-S20.
- Polderman KH, Stehouwer CDA, van Kamp GJ. et al. Influence of sex hormones on plasma endothelin levels. Ann Intern Med 1993; 118:429-432.
- Van Kesteren PJ, Kooistra T, Lansink M. et al. The effects of sex steroids on plasma levels of marker proteins of endothelial cell functioning. Thromb Haemost 1998; 79:1029-1033.
- Oishi S, Sasaki M, Sato T. Elevated immunoreactive endothelin levels in patients with pheochromocytoma. Am J Hypertens 1994; 7: 717-722.
- Veglio F, Melchio R, Rabbia F. et al. Plasma immunoreactive endothelin-1 in primary hyperaldosteronism. Am J Hypertens 1994; 7: 559-561.
- Letizia C, Centanni M, Scuro L. et al. High plasma levels of endothelin-1 in untreated Addison\'s disease. Eur J Endocrinol 1996;135: 696-699.
- Kanyicska B, Burris TP, Freeman ME Endothelin-3 inhibits prolactin and stimulates LH, FSH and TSH secretion from pituitary cell culture. Biochem Biophys Res Commun 1991; 174:338-343.
- Furudate S, Masaki Y, Muto T. Induction of ovulation by endothelin-3 in rats. J Endocrinol 1994; 141:109-112.
- Naruse M, Naruse K, Demura H. Recent advances in endothelin research on cardiovascular and endocrine systems. Endocrinol J 1994; 41:491-507.
- Maggi M, Barni T, Fantoni G. et al. Expression and biological effects of endothelin-1 in human gonadotropin-releasing hormone-secreting neurons. J Clin Endocrinol Metab 2000; 85:1658-1665.
- Haak T, Marz W, Jungmann E. et al. Elevated endothelin levels in patients with hyperlipoproteinemia. Clin Invest 1994; 72: 580-584. 27.Yanagisawa M, Kurihara H, Kimura S. et al. A novel potent vasoconstrictor peptide produced by vascular endothelial cells. Nature 1988; 332:411-415.
- Tan KC, Shiu SW, Pang RW. Et al. Effects of testosterone replacement on HDL subfractions and apolipoprotein A-I containing lipoproteins. Clin Endocrinol 1998; 48:187-194.
- Murakami O, Takahashi K, Sone M. et al. An ACTH-secreting bronchial carcinoid: presence of corticotropin-releasing hormone, neuropeptid Y and endothelin-1 in the tumor tissue. Acta Endocr 1993; 128: 192-196.
- Lange M, Pagotto U, Hopfner U. et al. Endothelin expression in normal human anterior pituitaries and pituitary adenomas. J Clin Endocrinol Metab 1994; 79: 1864-1870.
- Ruschitzka F, Luescher T. Endothelin: culprit or bystander in Addison\'s disease Eur J Endocrinol 1996; 135: 645-648.
- Haynes WG, Webb DJ: Endothelin as a regulator of cardiovascular function in health and disease. J Hypertens 1998; 16: 1081-1098.
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC





 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a:

