





 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: Patrocinio y reconocimiento
Patrocinio y reconocimiento
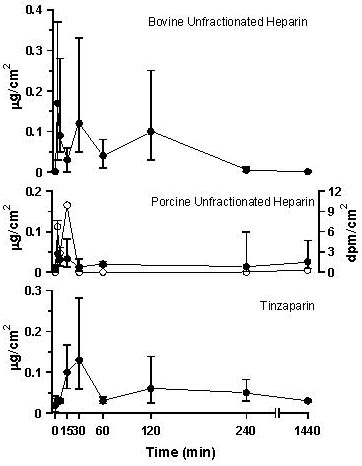
Figura 1. Heparina hallada en el endotelio tras la administración de 60 mg/kg de heparina bovina no fraccionada, heparina no fraccionada porcina de la mucosa marcada con 14C, o tinzapariana a través de una sonda gástrica. Se muestran la media ± SEM de los valores por intervalo de tiempo de 3 a 6 ratas. El endotelio fue extraído de la aorta torácica a través de la aplicación de una película de celulosa sobre la superficie endotelial y de GAG cuando posteriormente fueron extraídos por la digestión de pronasa o acetona. Los extractos fueron sometidos a electroforesis sobre gel de agarosa seguida por la coloración con azul de toluidina. Los GAG fueron identificados por la distancia de desplazamiento y sus cantidades determinadas por densitometría. La película de acetato de celulosa fue añadida a una solución de centelleo y se cuantificó cuando se radiomarcó con 14C.
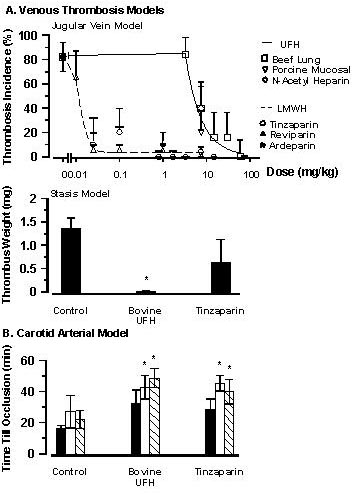
Figura 2. Actividad antitrombótica en modelos murinos de trombosis tras la administración oral de heparinas. En el modelo de la vena yugular, la adventicia de esta vena fue expuesta a 10% de formalina en 65% de metanol. Inmediatamente, las ratas fueron tratadas con heparinas no fraccionadas o de bajo peso molecular a través de una sonda gástrica y se estudió la vena para evaluar la presencia de trombos 4 horas después. Se muestran las incidencias porcentuales de los tapones estables más los intervalos de confianza del 95%. En el modelo de estasis, el trombo fue removido luego de 10 minutos tras la inyección de factor tisular en la vena peneana. Las heparinas se administraron en dosis de 7.5 mg/kg para la heparina bovina no fraccionada y de 0.1 mg/kg para la tinzaparina una hora antes de la iniciación del trombo. Los coágulos fueron secados por 24 horas antes de ser pesados. Se muestran los valores de las medias ± SEM , *p < 0.05 para los tratados con heparina versus los controles (ANOVA de 1 vía). En la figura 2B, las heparinas fueron administradas en dosis de 7.5 mg/kg para las heparinas no fraccionadas y de 0.1 mg/kg para la tinzaparina 2, 5 y 25 horas previas a la iniciación del trombo tras la aplicación de un papel de filtro embebido en 30% de cloruro férrico en la adventicia de la arteria carótida expuesta. Un medidor de flujo registró el flujo sanguíneo a lo largo de un período de 60 minutos para determinar el tiempo para la oclusión (TO).* p < 0.05 tratados con heparina versus los controles combinados (ANOVA de 1 vía).Nuestros estudios más recientes muestran que las heparinas administradas de forma oral son también efectivas en el modelo de trombosis de la arteria carótida en las ratas.75 A través de una sonda estomacal se administró HNF bovina (7.5 mg/kg), tinzaparina (0.1 mg/kg) y solución fisiológica a las 2, 5 y 25 horas previas a la iniciación del trombo. El tiempo hasta la oclusión (TO) aumentó significativamente tanto para la HNF como para la tinzaparina cuando se administraron a las 5 y a las 25 horas pero no a las 2 horas previas. No hubo diferencias en el TO entre los grupos tratados con HNF y tinzaparina (figura 2B). Se observó predisposición para reducir el tamaño del trombo con la HNF a las 5 y a las 25 horas previas y, para la tinzaparina, a las 5 horas antes de la iniciación del trombo (ANOVA de 1 vía).75 Por lo tanto, las heparinas administradas de forma oral son agentes antitrombóticos efectivos tanto en los modelos arteriales como venosos.