





 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: Patrocinio y reconocimiento
Patrocinio y reconocimiento

Figura 1. Como la esfinge, el espectro del cáncer de testículo amenaza la vida de hombres jóvenes. Como en el mito, el acertijo del cáncer de testículo tiene solución. Edipo y la Esfinge, Jean August Dominique Ingres (1780-1867), Galería Nacional de Londres.El acertijo del cáncer de testículo

Figura 2: Estructura de la ocratoxina A. Es una micotoxina producida por Aspergillus y Penicillium. Se encuentra en los cereales enmohecidos y en los animales que los consumen, como el cerdo. Los cereales, la carne porcina y los granos de café suelen estar contaminados por OTA. La exposición a OTA en seres humanos está ampliamente diseminada. Muestras de sangre provenientes de Dinamarca resultaron positivas para OTA en un porcentaje cercano al 50%.Cómo puede la ocratoxina resolver el acertijo

Tabla 1. Los coeficientes de correlación entre la incidencia del cáncer de testículo por país y el consumo per capita de alimentos potencialmente contaminados por la ocratoxina A. El N para cada comparación refleja el número de observaciones apareadas disponibles en este estudio.La r de Pearson para el consumo per capita de cereales, café y carne porcina se muestra en la tabla 1. La correlación con cebada, centeno, trigo y maíz no fue significativa. Se observó correlación significativa para el consumo per capita de café y carne de cerdo (r = 0.49 y 0.54, p = 0.03 y p = 0.01, respectivamente).
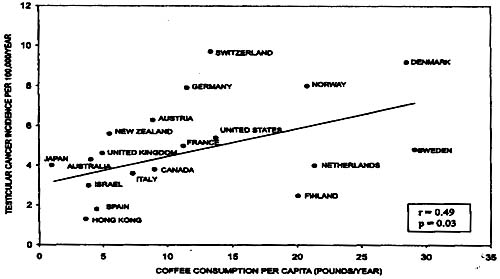
Figura 3. Gráfico de dispersión de la incidencia de cáncer de testículo en 19 países vs. el consumo per capita de café.
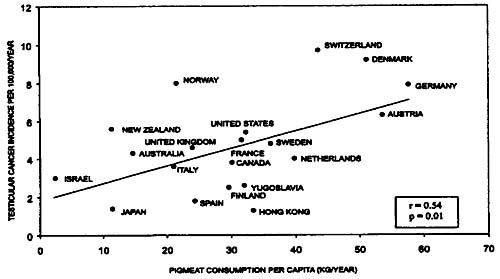
Figura 4. Gráfico de dispersión de la incidencia de cáncer de testículo en 19 países vs. el consumo per capita de carne porcina.Estos datos tienen algunas limitaciones, incluidas aquellas que son comunes en las planillas de equilibrio alimentario y los datos ecológicos. Por ejemplo, las planillas de equilibrio alimentario no ofrecen información acerca de los alimentos manufacturados que contienen diversos ingredientes básicos, como el pan de centeno. Estos factores podrían haber limitado nuestra habilidad para detectar una correlación significativa entre el cáncer de testículo y el consumo de cereales. Utilizamos el consumo per capita de alimentos que contienen OTA como una medida indicativa de la exposición a esta toxina. Este enfoque es conservador ya que asume que la exposición diferencial a la OTA es consecuencia de las diferencias en los niveles de consumo de alimentos contaminados por OTA más que de las diferencias en los niveles de contaminación por OTA en estos alimentos. A pesar de esto, observamos correlaciones significativas entre el consumo per capita de café y carne porcina en 20 países y la incidencia de cáncer de testículo (figuras 3 y 4). El hecho de que estos artículos se seleccionaran a priori y de que sólo se utilizara un número pequeño de pruebas estadísticas, sugiere que estas correlaciones no son simplemente el resultado de comparaciones múltiples.

Figura 5. Modelo conceptual de la hipótesis de la ocratoxina A como causa del cáncer de testículo.Las oportunidades para estudios futuros