OPTIMIZACION DE LA MARCACION DE BIOMOLECULAS CON 188RE-MAG3 DE USO POTENCIAL EN RADIOINMUNOTERAPIA
(especial para SIIC © Derechos reservados)
Coautores
Esteban Obenaus* Silvia Gómez de Castiglia**
Licenciado en Ciencias Químicas UBA. Comisión Nacional de Energía Atómica*
Licenciada en Ciencias Químicas UBA. Comisión Nacional de Energía Atómica**
Recepción del artículo: 14 de julio, 2004
Aprobación: 12 de octubre, 2004
 Conclusión breve
En la presente actualización se hace referencia a resultados obtenidos en nuestro laboratorio al aplicar y optimizar los procedimientos de marcación de anticuerpos con 188Re-MAG3 usando como modelo inmunoglobulina policlonal humana (IgG) y se evalúan parámetros que son críticos en radioinmunoterapia, como el rendimiento de marcación, la actividad específica, la pureza radioquímica y la estabilidad in vitro del anticuerpo marcado.
Conclusión breve
En la presente actualización se hace referencia a resultados obtenidos en nuestro laboratorio al aplicar y optimizar los procedimientos de marcación de anticuerpos con 188Re-MAG3 usando como modelo inmunoglobulina policlonal humana (IgG) y se evalúan parámetros que son críticos en radioinmunoterapia, como el rendimiento de marcación, la actividad específica, la pureza radioquímica y la estabilidad in vitro del anticuerpo marcado.
 Resumen
Los anticuerpos monoclonales (AcMo) son vehículos potencialmente aptos para el transporte de radionucleidos emisores β hasta células que poseen un antígeno asociado al tumor. Este es el principio de la aplicación clínica de la radioinmunoterapia (RIT). En la presente actualización se hace referencia a resultados obtenidos en nuestro laboratorio al aplicar y optimizar los procedimientos de marcación de anticuerpos con 188Re-MAG3 usando como modelo inmunoglobulina policlonal humana (IgG) y se evalúan parámetros que son críticos en RIT, como el rendimiento de marcación, la actividad específica, la pureza radioquímica y la estabilidad in vitro del anticuerpo marcado. Se discuten las ventajas y desventajas del método directo de marcación con 188Re. Se mencionan además los últimos resultados de la marcación con 188Re-MAG3 del AcMo murino antimelanoma 14f7 y de su evaluación in vivo, en particular su acumulación en el tumor en función del tiempo. También se propone un nuevo derivado de biotina marcado con 188Re-MAG3 de uso potencial en RIT de tres pasos (basada en el sistema avidina/biotina radiomarcada) para aumentar la relación dosis tumor/fondo.
Resumen
Los anticuerpos monoclonales (AcMo) son vehículos potencialmente aptos para el transporte de radionucleidos emisores β hasta células que poseen un antígeno asociado al tumor. Este es el principio de la aplicación clínica de la radioinmunoterapia (RIT). En la presente actualización se hace referencia a resultados obtenidos en nuestro laboratorio al aplicar y optimizar los procedimientos de marcación de anticuerpos con 188Re-MAG3 usando como modelo inmunoglobulina policlonal humana (IgG) y se evalúan parámetros que son críticos en RIT, como el rendimiento de marcación, la actividad específica, la pureza radioquímica y la estabilidad in vitro del anticuerpo marcado. Se discuten las ventajas y desventajas del método directo de marcación con 188Re. Se mencionan además los últimos resultados de la marcación con 188Re-MAG3 del AcMo murino antimelanoma 14f7 y de su evaluación in vivo, en particular su acumulación en el tumor en función del tiempo. También se propone un nuevo derivado de biotina marcado con 188Re-MAG3 de uso potencial en RIT de tres pasos (basada en el sistema avidina/biotina radiomarcada) para aumentar la relación dosis tumor/fondo.
 Palabras clave
188Re-MAG3-AcMo, anticuerpos radiomarcados, radioinmunoterapia, 188Re-MAG3, derivados de biotina
Clasificación en siicsalud
Palabras clave
188Re-MAG3-AcMo, anticuerpos radiomarcados, radioinmunoterapia, 188Re-MAG3, derivados de biotina
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/69293
Especialidades
 Principal: Medicina Nuclear, Oncología,
Principal: Medicina Nuclear, Oncología,
 Relacionadas: Bioquímica, Inmunología,
Relacionadas: Bioquímica, Inmunología,
 Enviar correspondencia a:
Enviar correspondencia a:
José Luis Crudo. Presbítero Gonzales y Aragón núm 15 (B1802AYA) Ezeiza. Centro Atómico Ezeiza. Buenos Aires. Argentina Crudo, José Luis
OPTIMIZATION OF LABELLING OF BIOMOLECULES WITH 188RE-MAG3 FOR POTENTIAL USE IN RADIOIMMUNOTHERAPY
 Abstract
Abstract
Monoclonal antibodies (MoAb) are suitable vehicles to transport and to deliver β-emitters radionuclides to tumour associated antigens from malignant cells. This is the basis of the clinical application of radioimmunotherapy (RIT). In the present paper, we refer to results obtained in our laboratory to optimize the procedures of labelling antibodies with 188Re-MAG3 using IgG as a model. In this paper we evaluate critical parameters in RIT as labelling yield, specific activity, radiochemical purity and in vitro stability of the radioantibody. We discuss the advantages and drawbacks of the direct method of labelling with 188Re. We refer to the last results published in labelling of antimelanoma MoAb 14f7 with 188Re-MAG3 and its in vivo evaluation, particularly its tumour accumulation. We propose a new 188Re-MAG3-biotin derivative for potential use in three step RIT (based on avidin/biotin system) to improve the target/non- target dose ratio.
 Key words
Key words
188Re-MAG3-MoAb, radiolabelled antibodies, radioimmunotherapy, 188Re-MAG3, biotin derivatives
OPTIMIZACION DE LA MARCACION DE BIOMOLECULAS CON 188RE-MAG3 DE USO POTENCIAL EN RADIOINMUNOTERAPIA
(especial para SIIC © Derechos reservados)
Artículo completo
Introducción
Los anticuerpos monoclonales (AcMo) son vehículos potencialmente aptos para el transporte y entrega de radionucleidos emisores β a células tumorales dada su elevada especificidad y afinidad por un determinado antígeno asociado al tumor.1 Este es el principio de la aplicación clínica de la radioinmunoterapia (RIT), que desde hace algunos años se viene aplicando en forma experimental a tumores sólidos y que fue aprobada recientemente por la Food and Drug Administration (FDA) para la aplicación clínica a linfomas no Hodgkin.
El desafío de tratar tumores sólidos estimuló a los grupos de investigación y desarrollo a implementar nuevas estrategias para incrementar la dosis de radiación entregada y obtener una mejor distribución de la radiación ionizante. El objetivo final es la entrega de dosis tumoricidas que resguarden los tejidos sanos, en particular la médula ósea, que en RIT tradicional es el órgano limitante de la dosis (dosis máxima tolerable o MTD de 150 a 200 cGy) debido a la lenta depuración sanguínea de los AcMo marcados. Una de las estrategias más exitosas desarrolladas y que hace años se aplica en pacientes oncológicos es la RIT basada en el sistema avidina/biotina, que será explicada en detalle más adelante.
La variedad de radionucleidos emisores β de alta energía de uso potencial en RIT es amplia y comprende itrio 90 (90Y) (Emáx 2.28 MeV, t1/2 2.7 d), lutecio 177 (Emáx 0.5 MeV, t1/2 6.7 d), samario 153 (Emáx 640, 710 y 810 Kev, t1/2 46.8 h), yodo 131 (Emáx 0.6 MeV, t1/2 8 d) y renio 188 (188Re) (Emáx 2.11 MeV, t1/2 17 h); donde Emáx es la energía máxima de la emisión beta negativa (son electrones acelerados a enormes velocidades) que está asociada con el rango máximo de la partícula y t ½ es el período de semidesintegración del radionucleido, es decir el tiempo que tarda en alcanzar la mitad de la actividad inicial. Para el 188Re, el rango máximo de la partícula es de 11 mm, lo cual lo hace muy apropiado para la irradiación de tumores grandes y no apto para el tratamiento de micrometástasis.
Entre las ventajas comparativas que posee el 188Re cabe mencionar su obtención in situ apartir de un generador 188W/188Re lo que permite tener disponibilidad permanente y obtener un producto sin portador, a diferencia de los otros radionucleidos antes mencionados (salvo el 90Y) que son producidos en reactor nuclear y que poseen portador. Además, el 188Re tiene asociada una emisión gamma de 155 KeV con una abundancia del 15.88%, lo cual permite la obtención de imágenes centellográficas en cámara gamma.
Existe cierta similitud entre la química del 188Re y del tecnecio 99m (99mTc) (el radionucleido para diagnóstico más ampliamente usado en radiofarmacia), por lo que se buscó adaptar para el 188Re las técnicas de marcación ya existentes para el 99mTc. En general, estos métodos de marcación se dividen en directos e indirectos. En los primeros, el radionucleido previamente reducido se une a los grupos sulfhidrilos producidos a partir de la reducción de puentes disulfuro endógenos de la proteína. En los indirectos existen dos variantes: a) el radionucleido reducido se une a un agente quelante bifuncional (BFCA) previamente conjugado a la biomolécula (marcación del preconjugado) y b) el radionucleido reducido se compleja con un BFCA y luego se produce un éster activo del BFCA radiomarcado que se conjuga finalmente a la biomolécula (técnica del quelante premarcado). Es importante destacar que para cada radionucleido hay BFCA específicos que son los que determinan el método de marcación óptimo para una biomolécula y la estabilidad in vitro e in vivo de la biomolécula marcada. Estos BFCA no siempre son productos comerciales y por tanto se debe encarar su síntesis orgánica, lo cual aumenta las complicaciones. En nuestro caso nos restringimos a utilizar un BFCA de tipo comercial, el S-benzoil-mercaptoacetiltriglicina (S-benzoíl-MAG3) (figura 1), que es un derivado de un radiofármaco usado como agente renal marcado con 99mTc.

Figura 1. Estructura química del S-benzoíl-MAG3.
Objetivos
En la presente actualización se hace referencia a resultados obtenidos en nuestro laboratorio al aplicar y optimizar los procedimientos de marcación de anticuerpos con 188Re-MAG3 (figura 2) usando como modelo inmunoglobulina policlonal humana (IgG) y se evalúan parámetros que son críticos en RIT, como el rendimiento de marcación, la actividad específica, la pureza radioquímica y la estabilidad in vitro del anticuerpo marcado. Se discuten las ventajas y desventajas del método directo de marcación con 188Re. Se mencionan además los últimos resultados de la marcación con 188Re-MAG3 del AcMo murino antimelanoma 14f7 y de su evaluación in vivo, en particular su acumulación en el tumor en función del tiempo. También se describe una estrategia actualmente en curso (RIT basada en el sistema avidina/biotina radiomarcada) para aumentar la relación dosis tumor/fondo.

Figura 2. Estructura química del 188Re-MAG3.
Materiales y métodos
El procedimiento optimizado de marcación con 188Re-MAG3 consta de tres etapas. Brevemente: 1) Reducción del 188ReO4- eluido del generador en solución fisiológica usando SnCl2.2H2O y marcación del S-benzoíl-MAG3 por calentamiento durante 30 min a 90ºC bajo atmósfera de nitrógeno. 2) Esterificación del 188Re-MAG3 usando 2,3,5,6-tetrafluorofenol (TFP) y 1-etil-3-(3-dimetilaminopropil)-carbodiimida (EDC) para obtener el éster activo 188Re-MAG3-TFP (figura 3) y purificación através de un cartucho Sep-Pack C-18. 3) Conjugación del éster activo purificado a los grupos amino de la IgG (PM 150 000) a distintas relaciones molares éster:IgG y posterior purificación del 188Re-MAG3-IgG por cromatografía líquida de alta resloución (HPLC) usando una columna de permeación de geles. La descripción detallada del método optimizado se encuentra publicada.2 Se realizaron estudios in vitro e in vivo. En un trabajo posterior, actualmente en prensa en Journal of Radioanalytical and Nuclear Chemistry,3 se marcó por esta técnica el AcMo antimelanoma 14f7 de origen murino y se hicieron estudios de biodistribución en ratones portadores del melanoma murino B16f0 a diferentes tiempos posinyección. En otro trabajo realizado en colaboración con el Instituto Europeo de Oncología y el H.S. Raffaele (Milán, Italia) se aplicó esta misma técnica a la marcación de un nuevo derivado sintético de biotina de tipo comercial.4
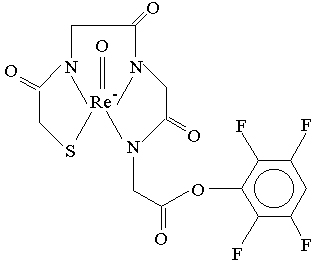
Figura 3. Estructura química del 188Re-MAG3-TFP.
Resultados
Sintéticamente, optimizamos la técnica de preconjugación en la cual el 188Re-MAG3 es primero activado químicamente para obtener un éster activo (188Re-MAG3-TFP), el cual seguidamente se hace reaccionar con los grupos amino libres de los anticuerpos (IgG y AcMo 14f7) o de un derivado síntético de biotina (norbiotinamina).
Los rendimientos de marcación optimizados con 188Re-MAG3 para las biomoléculas (IgG, AcMo 14f7 y norbiotinamina) fueron de 62.1%, 43.3% y 72.2%, respectivamente. Las actividades específicas máximas 61.4 MBq/mg, 90.3 MBq/mg y 141.4 MBq/μmol. La pureza radioquímica, previamente a la purificación, 80%, 46.9% y 75%. El 188Re-MAG3-IgG fue estable en solución fisiológica (SF) a 24 h (96.2%) y tuvo captación favorable en sitios de inflamación focalizada,2 mientras que 188Re-MAG3-AcMo 14f7 fue menos estable en SF a 20 h (80%) y mostró captación elevada y acumulación positiva en el tumor.3 El 188Re-MAG3-norbiotinamina se unió en un 60% a un exceso de avidina y el complejo formado permaneció estable en SF a las 18 h.4
Discusión y conclusiones
Como fuera consignado en Materiales y métodos, para la reducción del 188Re y posterior complejación del 188Re reducido al S-benzoyl-MAG3, la mezcla de reacción debe ser calentada por 30 min a 90ºC. A esta temperatura, sin embargo, no es posible la marcación de MAG3-IgG (o MAG3-AcMo) con 188Re debido a la desnaturalización de la proteína y a la consecuente pérdida de inmunorreactividad que impediría su posterior utilización en RIT. La técnica del quelante premarcado no es apropiada para la obtención de un kit de AcMo de marcación instantánea, pero no conlleva a la desnaturalización proteica (dado que la conjugación se realiza a temperatura ambiente) y produce complejos con estabilidad in vitro superior a los obtenidos por método directo. Este último permite la formulación de un kit, aunque no de marcación instantánea, dado que se necesitan hasta 3 horas para una marcación eficiente y produce una gran disminución en la inmunorreactividad del AcMo.5
Una ventaja adicional de la técnica del quelante premarcado consiste en su versatilidad, lo que hace posible –una vez obtenido el 188Re-MAG3-TFP– marcar derivados de biotina (de uso en RIT), péptidos (para radioterapia mediada por receptores peptídicos, PRRT) y, obviamente, AcMos.
Nuestros estudios de estabilidad in vitro con IgG marcada muestran que el 96.2% y el 85.5% de la actividad permaneció unida a la IgG cuando fue incubada en SF y en suero humano a temperatura ambiente por 24 horas, respectivamente.2
Nosotros encontramos una elevada relación PI/PN a todos los tiempos siguientes a la administración de 188Re-MAG3-IgG en ratones con inflamación. Esas relaciones a 24 y 48 hs. (4.5 y 4.6, respectivamente) fueron más elevadas que aquellas relaciones PI/PN obtenidas para 99mTc-IgG policlonal (2.0), informadas previamente por nuestro grupo usando métodos de marcación tanto directos como indirectos.2
El 188Re-MAG3-IgG tuvo un patrón de excreción similar al del 99mTc-MAG3-IgG. Bajos niveles de radioactividad se observaron en el estómago, coincidentes con la ausencia de perrenato libre y con la estabilidad de la IgG marcada, como se observa en los ensayos in vitro.
El 188Re-MAG3-AcMo 14f7 mostró la máxima acumulación 12.1% D.I./g (porcentaje de la dosis inyectada por gramo de tumor) en ratones tumorados a las 24 hs. posinyección.
Una consecuencia no deseada de la utilización de AcMo marcados para RIT de tumores sólidos es su lenta depuración sanguínea, lo que produce una elevada dosis en médula ósea.
Como comentamos anteriormente, una estrategia perfeccionada de la RIT tradicional, empleada clínicamente en varios centros europeos de excelencia, es la RIT basada en la interacción entre avidina y biotina,6 la cual tiene una constante de afinidad del orden de Ka = 1015 M-1. Esta estrategia se completa en tres pasos: 1) administración de un AcMo-biotinado. 2) Veinticuatro horas más tarde, cuando el AcMo-biotinado alcanzó la máxima acumulación en el tumor, se administra avidina (proteína formada por cuatro subunidades con capacidad para unirse cada una a una molécula de biotina) para depurar el anticuerpo circulante y unirse al AcMo-biotinado localizado en el tumor. 3) Finalmente, 48 horas más tarde, se administra biotina marcada con un emisor β. De esta forma se disocia el reconocimiento antigénico realizado por el AcMo-biotinado (targeting) de la entrega de la dosis (delivery) por la biotina radiomarcada que se realiza 48 hs. después, cuando ya el AcMo-biotinado desapareció de los tejidos normales y se acumuló mayormente en el tumor. El clearence sanguíneo de la biotina radiomarcada es veloz y por consiguiente disminuye la dosis recibida por órganos no blanco (especialmente médula ósea que, como ya hemos mencionado, en RIT tradicional es el órgano limitante de la dosis). Comparado con los AcMo radiomarcados, este método produce relaciones tumor/sangre y tumor/blanco más elevadas originadas en que tres biotinas radiomarcadas pueden unirse a cada molécula de avidina unida al AcMo en la superficie de la célula tumoral. Paganelli y col. fueron los pioneros en la aplicación de esta técnica usando 90Y-DOTA-biotina y en un estudio clínico de fase I/II en gliomas de alto grado obtuvieron resultados esperanzadores.7 Como consecuencia de varias becas de entrenamiento realizadas junto a él y su grupo, es que se trató de implementar la marcación de un nuevo derivado de biotina con 188Re-MAG3, de potencial uso en RIT. Entre las razones sopesadas para migrar del 90Y al 188Re consideramos de vital importancia la disponibilidad (que en el caso de tener un generador es permanente) y el costo (una dosis de 90Y equivale al costo de un generador de 188Re que se puede eluir por varios meses).

Figura 4. Estructura química de la biotina (vitamina H). Como se observa, no posee ningún grupo amino (NH2) donde se pueda conjugar el 188Re-MAG3-TFP.

Figura 5. La biocitina posee una unión amido entre el grupo carboxilo de la biotina y el grupo amino en posición ε de la lisina, que se hidroliza por efecto de la biotinidasa.
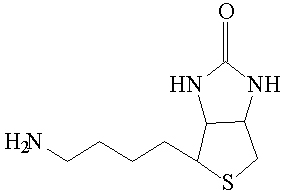
Figura 6. Estructura química de la norbiotinamina, derivado sintético de la biotina en el que se encuentra un grupo amino en la posición que normalmente ocupa el grupo carboxilo en la biotina.
La biotina (figura 4) no tiene grupos amino a los cuales poder conjugar un BFCA marcado. Por tanto, con la técnica del quelante premarcado solo se pueden marcar derivados de biotina que poseen grupos amino terminales, como biocitina (ε-biotinil-L-lisina) (figura 5) y norbiotinamina (figura 6). En suero humano se halla presente una enzima llamada biotinidasa que hidroliza la unión amido, haciendo desaconsejable la utilización de biocitina radiomarcada en RIT, que por efecto de esa enzima se hidrolizaría dando lisina-BFCA radiomarcada y biotina. Sin embargo, experimentalmente, cuando la unión amido está invertida, por ejemplo entre el grupo amino de un derivado de biotina y el carboxilo de un BFCA, casi no hay catálisis enzimática. En un esfuerzo por tratar de obtener un producto con una unión amido invertida estable frente a la biotinidasa, condición necesaria para su aplicación en RIT, se realizó la marcación de norbiotinamina con188Re-MAG3. En ensayos preliminares este producto mostró unión a avidina4 y resultó ser más estable in vitro que otros derivados de biotina radiomarcados evaluados.8
Los autores no manifiestan conflictos.
 Bibliografía del artículo
Bibliografía del artículo
- Goldenberg DM. Targeted therapy of cancer with radiolabeled antibodies. J Nucl Med. 2002, 43(5):693-713.
- Crudo JL, Edreira M, Obenaus E y col. Optimization of antibody labeling with rhenium-188 using a prelabeled MAG3 chelate. Int J Pharm. 2002, 248(1-2):173-182.
- Crudo JL, Edreira M, Obenaus E y col. Labeling of the anti-melanoma 14f7 monoclonal antibody with Rhenium-188-MAG3 chelate: conjugation optimization, in vitro stability and animal studies. J Radioanal Nuc Chem, en prensa.
- Crudo JL, Sudati F, Chinol M y col. Preparation of 188Re-norbiotinamine using S-benzoyl-MAG3 as chelating agent. Technetium, Rhenium and other metals in chemistry and nuclear chemistry, SGEditoriali, Padova. 2002, 6:563-565.
- Griffiths GL, Goldenberg DM, Knapp FF Jr y col. Direct radiolabeling of monoclonal antibodies with generator-produced rhenium-188 for radioimmunotherapy: labeling and animal biodistribution studies. Cancer Res. 1991; 51:4594-4602.
- Cremonesi M, Ferrari M, Chinol M y col. Three-step radioimmunotherapy with yttrium-90 biotin: dosimetry and pharmacokinetics in cancer patients. Eur J Nucl Med. 1999, 26:110-120.
- Paganelli G, Grana C, Chinol M y col. Antibody-guided three-step therapy for high grade glioma with yttrium-90 biotin. Eur J Nucl Med, 1999, 26:348-357.
- Sudati F, Crudo JL, Fabro A y col. High radiochemical purity of 188-Re-MAG3 biotin conjugates Using S-benzoyl-MAG3 as chelating agent. Quart J Nuc Med. 2002, 46:(supl. 4) (abstract).
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC





 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a:




