




 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: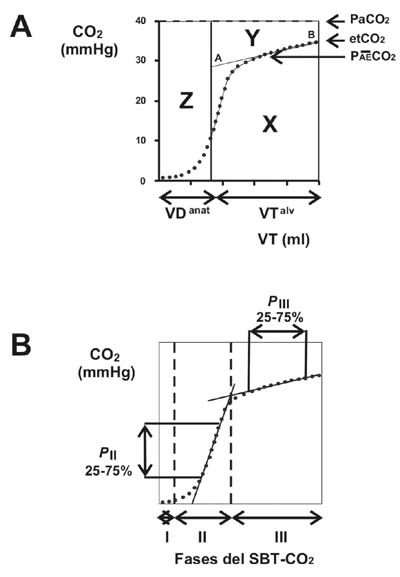
Figura 1. A) La capnografía volumétrica (CV): Clásica división del espacio muerto; Z = espacio muerto anatómico (VDanat), Y = espacio muerto alveolar (VDalv) y X = área bajo la curva o volumen espirado de CO2 (VTCO2,br). El espacio muerto fisiológico (VDfisiol) está constituido por la suma del área Z + Y. VTalv es el volumen corriente alveolar. La PAECO2 representa la presión parcial media de CO2 en el gas alveolar, definido como el punto medio de la línea A-B (mm Hg). La línea superior del gráfico está determinada por el valor de PaCO2. El etCO2 es la presión parcial de CO2 al final de la espiración. B) Fases y pendientes de la CV: La fase I representa la porción libre de CO2 en la vía aérea proximal, comenzando desde el inicio de la espiración y terminando cuando se detecta una concentración de CO2 mayor que 0.1% en el gas espirado. La fase II representa la interfase entre el gas de la vía aérea y el alveolar, comenzando desde una concentración de CO2 mayor que 0.1% hasta la intercepción de las pendientes de las fases II y III. La fase III o alveolar se extiende desde esta intersección hasta el final de la espiración. Los volúmenes de cada fase se normalizan con el volumen corriente dando las variables Vol I/VT, Vol II/VT y Vol III/VT. Las pendientes de fases II y III son calculadas por regresión lineal de los datos numéricos recolectados entre 25%-75% de la correspondiente fase (%/L). La pendiente de fase III de cada CV se normaliza dividiendo el valor de la pendiente por su correspondiente fracción alveolar media de CO2. El límite entre el VDanat y el VDalv se calculó utilizando el método de Fowler,12 determinado por una línea que atraviesa la mitad de la pendiente de fase II (50% de los puntos que constituyen matemáticamente dicha pendiente).Se describieron numerosos índices derivados de la curva de capnografía volumétrica con el fin de determinar distintos fenómenos fisiológicos y patológicos. En la figura 1 se describen los índices utilizados por el autor. Cabe destacar que el EM no es un valor “estático” sino todo lo contrario, es un valor dinámico que se modifica por numerosas causas. El cambio en las diversas variables derivadas de la CV otorga al médico una herramienta clínica importante a la hora de evaluar la función pulmonar.
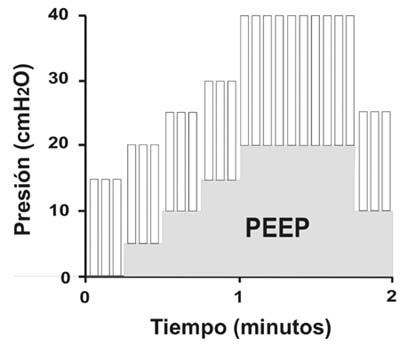
Figura 2. Representación esquemática de la estrategia de reclutamiento alveolar (ERA). Los rectángulos representan el volumen corriente. En ventilación controlada por presión se incrementa el nivel de presión positiva al final de la espiración (PEEP) en escalones de 5, 10, 15 y 20 cm H2O cada 3-5 ciclos respiratorios a una frecuencia respiratoria entre 12’ y 15’ y una relación I:E de 1:1. La presión de amplitud (presión inspiratoria pico = PIP menos PEEP) se incrementa a 20 cm H2O en el último escalón de PEEP, para lograr una presión en la vía aérea de 40/20 cm H2O durante 10 ciclos respiratorio. Luego de estos 10 ciclos de reclutamiento máximo se retorna a la ventilación basal adicionando un nivel de PEEP que supere la presión crítica de colapso pulmonar.Datos clínicos
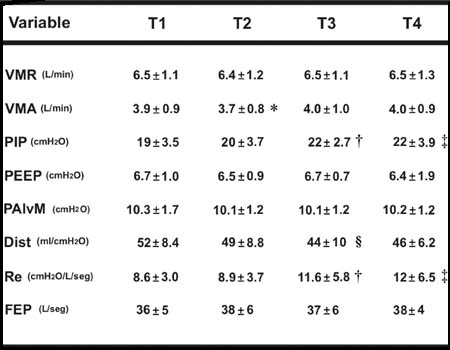
Tabla I. Mecánica respiratoria durante la cirugía cardíaca. VMR = volumen minuto respiratorio, VMA = volumen minuto alveolar, PIP = presión inspiratoria pico, PEEP = presión positiva al final de la espiración, PalvM = presión alveolar media, Dist = distensibilidad respiratoria dinámica, Re = resistencia espiratoria y FEP = flujo espiratorio pico. T1 = tórax cerrado antes de la circulación extracorpórea (CEC), T2 = tórax abierto antes de la CEC, T3 = tórax abierto luego de la CEC y T4 = cierre esternal después de la CEC. * T2 vs. T1-3-4, p < 0.05; † ; T3 vs. T1-2, p < 0.05; ‡ ; T4 vs. T1-2, p < 0.05 y § ; T3 vs. T1, p < 0.05.El edema pulmonar post-CEC parece ser el factor responsable de esta alteración en la distensibilidad y la resistencia respiratoria. El edema tisular asociado al cierre esternal induce un colapso pulmonar adicional al que se observa tras la inducción anestésica, especialmente en la vía aérea. Estos resultados coinciden con los obtenidos por Fletcher y col.28 en un protocolo similar.
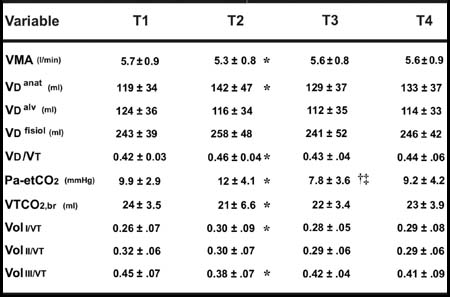
Tabla II. El espacio muerto durante la cirugía cardíaca. VMA = volumen minuto alveolar, VDanat = espacio muerto anatómico, VDalv = espacio muerto alveolar, VDfisio = espacio muerto fisiológico, VD/VT = relación entre el espacio muerto fisiológico y el volumen corriente (calculado con la ecuación de Bohr modificada por Enghoff,5 donde VDfisio/VT = PaCO2 – PAECO2/PaCO2), Pa-etCO2 = diferencia entre la presión parcial de CO2 arterial y la presión parcial de CO2 al final de la espiración, VTCO2,br = volumen espirado de CO2 por respiración y Vol I, II y III/VT = relación entre el volumen de fase I, II y III y el volumen corriente respectivamente. T1 = tórax cerrado antes de la circulación extracorpórea (CEC), T2 = tórax abierto antes de la CEC, T3 = tórax abierto luego de la CEC y T4 = cierre esternal después de la CEC. * T2 vs. T1, p < 0.05; † ; T 3 vs. T1, p < 0.05 y ‡ ; T3 vs. T2, p < 0.05.Es interesante observar que el EM anatómico disminuyó ligeramente después de la CEC con el tórax abierto (T3), quizá debido a reducción en el diámetro de la vía aérea inducido por la acumulación de edema en sus paredes.30
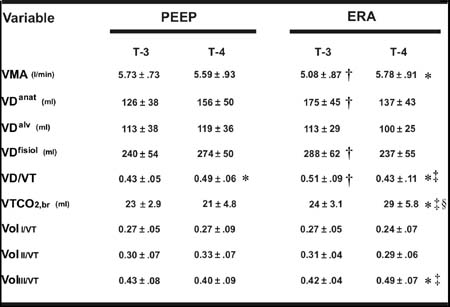
Tabla III. Efecto del reclutamiento pulmonar sobre la capnografía volumétrica. VMA = volumen minuto alveolar, VDanat = espacio muerto anatómico, VDalv = espacio muerto alveolar, VDfisio = espacio muerto fisiológico, VTCO2,br = volumen espirado de CO2 por respiración, VD/VT = relación entre el espacio muerto fisiológico y el volumen corriente. Vol I, II y III/VT = relación entre el volumen de fase I, II y III y el volumen corriente, respectivamente. T3 = tórax abierto luego de la circulación extracorpórea (CEC) y T4 = cierre esternal después de la CEC. * T3 vs. T4 mismo grupo, p < 0.05; † T3 ERA vs. T3 PEEP, p < 0.05; ‡ T4 ERA vs. T4 PEEP p < 0.05 y § T4 ERA vs. T3 PEEP, p < 0.05.Los resultados demuestran que el efecto fisiológico del PEEP aislado (sin reclutamiento) es muy diferente al de la ERA. Se puede postular que estos cambios en la CV observados con la ERA están causados por una distribución más homogénea de la ventilación y en un aumento en el área de intercambio gaseoso.
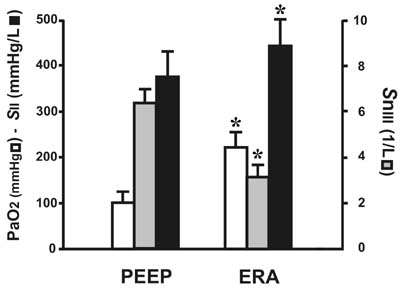
Figura 3. Presión parcial de oxígeno arterial (PaO2, mm Hg), pendiente de la fase II (SII, %/L) y pendiente de la fase III normalizada (SnIII, 1/L) en el grupo PEEP y con la estrategia de reclutamiento alveolar (ERA). Se estudiaron dos momentos después de la circulación extracorpórea: T-3 con el tórax abierto y T-4 luego del cierre esternal. * ERA contra PEEP, p < 0.05.Conclusiones