EVALUACION PREOPERATORIA DE LOS TUMORES CEREBRALES SOLITARIOS Y MALIGNOS MEDIANTE ESPECTROSCOPIA POR RESONANCIA MAGNETICA Y RESONANCIA MAGNETICA DE DIFUSION PONDERADA
(especial para SIIC © Derechos reservados)
Coautor
Inanc Guvenc*
Radiologist. Gulhane Military Medical Academy, Department of Radiology.*
Recepción del artículo: 4 de enero, 2005
Aprobación: 1 de abril, 2005
 Conclusión breve
Las imágenes por resonancia magnética de difusión ponderada pueden aportar información adicional a las obtenidas mediante espectroscopia por resonancia magnética para diferenciar y estadificar los tumores cerebrales.
Conclusión breve
Las imágenes por resonancia magnética de difusión ponderada pueden aportar información adicional a las obtenidas mediante espectroscopia por resonancia magnética para diferenciar y estadificar los tumores cerebrales.
 Resumen
Se evaluaron en forma prospectiva 111 pacientes con tumores cerebrales malignos y solitarios (55 gliomas de bajo grado, 31 de alto grado, y 25 metástasis). Los gliomas fueron clasificados como de bajo y alto grado según NAA/Cho, Cho/Cr, Lac/Cr y CDANT (p < 0.001). Un grado mayor de malignidad se asoció con Cho/Cr (r = 0.648; p < 0.001); Lac/Cr (r = 0.583; p < 0.001); NAA/Cho (r = -0.657; p < 0.001); y CDANT (r = -0.473; p < 0.001). Mientras que CDANT, Lip/Cr (p < 0.001), NAA/Cho, Lac/Cr, CDANP y Cho/Cr (p < 0.05) pudieron diferenciar las metástasis de los gliomas de bajo grado; NAA/Cho, Cho/Cr, Lip/Cr (p < 0.001), NAA/Cr, Lac/Cr y CDANP (p < 0.05) pudieron diferenciarlas de los gliomas de alto grado. Excepto por la relación Lip/Cr (p < 0.05), ningún parámetro resultó de utilidad para diferenciar los gliomas de alto grado entre sí. Los gliomas no astrocíticos de bajo grado tuvieron relaciones Cho/Cr significativamente más elevadas que los astrocitomas de bajo grado (p < 0.05). Además, los astrocitomas pilocíticos tuvieron relaciones NAA/Cho significativamente más elevadas pero menores CDANP que los astrocitomas difusos y los gliomas no astrocíticos de bajo grado. Los astrocitomas difusos también presentaron relaciones Lip/Cr más elevadas que los de tipo pilocítico, los gliomas no astrocíticos de bajo grado y los anaplásicos. En la diferenciación de los subgrupos tumorales, la correlación de Pearson más elevada se halló en la relación Lip/Cr (r = 0.685; p < 0.001), NAA/Cho (r = -0.567; p < 0.001), CDANP (r = 0.522; p < 0.001), Lac/Cr (r = 0.437; p < 0.001) y Cho/Cr (r = 0.395; p < 0.001). La espectroscopia por resonancia magnética y las imágenes de difusión ponderada pueden aportar información adicional a las imágenes obtenidas mediante resonancia magnética para la diferenciación y estadificación de los tumores cerebrales malignos.
Resumen
Se evaluaron en forma prospectiva 111 pacientes con tumores cerebrales malignos y solitarios (55 gliomas de bajo grado, 31 de alto grado, y 25 metástasis). Los gliomas fueron clasificados como de bajo y alto grado según NAA/Cho, Cho/Cr, Lac/Cr y CDANT (p < 0.001). Un grado mayor de malignidad se asoció con Cho/Cr (r = 0.648; p < 0.001); Lac/Cr (r = 0.583; p < 0.001); NAA/Cho (r = -0.657; p < 0.001); y CDANT (r = -0.473; p < 0.001). Mientras que CDANT, Lip/Cr (p < 0.001), NAA/Cho, Lac/Cr, CDANP y Cho/Cr (p < 0.05) pudieron diferenciar las metástasis de los gliomas de bajo grado; NAA/Cho, Cho/Cr, Lip/Cr (p < 0.001), NAA/Cr, Lac/Cr y CDANP (p < 0.05) pudieron diferenciarlas de los gliomas de alto grado. Excepto por la relación Lip/Cr (p < 0.05), ningún parámetro resultó de utilidad para diferenciar los gliomas de alto grado entre sí. Los gliomas no astrocíticos de bajo grado tuvieron relaciones Cho/Cr significativamente más elevadas que los astrocitomas de bajo grado (p < 0.05). Además, los astrocitomas pilocíticos tuvieron relaciones NAA/Cho significativamente más elevadas pero menores CDANP que los astrocitomas difusos y los gliomas no astrocíticos de bajo grado. Los astrocitomas difusos también presentaron relaciones Lip/Cr más elevadas que los de tipo pilocítico, los gliomas no astrocíticos de bajo grado y los anaplásicos. En la diferenciación de los subgrupos tumorales, la correlación de Pearson más elevada se halló en la relación Lip/Cr (r = 0.685; p < 0.001), NAA/Cho (r = -0.567; p < 0.001), CDANP (r = 0.522; p < 0.001), Lac/Cr (r = 0.437; p < 0.001) y Cho/Cr (r = 0.395; p < 0.001). La espectroscopia por resonancia magnética y las imágenes de difusión ponderada pueden aportar información adicional a las imágenes obtenidas mediante resonancia magnética para la diferenciación y estadificación de los tumores cerebrales malignos.
 Palabras clave
Neoplasias cerebrales, diagnóstico diferencial, resonancia magnética, espectroscopia por resonancia magnética, difusión ponderada
Clasificación en siicsalud
Palabras clave
Neoplasias cerebrales, diagnóstico diferencial, resonancia magnética, espectroscopia por resonancia magnética, difusión ponderada
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/71876
Especialidades
 Principal: Diagnóstico por Imágenes, Neurología,
Principal: Diagnóstico por Imágenes, Neurología,
 Relacionadas: Medicina Interna, Neurocirugía,
Relacionadas: Medicina Interna, Neurocirugía,
 Enviar correspondencia a:
Enviar correspondencia a:
Nail Bulakbasi, M.D. Associate Professor of Radiology. Gulhane Military Medical Academy, Department of Radiology. Etlik, 06018 Ankara, Turquía.
PREOPERATIVE EVALUATION OF SOLITARY MALIGNANT BRAIN TUMORS WITH MR SPECTROSCOPY AND DIFFUSION WEIGHTED IMAGING
 Abstract
Abstract
One hundred eleven patients with solitary malignant brain tumors (55 low-, 31 high-grade gliomas, and 25 metastases) were prospectively evaluated. Gliomas classified as low- and high-grade by NAA/Cho, Cho/Cr, Lac/Cr and NADCT (p < 0.001). Higher degree of malignancy was associated with Cho/Cr (r = 0.648, p < 0.001), Lac/Cr (r = 0.583, p < 0.001), NAA/Cho (r = -0.657, p < 0.001) and NADCT (r = -0.473, p < 0.001). While NADCT, Lip/Cr (p < 0.001), NAA/Cho, Lac/Cr, NADCP and Cho/Cr (p < 0.05) could differentiate metastases from low-grade gliomas; NAA/Cho, Cho/Cr, Lip/Cr (p < 0.001), NAA/Cr, Lac/Cr and NADCP (p < 0.05) could differentiate them from high-grade gliomas. Except Lip/Cr ratio (p < 0.05), no parameter was useful to differentiate high grade gliomas from each other. Low-grade non-astrocytic gliomas had significantly higher Cho/Cr ratios than low-grade astrocytomas (p < 0.05). Furthermore pilocytic astrocytomas had significantly higher NAA/Cho and lesser NADCP than diffuse astrocytomas and low-grade non-astrocytic gliomas. Diffuse astrocytomas had also higher Lip/Cr than pilocytic astrocytomas, low-grade non-astrocytic gliomas and anaplastic astrocytomas. In the differentiation of tumor subgroups, highest Pearson correlation was found in Lip/Cr (r = 0.685, p < 0.001), NAA/Cho (r = -0.567, p < 0.001), NADCP (r = 0.522, p < 0.001), Lac/Cr (r = 0.437, p < 0.001) and Cho/Cr (r = 0.395, p < 0.001). MR spectroscopy and diffusion weighted images can support additional information to MR imaging in the differentiation and grading of malignant brain tumors.
 Key words
Key words
Brain neoplasms, differential diagnosis, magnetic resonance imaging, MR spectroscopy, diffusion weighted imaging
EVALUACION PREOPERATORIA DE LOS TUMORES CEREBRALES SOLITARIOS Y MALIGNOS MEDIANTE ESPECTROSCOPIA POR RESONANCIA MAGNETICA Y RESONANCIA MAGNETICA DE DIFUSION PONDERADA
(especial para SIIC © Derechos reservados)
Artículo completo
El diagnóstico de los tumores cerebrales malignos solitarios intraaxiales mediante resonancia magnética (RM) es siempre problemático porque todos los tumores muestran intensidad de señal elevada en las imágenes ponderadas en T2 con refuerzo variable del contraste de la neoplasia y edema vasogénico peritumoral leve a moderado. Aunque las imágenes de RM pueden caracterizar de mejor forma la localización y la extensión del tumor, ni el patrón de refuerzo ni los cambios en la señal T2 son diagnósticos de un tipo tumoral específico.1,2 Además, el patrón de refuerzo del tumor no está relacionado con el grado tumoral porque dicho refuerzo se debe principalmente a la interrupción de la barrera hematoencefálica y no a la propia proliferación vascular tumoral.3,4 Por lo general es insuficiente para la diferenciación y la estadificación de los tumores cerebrales malignos, las cuales son imprescindibles para el planeamiento exacto del tratamiento, y la única posibilidad para mejorar el mal pronóstico.5,6 La espectroscopia por RM y la RM de difusión ponderada (DP) han sido empleadas por mucho tiempo para el diagnóstico diferencial y para la estadificación tumoral.7-40 En este estudio se analizó prospectivamente en 111 pacientes la eficacia diagnóstica de la espectroscopia por RM y RMDP para la diferenciación y la estadificación de los tumores cerebrales malignos solitarios con sospecha de neoplasia cerebral.
Métodos
Población de pacientes
Ciento once pacientes con tumores cerebrales solitarios primarios y metastáticos, 69 de ellos de sexo masculino y 42 mujeres, con edades comprendidas entre 11 y 87 años (edad promedio: 47.8 años) fueron evaluados de forma prospectiva mediante RM, espectroscopia por RM y RMDP durante el período comprendido entre 2000 y 2004. Se evaluaron 24 personas sanas (15 hombres y 9 mujeres, de entre 21 y 62 años [edad promedio: 40.3 años) que conformaron el grupo control. El procedimiento diagnóstico se efectuó en todos los participantes, en una sesión única, de 1 a 10 días antes del procedimiento quirúrgico. Los diagnósticos radiológicos se confirmaron, en todos los casos, mediante anatomía patológica de la pieza de resección o de la biopsia según el número y localización de sus lesiones en partes vitales o significativas del cerebro. Los pacientes no recibieron tratamiento con esteroides antes de la evaluación por RM. En todos los casos se obtuvo el consentimiento informado para la realización de RM y para la revisión de sus historias clínicas y sus imágenes.
Evaluación por RM
En todos los participantes las imágenes se obtuvieron con equipos superconductores de 1.5 teslas (Magnetom Vision Plus, Siemens, Erlangen, Alemania, y The New Intera Nova, Philips Medical Systems, Best, Países Bajos) con bobina de cabeza en cuadratura estándar. Las imágenes axiales ponderadas en T1 con spin-echo (TR/TE 650/14 ms, una excitación), las ponderadas en T2 spin-echo (TR/TE 2 295/90 ms, dos excitaciones) y con secuencia FLAIR (recuperación de la inversión rápida de líquidos atenuada) (TR/TE/TI 9 000/2 500/110 ms, una excitación) fueron realizadas con cortes de 5 mm y con 1 mm de brecha de intersección, con un campo de visión de 220 x 220 mm y con una matriz de 256 x 256. Luego de la administración intravenosa de 0.2 mg/kg de gadodiamida (Omniscan, Amersham Health, Irlanda), se obtuvieron las imágenes T1 con refuerzo de contraste en tres planos ortogonales.
Evaluación por espectroscopia por RM
Se emplearon técnicas espectroscópicas simples (en 46 pacientes) o multivóxel (en 65 casos) en función de cada caso, de acuerdo con el tamaño, localización y tipo de tumor. Los datos espectroscópicos obtenidos provinieron principalmente de partes grasosas con metabolismo activo (áreas con realce por el contraste) de las lesiones, y se evitó la contaminación proveniente de la grasa del cuero cabelludo. Además, se obtuvieron datos espectroscópicos de regiones anatómicas comparables en los 24 controles de la misma edad.
Se lograron el calce automático apropiado y la supresión del agua con el empleo de un ancho de línea de 4-8 Hz, un ancho espectral de 1 KHz y el software desarrollado por los fabricantes. Los datos espectroscópicos de vóxeles simples se obtuvieron a partir de volúmenes de 1.5 x 1.5 x 1.5 cm3 a 2 x 2 x 3 cm3 con el uso de secuencias espectrocópicas con puntos spin-echo dobles con 1 500/135 ms TR/TE, promedio 128-256, 1 024 puntos de datos y 4 000 Hz de ancho espectral. En el examen por multivóxeles, los datos espectrales se consiguieron con el empleo del método de selección del volumen ECHO con TE/TR de 136/2 000 ms, 1 024 filas, campo de visión de 225 x 225 mm, ancho de banda espectral de 1 050 Hz y 3 factores turbo.
El posprocesamiento de los datos espectroscópicos se aplicó de acuerdo con lo descrito con anterioridad, con inclusión del cambio de frecuencia, y correcciones basales lineales y de fase de acuerdo con la transformada de Fourier.7 Las curvas de frecuencia fueron ajustadas a un modelo gaussiano de líneas con el empleo del software provisto por el fabricante para definir los valores máximos de N-acetil aspartato (NAA), de compuestos que contienen colina (Cho), y de creatina y fosfocreatina (Cr). Los picos metabólicos empleados en la diferenciación de los tipos tumorales fueron los siguientes: NAA 2.02 ppm; Cho 3.22 ppm; Cr 3.01 ppm; compuestos que contienen lípidos (Lip) entre 0.9 y 1.3 ppm, y lactato (Lac) 1.35 ppm (un doblete beta-metilo invertido). Los valores integrales máximos se normalizaron al pico de Cr interno. Se calcularon las relaciones metabólicas NAA/Cho, NAA/Cr, Cho/Cr, Lac/Cr y Lip/Cr. Debido a que en 46 pacientes se empleó una técnica espectroscópica con vóxeles simples, para el análisis estadístico solo se emplearon los índices de la RM por espectroscopia obtenidas del núcleo tumoral.
Evaluación de imágenes con DP
Se obtuvieron imágenes de difusión ponderada con el empleo de secuencias SE axiales de cortes múltiples ecoplanares de un solo disparo mediante la utilización de los siguientes parámetros: TE 91 ms, TR más corto entre 4 200 y 4 300 ms, una excitación, ancho de banda de 1 833.3 Hz/píxel, factor ecoplanar 89, 22 cortes de 5 mm de espesor sin brecha de intersección, tamaño de matriz de 112 x 256, y campo de visión de 220 x 220 mm. Estas imágenes por difusión fueron adquiridas mediante el empleo de al menos tres valores b de 0, 500 y 1 000 s/m2 aplicados en las direcciones de fase (P), medición (M) y selección de cortes (S). Se agregó calce automático y recuperación de la inversión espectral de saturación (spectral saturation inversion recovery [SPIR]) para eliminar el cambio entre la interfase acuosa y grasa. El tamaño del vóxel por medición en las direcciones M, P y S fue de 2.05 mm, 2.58 mm y 5 mm, respectivamente. El tamaño del vóxel reconstruido en las mismas direcciones fue de 0.90 mm, 0.90 mm y 5 mm, también en forma respectiva. El procesamiento posterior de las imágenes DP isotrópicas a partir de las tres direcciones principales diferentes se obtuvo con el empleo de la fórmula:
imagen DP = (|P|.|M|.|S|)1/3
con el empleo de programas de computación estándar.41 El cálculo del coeficiente de difusión aparente (CDA) se basó en la fórmula:
S(b)/S(b= 0) = exp (valor -b x CDA)
donde S(b) representa la intensidad de la señal con el gradiente de difusión; S(b= 0) es la intensidad de la señal sin el gradiente de difusión; el valor -b es el factor de atenuación en s/mm2, y CDA es el coeficiente de difusión aparente en mm2/s.41 Los mapas CDA se calcularon sobre la base píxel por píxel.
Posición de la región de interés
Para la demostración exacta de la heterogeneidad tumoral, se seleccionaron al menos cinco regiones uniformes de interés de entre 10 y 20 mm2 de áreas diferentes del núcleo tumoral, de áreas peritumorales con señal elevada y áreas “espejo” con apariencia normal.9 En todos los casos, las regiones tumorales y peritumorales fueron definidas de acuerdo con las características de las imágenes.7-9 El valor CDA medio de cada región de interés se grabó automáticamente de los mapas CDA y se expresó como 10-3 mm2/s. Luego del registro de los valores CDA de las áreas tumorales y peritumorales, los obtenidas de regiones en espejo con apariencia normal del tumor en el mismo paciente se grabaron como valores CDA de la sustancia blanca normal. Todos los valores CDA medidos fueron normalizados (CDAN) mediante la división de los valores CDA tumorales y peritumorales con las cifras CDA normales para obtener los valores CDAN del núcleo tumoral (CDANT) y del área peritumoral (CDANP) para la realización del análisis estadístico.
Clasificación histológica
Las muestras obtenidas en los procedimientos quirúrgicos se fijaron en formalina y fueron remitidas para la tinción rutinaria con hematoxilina-eosina y para inmunohistoquímica. Se registró la presencia de pleomorfismo, atipia, mitosis, necrosis, astrogliosis e infiltración macrofágica para cada uno de los pacientes. Con propósitos estadísticos, todos los tumores se clasificaron en: gliomas de bajo grado (grados I y II), alto grado (III y IV) y metástasis. Posteriormente se los subdividió de acuerdo con el tipo y grado histológicos según la clasificación de la OMS del año 2000.42
Análisis estadístico
Los datos se analizaron con pruebas t de muestras independientes asumiendo varianzas desiguales o análisis de varianza (ANOVA) multivariado con mediciones repetidas y el procedimiento post hoc no direccional de Tamhane, también con adopción de varianzas no iguales cuando fue apropiado para corregir por el efecto de comparaciones múltiples entre los tipos tumorales, mediante la versión 11.0 del programa SPSS (SPSS para Windows; SPSS Inc., Chicago, IL, Estados Unidos). Se probó la correlación entre los diferentes parámetros con la prueba de Pearson de dos colas. La diferencia media se consideró significativa a un nivel de p de 0.05.
Resultados
Hallazgos histopatológicos
Cincuenta y cinco (49.55%) de los 111 tumores cerebrales malignos solitarios intraaxiales fueron clasificados como de bajo grado, 31 (27.93%) como gliomas de alto grado y 25 (22.52%) como metástasis. La distribución de los subgrupos tumorales se muestra en la tabla 1.

Grados
La estadística descriptiva de los valores medios de los parámetros de los diferentes grupos de tumores se muestra en la tabla 2. De acuerdo con lo que se puede observar en la tabla 3, los cocientes NAA/Cho, Cho/Cr y Lac/Cr, y los valores CDANT fueron significativamente efectivos para la estadificación de los tumores gliales primarios como de bajo grado (figura 1) y alto grado (figura 2) (p < 0.001). El mayor grado de malignidad se asoció en forma lineal con cocientes Cho/Cr (r = 0.648; p < 0.001) y Lac/Cr (r = 0.583; p < 0.001) más elevados, y se asoció inversamente con cocientes NAA/Cho (r = -0.657; p < 0.001) y valores de CDANT (r = -0.473; p < 0.001) más elevados. No se detectaron valores de corte precisos para la determinación exacta del grado tumoral.

Figura 1. Hombre de 38 años con astrocitoma de bajo grado en la región occipito-pariteal izquierda. a. La imagen con secuencia FLAIR muestra un tumor hiperintenso con edema leve.
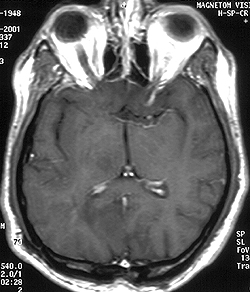
b. La imagen ponderada en T1 no muestra realce.

c. En la imagen de mapeo CDA el tumor presenta una intensidad de señal marcadamente superior que la sustancia blanca contralateral. Los valores calculados de CDANT (1.25) y de CDANP (1.43) indican tumor maligno de bajo grado.

d. La espectroscopia por RM muestra un cociente NAA/Cho (= 0.60) ligeramente disminuido sin ningún pico de lactato prominente.

Figura 2. Hombre de 28 años con glioblastoma multiforme en la unión frontoparietal. a. Tumor hiperintenso en la sustancia blanca cortical y subcortical, presenta edema “en huella digital” prominente en la imagen con FLAIR axial.

b. En la imagen ponderada en T1 el tumor muestra realce del contraste heterogéneo, con cavidad necrótica en la parte posterior del tumor.

c. En la imagen con mapeo CDA el tumor es hipointenso en relación con la sustancia blanca; sus valores de CDANT (0.84) y de CDANP (1.57) ayudan a diferenciarlo de los tumores malignos de bajo grado pero no de las metástasis.

d. La espectroscopia por MR muestra un descenso prominente en los niveles de NAA y aumento en los de Cho (NAA/Cho = 0.21; Cho/Cr = 5.43) y lactato (Lac/Cr = 1.55). La ausencia de un pico prominente de Lip, con un cociente Lip/Cr bajo (1.14) ayuda a diferenciarlo de una metástasis.
Diferenciación
Como se muestra en la tabla 3, en la diferenciación de las metástasis (figura 3) de los gliomas de bajo grado, el valor CDANT y la relación Lip/Cr fueron los parámetros más efectivos. Los cocientes NAA/Cho, Lac/Cr, CDANP y Cho/Cr resultaron menos efectivos que el valor CDANT y que Lip/Cr (p < 0.05). A diferencia de los gliomas de bajo grado, la diferenciación de las metástasis de los gliomas de alto grado fue más problemática y más importante que la de los tumores de bajo grado. Los índices de la espectroscopia por RM, así como los cocientes NAA/Cho, Cho/Cr y Lip/Cr (p < 0.001) tuvieron mayor efectividad que los NAA/Cr y Lac/Cr (p < 0.05). Mientras que el cálculo de CDANT no fue tan efectivo en la diferenciación, las metástasis tienen valores de CDANP más elevados que los gliomas de alto grado (p < 0.05).

Figura 3. Mujer de 48 años con metástasis cerebral por cáncer de mama en el lóbulo frontal posterior izquierdo. a. En la imagen con FLAIR el tumor necrótico muestra una señal de alta intensidad con notable edema peritumoral.
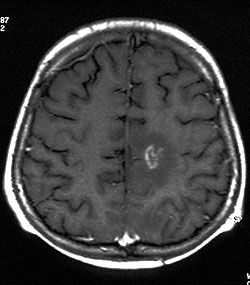
b. Imagen ponderada en T1 que muestra realce anular irregular.
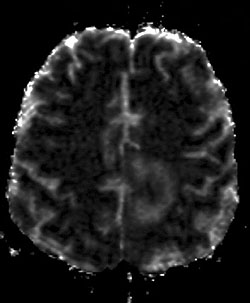
c. El tumor presenta una intensidad de señal similar a la sustancia blanca cerebral, con edema peritumoral hiperintenso en la imagen de mapeo CDA. Los valores calculados de CDANT (1.08) y de CNADP (1.67) ayudan a difrenciarlo de los tumores malignos de bajo grado, pero no de los de alto grado.

d. Los picos de lípidos prominentes ayudan a diferenciar las metástasis de otros tumores malignos primarios.

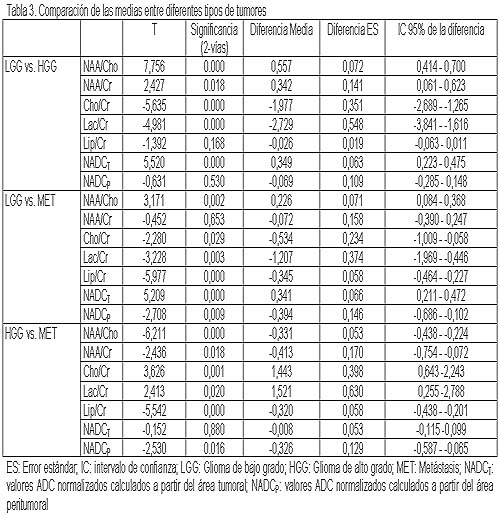
Como se puede observar en las tablas 4 y 5, tanto los parámetros de la espectroscopia como los de las imágenes DP resultaron menos efectivos en la diferenciación de subtipos tumorales que tuvieron el mismo grado glial. Además de la relación Lip/Cr (p < 0.05), no se pudo detectar ningún parámetro para la diferenciación entre los gliomas de alto grado. Por otra parte, los gliomas no astrocitarios de bajo grado presentaron relaciones Cho/Cr más altas que los astrocitomas de bajo grado (p < 0.05). Además, los de tipo pilocítico tuvieron cifras de NAA/Cho significativamente más elevadas y menores valores de Cho/Cr y de CDANP que los astrocitomas difusos. En los astrocitomas pilocíticos también se evidenciaron relaciones de NAA/Cho significativamente más altas y valores de CDANP más bajos que en los astrocitomas difusos. Estos últimos presentaron una relación Lip/Cr más alta que los astrocitomas pilocíticos, los gliomas no astrocitarios de bajo grado y los anaplásicos. A no ser por estos datos, no se detectó significación para efectuar una diferenciación adicional. En la diferenciación de los subgrupos tumorales se encontró la correlación de Pearson más elevada entre el tipo de tumor y la relación Lip/Cr (r = 0.685; p < 0.001), seguida de NAA/Cho (r = 0.567; p < 0.001), CDANP (r = 0.522; P < 0.001), Lac/Cr (r = 0.437; p < 0.001) y Cho/Cr (r = 0.395; p < 0.001), en orden decreciente.


Discusión
La causa más frecuente de discrepancia entre los diagnósticos radiológicos e histopatológicos es la realización de la biopsia en sitios inapropiados. Por esta razón, el mapeo tumoral que muestra heterogeneidad es la parte más importante del diagnóstico preoperatorio del tumor, tanto para la estadificación exacta como para la diferenciación. Aunque la espectroscopia por RM presenta baja resolución espacial, la heterogeneidad del tumor puede ser demostrada con claridad ya sea con el empleo de técnicas espectroscópicas por RM multivóxel, las cuales permiten una resolución espacial suficiente en mapas metabólicos, o mediante las imágenes DP. En especial, NAA, Cho y los mapas CDA son muy útiles para detectar la parte más maligna del tumor, lo cual es crucial para la determinación exacta del grado.
Las RM convencionales pueden detectar con facilidad los tumores y sus complicaciones, pero carecen de la posibilidad de realizar diagnósticos diferenciales exactos y estadificación tumoral. La RM por espectroscopia nos puede brindar información metabólica sobre la naturaleza del tumor, lo que refleja la integridad y la función del tejido neuronal, así como la destrucción y necrosis de la arquitectura tisular.7,8,10,11,15,16 Mientras que el descenso de los valores NAA/Cho y NAA/Cr representa pérdida de la integridad y de la función de las neuronas, el incremento de los cocientes Cho/Cr refleja el incremento del recambio de las membranas y la liberación de Cho no unidos provocada por la destrucción de las neuronas durante los procesos malignos, los cuales están asociados de manera lineal con mayor grado tumoral.10,11,15,16 Como se informó previamente, el incremento de las relaciones Lac/Cr y Lip/Cr presenta una buena correlación lineal con el grado de malignidad.7,8,10,11,15,16,25-28 La presencia de lactato es el indicador de la falta de función de la respiración oxidativa normal y del incremento de la glucólisis anaeróbica,23 y está representada como pérdida de tejido neuronal normal y necrosis en las RM.7,11 La relación Lip/Cr es el único parámetro de diferenciación de las metástasis de otros tumores malignos primarios.7 Como se informó previamente,7,8,14-16 el incremento en los niveles de lípidos es el indicador de glucólisis anaeróbica y es, por lo general, considerable en los gliomas de alto grado y en las metástasis. Se correlaciona bien con la extensión de la necrosis celular, pero su ausencia no las descarta.27 La señal promedio en el espectro TE-largo es mayor en las metástasis que en el glioblastoma multiforme, lo que indica posiblemente una diferencia en el tiempo de relajación en T2.28
Aunque estos parámetros son bastante efectivos para la diferenciación entre gliomas de alto y bajo grado, aportan muy poca información para la diferenciación adicional. A excepción de la relación Lip/Cr, no existe un parámetro estadísticamente significativo para diferenciar los gliomas de alto grado entre sí. El motivo principal es que los gliomas de alto grado tienen tasas de recambio de proliferación celular más elevadas que los de bajo grado. Aunque los gliomas de grado IV tienen mayor proliferación vascular, mitosis y necrosis que los de grado III, las necrosis macroscópicas y microscópicas más elevadas provocan una dilución relativa de las concentraciones de los metabolitos y un descenso de los valores CDANT debido a una reducción en la densidad celular.7-9,15,16,26 Esta declinación natural de los parámetros estadísticos poco claros de los gliomas de alto grado no nos permitió la estadificación y la diferenciación adicionales entre los subgrupos tumorales de estos gliomas. Por otro lado, es posible diferenciar los gliomas de bajo grado entre sí. En especial, los astrocitomas pilocíticos tienen relaciones Cho/Cr y valores CDANP menores que los que se encuentran en los astrocitomas difusos y en los gliomas no astrocitarios de bajo grado. Las cifras menores en los cocientes Cho/Cr reflejan que los astrocitomas pilocíticos tienen un recambio celular menor que los gliomas de grado II. Los valores significativamente más bajos de CDANP de los astrocitomas pilocíticos son resultado de la naturaleza circunscrita de estos tumores, a diferencia de la característica infiltrativa de otros gliomas de grado II.42
El cálculo de CDANT es también efectivo para la estadificación de los gliomas. Los de bajo grado presentan cifras de este parámetro significativamente más altas que los de alto grado debido a que la malignidad de los tumores cerebrales y su actividad proliferativa y migratoria depende también de la capacidad de los tumores para crear espacio para las células que migran al destruir el tejido circundante.32 El movimiento microscópico molecular del agua puede cambiar en el tejido tumoral debido a alteraciones estructurales –las cuales son resultado de la destrucción de la arquitectura neuronal–, al incremento en la celularidad del tumor –la cual provoca la disminución del espacio intersticial–, y al edema vasogénico –que causa el aumento del compartimiento extracelular y cancela o anula el incremento en la celularidad.29-34 Los principales hallazgos histológicos de los gliomas de bajo grado son el polimorfismo celular moderado con figuras mitóticas o proliferación vascular endotelial escasa o ausente.42 Estos tumores moderadamente celulares con conexiones destruidas o laxas han ensanchado el espacio extracelular, lo que lleva al incremento de la difusión de los protones del agua con cifras más elevadas de CDA.9 En los gliomas de alto grado, muy anaplásicos y celulares con un polimorfismo prominente, aunque el espacio celular tiene más ensanchamiento, la difusión aparente de las moléculas de agua en el espacio extracelular está estrictamente restringida por la densidad de las células tumorales y sus productos de destrucción.9,32 El aumento de la tortuosidad debido al incremento del contenido de moléculas en el espacio extracelular puede enlentecer el CDA sin cambios en el volumen de dicho espacio debido al aumento de las barreras de difusión en el ambiente tumoral.32 Los valores CDANT de los gliomas de alto grado y de las metástasis son similares debido a la naturaleza sumamente destructiva de ambos tumores y son significativamente más elevados que los de las neoplasias cerebrales de bajo grado. A diferencia de los valores CDANT, los de CDANP no resultan de utilidad en la determinación del grado debido a que ambos tipos de gliomas (de bajo y alto grado) tienen infiltración peritumoral y edema vasogénico que provoca un incremento en estos últimos valores; si bien los gliomas de alto grado presentaron cifras más altas que los de bajo grado, la diferencia no es significativa. Por otra parte, las metástasis tienen valores de CDANP mayores que ambos grados de gliomas. Aunque no se pudieron detectar puntos de corte para la determinación exacta del grado tumoral y de la diferenciación, éstos son determinantes muy útiles del grado tumoral y pueden usarse con facilidad en la práctica diaria en combinación con la RM.
La RM es la modalidad de elección para el diagnóstico de los tumores cerebrales. Las técnicas de RM adicionales como la espectroscopia y las imágenes con DP pueden mejorar su eficacia diagnóstica, en la determinación del grado o en la diferenciación de estos tumores. Estas son técnicas prácticas, que están disponibles comercialmente, no consumen demasiado tiempo y aportan información valiosa en todos los sistemas T 1.5 y pueden llevarse a cabo con simplicidad en la práctica diaria. Aunque son bastante útiles para la estadificación y la diferenciación, son siempre interpretadas con la RM y entre ellas para la obtención de resultados óptimos.
Los autores no manifiestan “conflictos de interés”.
 Bibliografía del artículo
Bibliografía del artículo
- Law M, Yang S, Wang H, et al. Glioma grading: Sensitivity, specificity, and predictive values of perfusion MR imaging and proton MR spectroscopic imaging compared with conventional MR imaging. AJNR Am J Neuroradiol 2003; 24:1989-1998.
- Knopp EA, Cha S, Johnson G, et al: Glial neoplasms: dynamic contrast- enhanced T2 weighted MR imaging. Radiology 1999; 211:791-798.
- McKnight TR, Von dem Bussche MH, Vigneron DB. Histopathological validation of a three-dimensional magnetic resonance spectroscopy index as a predictor of tumor presence. J Neurosurg 2002; 97:794-802.
- Schwartz RB. Neuroradiology of brain tumors. Neurol Clin 1995; 13:723-756
- Kaba SE, Kyritsis AP. Recognition and management of gliomas. Drugs 1997; 53:235-244.
- Watanabe M, Tanaka R, Takeda N. Magnetic resonance imaging and histopathology of cerebral gliomas. Neuroradiology 1992; 34:463-469.
- Bulakbasi N, Kocaoglu M, Ors F, et al. Combination of single voxel proton MR spectroscopy and apparent diffusion coefficients calculation in the evaluation of common brain tumors. AJNR Am J Neuroradiology 2003; 24:225-233.
- Bulakbasi N. Clinical applications of proton MR spectroscopy in the diagnosis of brain tumours. Spectroscopy Int J 2004; 18:143-153.
- Bulakbasi N, Guvenc I, Onguru O, et al. The added value of the apparent diffusion coeficient calculation to magnetic resonance imaging in the differentiation and grading of malignant brain tumors. J Comput Assist Tomogr 2004; 28:735-746.
- Bruhn H, Frahm J, Gyngell ML, et al. Noninvasive differentiation of tumors with use of localized H-1 MR spectroscopy in vivo: initial experience in patients with cerebral tumors. Radiology 1989; 172:541-548.
- Segebarth CM, Baleriaux DF, Luyten PR, et al. Detection of metabolic heterogeneity of human intracranial tumors in vivo by H-1 NMR spectroscopic imaging. Magn Reson Med 1990; 13:62-76.
- Fulham MJ, Bizzi A, Dietz MJ, et al. Mapping of brain tumor metabolites with proton MR spectroscopic imaging: clinical relevance. Radiology 1992; 185:675-686.
- Baker PB, Glickson JD, Brayn RN. In vivo magnetic resonance spectroscopy of human brain tumors. Top Magn Reson Imaging 1993; 5:32-45.
- Poptani H, Gupta RK, Roy R, et al. Characterization of intracranial mass lesions with in vivo proton MR spectroscopy. AJNR Am J Neuroradiol 1995; 16:1593-1603.
- Castillo M, Kwock L, Mukherji SK. Clinical applications of MR spectroscopy. AJNR Am J Neuroradiol 1996; 17:1-15.
- Castillo M, Kwock L. Proton MR spectroscopy of common brain tumors. Neuroimaging Clin North Am 1998; 8:733-752.
- Meyerand ME, Pipas JM, Mamourian A, et al. Classification of biopsy-confirmed brain tumors using single-voxel MR spectroscopy. AJNR Am J Neuroradiol 1999; 20:117-123.
- Nelson SJ, Vigneron DB, Dillon WP. Serial evaluation of patients with brain tumors using volume MRI and 3D 1H MRSI. NMR Biomed. 1999; 12:123-128.
- Castillo M, Kwock L. Clinical applications of proton magnetic resonance spectroscopy in the evaluation of common intracranial tumors. Top Magn Reson Imaging 1999; 10:104-113.
- Burtscher IM, Skagerberg G, Geijer B, et al. Proton MR spectroscopy and preoperative diagnostic accuracy: An evaluation of intracranial mass lesions characterized by sterotactic biopsy findings. AJNR Am J Neuroradiol 2000; 21:84-93.
- Shimizu H, Kumabe T, Shirane R, et al. Correlation between choline level measured by proton MR spectroscopy and Ki-67 labeling index in gliomas. AJNR Am J Neuroradiol 2000; 21:659-665.
- Castillo M, Smith JK, Kwock L. Correlation of myo-inositol levels and grading of cerebral astrocytomas. AJNR Am J Neuroradiol 2000; 21:1645-1649.
- Kimura T, Sako K, Gotoh T, et al. In vivo single-voxel proton MR spectroscopy in brain lesions with ring-like enhancement. NMR Biomed 2001; 14:339-349.
- Dowling C, Bollen AW, Noworolski SM, et al. Preoperative proton MR spectroscopic imaging of brain tumors: Correlation with histopathologic analysis of resection specimens. AJNR Am J Neuroradiol 2001; 22:604-612.
- Moller-Hartmann W, Herminghaus S, Krings T, et al. Clinical application of proton magnetic resonance spectroscopy in the diagnosis of intracranial mass lesions. Neuroradiology 2002; 44:371-381.
- Kinoshita Y, Yokota A. Absolute concentrations of metabolites in human brain tumors using in vitro proton magnetic resonance spectroscopy, NMR Biomed, 1997; 10:2-12.
- Howe FA, Barton SJ, Cudlip SA, et al. Metabolic profiles of human brain tumors using quantitative in vivo 1H magnetic resonance spectroscopy. Magn Reson Med 2003; 49:223-232.
- Barba I, Cabanas ME, Arus C. The relationship between nuclear magnetic resonance-visible lipids, lipid droplets, and cell proliferation in cultured C6 cells. Cancer Res 1999; 59:1861-1868.
- Brunberg J, Chenevert T, McKeever P, et al. In vivo MR determination of water diffusion coefficients and diffusion anisotropy: correlation with structural alteration in gliomas of the cerebral hemispheres. AJNR Am J Neuroradiol 1995; 16:361-371.
- Tien R, Felsberg G, Friedman H, et al. MR imaging of high-grade cerebral gliomas: value of diffusion weighted echo planar pulse sequences. AJR Am J Roentgenol 1994; 162:671-677.
- Els T, Eis M, Hoehn-Berlage M, et al. Diffusion-weighted imaging of experimental brain tumors in rats. MAGMA 1995; 3:13-20.
- Vargova L, Homola A, Zamecnik J, et al. Diffusion parameters of the extracellular space in human gliomas. Glia 2003; 42:77-88.
- Sugahara T, Korogi Y, Kochi M, et al. Usefulness of diffusion-weighted MRI with echo-planar technique in the evaluation of cellularity in gliomas. J Magn Reson Imaging 1999; 9:53-60.
- Muti M, Aprile I, Principi M, et al. Study on the variations of the apparent diffusion coefficient in areas of solid tumor in high-grade gliomas. Magn Reson Imaging 2002; 20:635-641.
- Kono K, Inoue Y, Nakayama K, et al. The role of diffusion- weighted Imaging in patients with brain tumors. AJNR Am J Neuroradiol 2001; 22:1081-1088.
- Castillo M, Smith JK, Kwock L, et al. Apparent diffusion coefficients in the evaluation of high-grade cerebral gliomas. AJNR Am J Neuroradiol 2001; 22:60-64.
- Krabbe K, Gideon P, Wagn P, et al. MR diffusion imaging of human intracranial tumours. Neuroradiol 1997; 39:483-489.
- Lam WW, Poon WS, Metreweli C. Diffusion MR imaging in glioma: Does it have any role in the pre-operation determination of grading of glioma Clinical Radiology 2002; 57:219-225.
- Gupta RK, Sinha U, Cloughesy TF, et al. Inverse correlation between choline magnetic resonance spectroscopy signal intensity and the apparent diffusion coefficient in human glioma. Magn Reson Med 1999; 41:2-7.
- Stadnik TW, Chaskis C, Michotte A, et al. Diffusion weighted MR imaging of intracerebral masses: comparison with conventional MRI and histologic findings. AJNR Am J Neuroradiol 2001; 22:969-976.
- Intera application guide, Release 9; Vol 2: Scan methods. Philips Medical Systems Nederland B.V. 2002:199-211.
- Kleihues, P., Cavenee, W.K. WHO Classification of Tumours: Pathology and Genetics of Tumours of the Nervous System. IARC, Lyon, France, 2000:6-82.
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC






 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a:















