EVOLUCION DE LA RESISTENCIA ANTIBIOTICA EN BACILOS GRAMNEGATIVOS AISLADOS EN LAS UNIDADES DE CUIDADOS INTENSIVOS. PERIODO ANALIZADO 1998-2004
(especial para SIIC © Derechos reservados)
Coautores
Josefina Juárez* Carmen de Mier* Laura Pugliese* Gabriela Blanco* Carlos Vay** Angela Famiglietti***
Bioquímico Especialista en Bacteriología. Facultad de Farmacia y Bioquímica, UBA*
Doctor. UBA. Facultad de Farmacia y Bioquímica. UBA**
Doctor UBA. Facultad de Farmacia y Bioquímica UBA***
Recepción del artículo: 11 de enero, 2005
Aprobación: 14 de febrero, 2005
 Conclusión breve
Los alarmantes porcentajes de resistencia hallados avalan la necesidad de un uso más racional de los antibióticos.
Conclusión breve
Los alarmantes porcentajes de resistencia hallados avalan la necesidad de un uso más racional de los antibióticos.
 Resumen
Se evaluó la incidencia relativa de las diferentes especies de bacilos gramnegativos y de la resistencia a varios antibacterianos, en cuatro muestras de aislamientos clínicos correspondientes a cinco meses (marzo-julio) de 1998, 2001, 2002 y 2004. Para ello se analizaron 374 aislamientos de bacilos gramnegativos obtenidos de muestras clínicas de pacientes internados en salas de cuidados intensivos del hospital de Clínicas José de San Martín. Acinetobacter spp. fue el microorganismo más aislado. El porcentaje de aislamientos resistentes a imipenem fue del 60%, mientras que a ciprofloxacina y cefalosporinas de tercera generación fue superior al 80%. En Pseudomonas aeruginosa aumentó la resistencia a imipenem de 15.4% a 68.0%; a ciprofloxacina, de 31.4% a 66%, y a ceftazidima, de 8.2% a 65%. Para Klebsiella pneumoniae el porcentaje de aislamientos resistentes a cefalosporinas de tercera generación fue del 40% y se observó un aumento de la resistencia a ciprofloxacina del 5.0% al 20.0%. En conclusión, los alarmantes porcentajes de resistencia hallados en nuestro trabajo avalan la necesidad de un uso más racional de los antibióticos.
Resumen
Se evaluó la incidencia relativa de las diferentes especies de bacilos gramnegativos y de la resistencia a varios antibacterianos, en cuatro muestras de aislamientos clínicos correspondientes a cinco meses (marzo-julio) de 1998, 2001, 2002 y 2004. Para ello se analizaron 374 aislamientos de bacilos gramnegativos obtenidos de muestras clínicas de pacientes internados en salas de cuidados intensivos del hospital de Clínicas José de San Martín. Acinetobacter spp. fue el microorganismo más aislado. El porcentaje de aislamientos resistentes a imipenem fue del 60%, mientras que a ciprofloxacina y cefalosporinas de tercera generación fue superior al 80%. En Pseudomonas aeruginosa aumentó la resistencia a imipenem de 15.4% a 68.0%; a ciprofloxacina, de 31.4% a 66%, y a ceftazidima, de 8.2% a 65%. Para Klebsiella pneumoniae el porcentaje de aislamientos resistentes a cefalosporinas de tercera generación fue del 40% y se observó un aumento de la resistencia a ciprofloxacina del 5.0% al 20.0%. En conclusión, los alarmantes porcentajes de resistencia hallados en nuestro trabajo avalan la necesidad de un uso más racional de los antibióticos.
 Palabras clave
Bacilos gramnegativos, resistencia antibiótica, terapia intensiva, resistencia a imipenem, betalactamasas de espectro extendido
Clasificación en siicsalud
Palabras clave
Bacilos gramnegativos, resistencia antibiótica, terapia intensiva, resistencia a imipenem, betalactamasas de espectro extendido
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/71983
Especialidades
 Principal: Cuidados Intensivos, Infectología,
Principal: Cuidados Intensivos, Infectología,
 Relacionadas: Administración Hospitalaria, Diagnóstico por Laboratorio, Epidemiología, Medicina Interna, Salud Pública,
Relacionadas: Administración Hospitalaria, Diagnóstico por Laboratorio, Epidemiología, Medicina Interna, Salud Pública,
 Enviar correspondencia a:
Enviar correspondencia a:
Carlos Hernán Rodríguez. Campana 2604 6º 12 (1417) Ciudad de Buenos Aires, Argentina.
EVOLUTION OF BACTERIAL RESISTANCE TO ANTIBIOTICS IN GRAM NEGATIVE ISOLATES FROM INTESIVE CARE UNITS 1998-2004
 Abstract
Abstract
The incidence and drug susceptibility of gram-negative isolates from clinical samples of patients of different intensive care units of the Hospital de Clinicas José de San Martín were analyzed. 374 isolates during the same five months period, in four different years (1998, 2001,2002 and 2004) were obtained and evaluated. Acinetobacter spp., was the most frequently isolated microorganism. Resistance to imipenem was observed in around 60% of these isolations while resistance to 3rd generations cephalosporin and ciprofloxacin was observed in more than 80%. An increasing resistance to imipenem in Pseudomonas aeruginosa was noted, from 15.4% to 68.0% ; to ciprofloxacin, from 31.4% to 66%; and to ceftazidime, from 8.2% to 65%. Klebsiella pneumoniae was not resistant to imipenem, the resistance to 3rd and 4rth generations cephalosporins was observed in 40% of these isolations while the ciprofloxacin resistance increased from 5.0% to 40%. In conclusion, the alarming rates of resistance found in this study provide compelling evidence of the need for more rational use of antimicrobial agents.
 Key words
Key words
Gram-negative rods, antibiotic resistance, critical care, imipenem resistance, extended spectrum betalactamase
EVOLUCION DE LA RESISTENCIA ANTIBIOTICA EN BACILOS GRAMNEGATIVOS AISLADOS EN LAS UNIDADES DE CUIDADOS INTENSIVOS. PERIODO ANALIZADO 1998-2004
(especial para SIIC © Derechos reservados)
Artículo completo
Las infecciones producidas por bacilos gramnegativos con resistencia múltiple a los antimicrobianos, que se seleccionan en las unidades de cuidados intensivos (UCI), constituyen un serio problema al cual se deben enfrentar a diario tanto médicos como microbiólogos.
La utilización de estos antibacterianos, muchas veces indiscriminada, trae aparejada la selección de mutantes resistentes, la aparición de nuevos mecanismos de resistencia –como en el caso de Pseudomonas aeruginosa, Acinetobacter spp., Enterobacter spp.– y la emergencia de patógenos con resistencia intrínseca a la mayoría de los antibacterianos de uso clínico.
La incidencia de las diferentes especies, así como el perfil de resistencia a los antibióticos de mayor uso, es un fenómeno con características propias tanto a nivel nacional como en cada centro asistencial en particular, por lo que es indispensable la vigilancia de la evolución de la resistencia en los microorganismos aislados de las UCI.
Se analizaron 374 bacilos gramnegativos (BGN) aislados en las diferentes UCI del Hospital de Clínicas José de San Martín durante 5 meses (período marzo-julio) en 1998, 2001, 2002 y 2004.
Las especies más frecuentemente aisladas fueron Acinetobacter spp. (107), P. aeruginosa (80), entre los bacilos no fermentadores, y Klebsiella pneumoniae (80) y Escherichia coli (69) entre las enterobacterias.
En orina y materiales abdominales predominaron las enterobacterias, mientras que los bacilos no fermentadores prevalecieron en especímenes del tracto respiratorio.
Enterobacterias
En los períodos de tiempo estudiados no se observó resistencia a imipenem en las enterobacterias, siendo éste el anitmicrobiano más activo: CIM90 = 0.25 μg/ml. Si bien la resistencia a carbapenémicos es un hecho infrecuente en las enterobacterias, en el hospital se documentaron aislamientos de K. pneumoniae y E. cloacae resistente a este carbapenem.1
El porcentaje de enterobacterias con resistencia a cefalosporinas de tercera generación, mediada por betalactamasas de espectro extendido (BLEE) fue 40.3%, 24.4%, 39.6%, 36.4%, respectivamente, en los períodos de estudio.
Las BLEE fueron descritas por primera vez a principios de la década del ’80 en Europa,2 y actualmente se encuentran diseminadas por todo el mundo.3 Estas enzimas hidrolizan las penicilinas, las cefalosporinas de primera, tercera y cuarta generaciones y los monobactámicos, y no los carbapenémicos ni cefoxitina. Además son bloqueadas por los inhibidores de betalactamasas como tazobactam, sulbactam y ácido clavulánico.4
Inicialmente se encontraron en K. pneumoniae y E. coli, y luego, con menor frecuencia en otras enterobacterias. Estudios epidemiológicos realizados en Argentina muestran que la BLEE predominante es CTXM-2.5
Es importante destacar que CTXM-2, inactiva fuertemente cefotaxima, ceftriaxona, cefepime y aztreonam (CIM > a 8 μg/ml) mientras que lo hace escasamente ante ceftazidima (CIM = 0.25-0.5 μg/ml). No obstante, se encuentra documentado que la presencia de BLEE se relaciona con fracaso de tratamiento cuando se utilizan cefalosporinas de tercera o cuarta generación.6
Por el momento debemos considerar las BLEE como una resistencia de origen intrahospitalaria.
Los factores de riesgo conocidos para la colonización de pacientes por cepas productoras de BLEE son: internación hospitalaria prolongada, ingreso a la UCI, cateterización arterial y urinaria y administración de cefalosporinas de tercera generación. La ceftriaxona, por presentar excreción biliar y elevada concentración en heces, es un potente selector de cepas productoras de BLEE.
En un trabajo realizado en el país (Melero L, comunicación personal) se pudo documentar una vez más la presión-selección que ejerce esta cefalosporina en la flora de colonización intestinal. De un porcentaje de colonización intestinal con cepas productoras de BLEE del 3% antes del tratamiento, se incrementó al 14% durante la terapia (p < 0.001).
Las opciones terapéuticas para las cepas productoras de BLEE entre los antibióticos betalactámicos se reducen a los carbapenémicos y a piperacilina-tazobactam, que en un estudio colaborativo y multicéntrico realizado en Argentina en 2003 mostró una actividad del 70% ante cepas productoras de esta betalactamasa, y que debe utilizarse con precaución debido a que altos inóculos bacterianos alcanzados en los sitios de infección pueden alterar los valores de CIM de este antibiótico provocando fracasos terapéuticos (Figura 1).

Figura 1. Evolución de la resistencia a los antibióticos de las enterobacterias aisladas en las UCI del Hospital de Clínicas José de San Martín entre 1998 y 2004 (n = 149).
Acinetobacter spp.
Acinetobacter baumannii es la genoespecie más frecuentemente asociada a brotes de infección hospitalaria, particularmente en las UCI, y con mayor frecuencia en pacientes sometidos a asistencia respiratoria mecánica.
Se han señalado varios mecanismos como responsables de la resistencia a carbapenémicos en Acinetobacter spp.: alteración de las proteínas ligadoras de penicilina, alteración de la permeabilidad de la membrana externa y/o presencia de múltiples betalactamasas. En Argentina se ha descrito una carbapenemasa plasmídica denominada ARI-2,7 y en los últimos años una carbapenemasa dependiente de cinc.8
El tratamiento de las infecciones causadas por Acinetobacter spp. multirresistentes es problemático9 ya que los únicos antibióticos que permanecen activos son minociclina y polimixina. Es destacable que pese al restringido uso de la polimixina, debido a su toxicidad, ya fueron descriptas cepas de Acinetobacter spp. resistentes a este polipéptido. En una comunicación reciente, Reis A comunica 5% de cepas de Acinetobacter spp. resistentes a polimixina, con un rango de CIM entre 8 y 32 μg/ml, aisladas de 100 bacteriemias de un hospital brasileño.10 En el Hospital de Clínicas se aisló una cepa de Acinetobacter spp. resistente a polimixina (CIM: 16 μg/ml) de un paciente pediátrico con distrés respiratorio medicado con colistina intravenoso, la cual se recuperó de sangre luego de 11 días con este tratamiento.11

Figura 2. Evolución de la resistencia a antibióticos en cepas de Acinetobacter spp. aisladas en las UCI del Hospital de Clínicas José de San Martín entre 1998 y 2004 (n = 107).
Pseudomonas aeruginosa
Pseudomonas aeruginosa ocupa el segundo lugar en las infecciones por bacilos gramnegativos. La resistencia a imipenem fue mayor en nuestros aislamientos (68%) que en los publicados por el SIR a nivel nacional.12
Los estudios epidemiológicos realizados en Argentina13 adjudican la resistencia a la impermeabilidad producida por la pérdida de la porina OprD, necesaria para la incorporación del imipenem a la bacteria. Este mecanismo aumenta la CIM a imipenem a valores comprendidos entre 4 y 16 μg/ml y no a las cefalosporinas de tercera y cuarta generaciones.
Sin embargo, en nuestro hospital –también en 2003– fue descrita una carbapenemasa que afecta a todos los antibióticos betalactámicos a excepción del aztreonam.14
La ceftazidima y el cefepime mostraron mayor actividad que el imipenem en los períodos en estudio, aunque los porcentajes en 2003 y 2004 fueron más elevados, probablemente por la acción de las carbapenemasas.
La resistencia a ciprofloxacina en P. aeruginosa aumentó en el segundo período de estudio (31% vs. 66%), alcanzándose valores comparables a nivel nacional. La resistencia a ciprofloxacina puede deberse a alteraciones a nivel de la DNA gyrasa y topoisomerasas IV o a una hiperexpresión de la bomba de eflujo MexAB-OprM. Este último mecanismo afecta a cefepime, meropenem y fluorquinolonas simultáneamente.
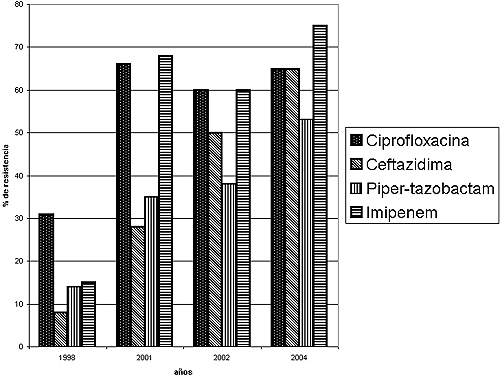
Figura 3. Evolución de la resistencia a antibióticos en cepas de P. aeruginosa aisladas en las UCI del Hospital de Clínicas José de San Martín entre 1998 y 2004 (n = 80).
En P. Aeruginosa, al igual que con Acinetobacter spp., las cepas con resistencia a imipenem se aislaron fundamentalmente de infecciones del tracto respiratorio inferior (64% y 63% respectivamente).
Si a esta situación con los bacilos gramnegativos se suma lo que ocurre con las bacterias grampositivas, surgimiento de enterococos resistentes a vancomicina y la hiperendemia de estafilococos resistentes a meticilina, las opciones terapeúticas se reducen a antiguos antibióticos con elevada toxicidad, como polimixina B, colistina, cloranfenicol y otros como minociclina, que al igual que el cloranfenicol tienen actividad bacteriostática.
Los autores no manifiestan “conflictos de interés”.
 Bibliografía del artículo
Bibliografía del artículo
- Famiglietti A, Rodríguez CH, Juárez J y col. Enterobacterias resistentes a carbapenémicos. Presentado en Actas VIII Congreso Argentino de Microbiología Buenos Aires 6-9 Sept.1998, p.140.
- Knothe H, Shah P, Kremery V y col. Transferable resistance to cefotaxime, cefoxitin, cefamandole and cefuroxime in clinical isolates of Klebsiella pneumoniae and Serratia marcescens. Infection 1983; 11:315-7.
- Winokur PL, Canton R, Casellas JM y col. Variations in the prevalence of strains expressing an extended-spectrum β-Lactamase phenotype and characterization of isolates from Europe, the Americas, and the Western Pacific Region. Clin Infect Dis 2001; 32(Suppl. 2):94-103.
- Jacoby GA. Extended-Spectrum β-lactamases and other enzymes providing resistance to oxyimino β-lactams. Infect Dis North Am 1997; 11:875-87.
- Galas MF, Rapoport MJ, Pasteran FG y col. High distribution of CTX-M-2 betalactamase among Klebsiella spp. isolates in an Argentinean extended-spectrum betalactamase (ESBLA) surveillance program. En: 39th Interscience Conference on Antimicrobial Agents Chemoterapy (ICAAC), San Francisco, California, USA, September 26-29, 1999, Abstract 1474 p.165.
- Paterson DL, Ko W, Gottberg A y col. Outcome of cephalosporin treatment for serious infections due to apparently susceptible organisms producing extended-spectrum β-lactamases: implications for the clinical microbiology laboratory. J Clin Microbiol 2001; 39:2206-12.
- Brown S, Bantar C, Young HK y col. Acinetobacter baumannii treatment by plasmid-mediated carbapenemase ARI-2. Lancet 1998; 351:186-187.
- Gómez N, Rapoport M, López Moral L y col. Caracterización de la resistencia antibiótica en aislamientos clínicos de Acinetobacter spp. En Reunión Científica Microbiología Clínica 2003. Buenos Aires 2003 Pág 24 resumen 14.
- Quin JP. Clinical problems posed by multiresistent nonfermenting Gram-Negative pathogens. Clin Infect Dis 1998; 27(Suppl 1):S117-24.
- Reis A O, Luz Dam, Tognim M y col. (2003) Polymyxin resistant Acinetobacter spp. isolates: what is next Emerg. Infect. Dis. 2003, 9:50-51.
- Rodríguez CH, Pautaso J, Bombicino K y col. Sensibilidad a colistina: evaluación de los puntos de corte disponibles en el antibiograma por difusión. Revista Argentina de Microbiología, 2004 vol. 36(4):125-129.
- Bantar C, Famiglietti A, Radice M y col. Análisis de 2 cortes de prevalencia del año 2001. Boletím informativo Nª158. Asociación Argentina de Microbiología 2003 Enero-Febrero.
- Pace J, Rossi A, Mollerach M et al. Resistance mechanisms associated to imipenem-resistance Pseudomonas aeruginosa in Argentina. En: 3rd International Conference of the Hospital Infection Society London, United Kingdom, September 4-8, 1994. p.80.
- Pagniez G, Rodríguez O, Rodríguez CH. Detección de metalo betalactamasa en Pseudomonas aeruginosa En: XVII Congreso Latinoamericano de Microbiología, Buenos Aires 2004 Resumen 20.
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC





 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a:

