INMUNOMODULACION DE LAS INFECCIONES MICOTICAS INVASIVAS: ¿AVANZARA DEL LABORATORIO A LA CAMA DEL PACIENTE
(especial para SIIC © Derechos reservados)
Coautor
John Dotis*
M.D., Research Fellow, 3rd Department of Paediatrics, Aristotle University*
Recepción del artículo: 14 de febrero, 2005
Aprobación: 14 de febrero, 2005
 Conclusión breve
La administración exógena de citoquinas y la transfusión de citoquinas obtenidas de fagocitos alogénicos parecen ser adyuvantes prometedores en la quimioterapia antifúngica de las infecciones micóticas invasivas.
Conclusión breve
La administración exógena de citoquinas y la transfusión de citoquinas obtenidas de fagocitos alogénicos parecen ser adyuvantes prometedores en la quimioterapia antifúngica de las infecciones micóticas invasivas.
 Resumen
Las infecciones micóticas invasivas (IMI) adquieren constantemente mayor importancia en el manejo de los pacientes inmunocomprometidos debido al aumento de la presencia de trastornos que provocan inmunosupresión y al surgimiento de hongos oportunistas que, con anterioridad, eran infrecuentes. Junto con la destrucción de los hongos mediante los agentes antimicóticos, la ayuda de la respuesta inmune a través de la reconstitución de las células efectoras, ya sea de su número o de su función con citoquinas o transfusiones de glóbulos blancos, o por la manipulación del desequilibrio de las citoquinas parece ser un adyuvante promisorio para la quimioterapia antifúngica. La evaluación de los beneficios de la prevención antimicótica y el tratamiento adyuvante con la combinación de factores de crecimiento hematopoyéticos o citoquinas y de agentes antimicóticos es una prioridad urgente para la investigación clínica. Sin embargo, es probable que los múltiples defectos inmunológicos que predisponen a las IMI, las diferencias biológicas entre los hongos patógenos y las respuestas variables a los inmunomoduladores compliquen el diseño de los estudios clínicos, y para que los resultados sean valederos será necesaria la inclusión de un gran número de casos. Un mejor conocimiento de la sinergia entre las citoquinas y los agentes antimicóticos puede aportar herramientas poderosas adicionales para el manejo de estas infecciones graves.
Resumen
Las infecciones micóticas invasivas (IMI) adquieren constantemente mayor importancia en el manejo de los pacientes inmunocomprometidos debido al aumento de la presencia de trastornos que provocan inmunosupresión y al surgimiento de hongos oportunistas que, con anterioridad, eran infrecuentes. Junto con la destrucción de los hongos mediante los agentes antimicóticos, la ayuda de la respuesta inmune a través de la reconstitución de las células efectoras, ya sea de su número o de su función con citoquinas o transfusiones de glóbulos blancos, o por la manipulación del desequilibrio de las citoquinas parece ser un adyuvante promisorio para la quimioterapia antifúngica. La evaluación de los beneficios de la prevención antimicótica y el tratamiento adyuvante con la combinación de factores de crecimiento hematopoyéticos o citoquinas y de agentes antimicóticos es una prioridad urgente para la investigación clínica. Sin embargo, es probable que los múltiples defectos inmunológicos que predisponen a las IMI, las diferencias biológicas entre los hongos patógenos y las respuestas variables a los inmunomoduladores compliquen el diseño de los estudios clínicos, y para que los resultados sean valederos será necesaria la inclusión de un gran número de casos. Un mejor conocimiento de la sinergia entre las citoquinas y los agentes antimicóticos puede aportar herramientas poderosas adicionales para el manejo de estas infecciones graves.
 Palabras clave
Infecciones micóticas invasivas, pacientes inmunocomprometidos, tratamiento antifúngico adyuvante, inmunomodulación
Clasificación en siicsalud
Palabras clave
Infecciones micóticas invasivas, pacientes inmunocomprometidos, tratamiento antifúngico adyuvante, inmunomodulación
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/72372
Especialidades
 Principal: Infectología, Inmunología,
Principal: Infectología, Inmunología,
 Relacionadas: Bioquímica, Diagnóstico por Laboratorio, Medicina Farmacéutica, Medicina Interna, Neumonología,
Relacionadas: Bioquímica, Diagnóstico por Laboratorio, Medicina Farmacéutica, Medicina Interna, Neumonología,
 Enviar correspondencia a:
Enviar correspondencia a:
Emmanuel Roilides. 3rd Department of Pediatrics, Hippokration Hospital, Konstantinoupoleos 49, GR-54642 Thessaloniki, Grecia
IMMUNOMODULATION OF INVASIVE FUNGAL INFECTIONS: WILL IT PROCEED FROM LAB TO BED
 Abstract
Abstract
Invasive fungal infections (IFIs) continuously acquire more importance in the management of immunocompromised patients especially because of the increased frequency of immunocompromising states and the emergence of previously rare opportunistic fungi. Together with destruction of fungi by antifungal agents, helping immune response by reconstitution of effector cells numerically and/or functionally with cytokines and/or white blood cell transfusions, or by manipulation of cytokine dysbalance appears to be promising adjunct to antifungal chemotherapy. Evaluation of the benefits of the antifungal prevention and adjunctive therapy combining hematopoietic growth factors/cytokines with antifungal agents is urgent priority for clinical research. However, the multiple immune defects that predispose to IFIs, the biological differences among pathogenic fungi, and the variable responses to immune modulators are likely to complicate the design of clinical studies, and large sample sizes will likely be required for valid results. A better understanding of the synergy between cytokines and antifungal agents may provide additional powerful tools for managing these serious infections.
 Key words
Key words
Invasive fungal infections, immunocompromised patients, immunomodulation, adjunctive antifungal treatment
INMUNOMODULACION DE LAS INFECCIONES MICOTICAS INVASIVAS: ¿AVANZARA DEL LABORATORIO A LA CAMA DEL PACIENTE
(especial para SIIC © Derechos reservados)
Artículo completo
Durante las tres últimas décadas, las infecciones micóticas invasivas (IMI) oportunistas se observan con una frecuencia cada vez mayor. Dos acontecimientos fundamentales han contribuido a esta tendencia. Primero, el aumento en el número de huéspedes con déficit inmunológicos adquiridos, como los enfermos con cáncer que reciben quimioterapia con dosis altas, los receptores de trasplantes, los pacientes que reciben corticosteroides y otras drogas inmunosupresoras, así como los pacientes con la infección por el virus de la inmunodeficiencia humana (HIV). En segundo lugar, las modalidades terapéuticas enérgicas como el uso de catéteres implantables y otros cuerpos extraños durante largo tiempo, así como el empleo de antimicrobianos de amplio espectro han expuesto a los pacientes más susceptibles a las IMI. Como respuesta a esta tendencia, diversos agentes antimicóticos han sido introducidos en el arsenal del médico. Sin embargo, los resultados de las IMI en pacientes con una respuesta inmunológica gravemente deficitaria no son óptimos y la morbilidad y mortalidad significativas acentúan la necesidad urgente de nuevos enfoques para la terapéutica antimicótica.1,2
Factores de riesgo de las IMI
Para llevar adelante estrategias efectivas para la prevención o el tratamiento de las IMI es importante reconocer diferentes categorías de factores de riesgo. Estos incluyen características genéticas, enfermedad subyacente, intervenciones terapéuticas y exposición ambiental. Una combinación de estos factores contribuye al riesgo total de la infección, lo que destaca la complejidad de las defensas del huésped frente al patógeno oportunista.
Mediante la utilización de tecnología molecular de análisis de los polimorfismos del ADN genómico se hallaron diversos polimorfismos de citoquinas específicas en pacientes con alto riesgo de infecciones micóticas.3 Además, en el ámbito de las patologías individuales, surgen patógenos selectos debido a defectos discretos en las defensas del huésped. Estos defectos se vuelven más profundos debido a los efectos de las terapias inmunosupresoras empleadas para el tratamiento de las enfermedades subyacentes. Los factores previos ilustran la importancia de los componentes clave de la inmunidad del huésped contra los patógenos fúngicos y enfatizan la utilidad de las terapéuticas inmunomoduladoras para aumentar las respuestas inmunes del huésped que se hallan deterioradas. La terapia inmune puede ser: a) de reemplazo o de reconstitución, la cual pretende corregir los defectos inmunológicos subyacentes que predisponen a los pacientes a las enfermedades micóticas, o b) el tratamiento potenciador o aumentador, el cual pretende realzar la función inmunológica contra el patógeno.4
Citoquinas relacionadas con hongos oportunistasSe identificaron diversas moléculas circulantes como citoquinas o factores de crecimiento hematopoyético (FCH) y se encontró una gran superposición entre estos dos grupos de agentes inmunológicos. Cuando se las prueba in vivo o in vitro con hongos oportunistas, las células inmunes secretan varias citoquinas, las cuales desempeñan un papel fundamental en la defensa del huésped frente a los hongos.5 Las citoquinas secretadas por los fagocitos durante la etapa temprana de la respuesta contribuyen a la inflamación y al incremento de las funciones antifúngicas, mientras que las citoquinas de fases tardías atenúan la inflamación y disminuyen la respuesta del huésped.
Los FCH son glucoproteínas que se requieren para la proliferación y diferenciación de células precursoras hematopoyéticas en leucocitos maduros. El factor estimulador de colonias granulocíticas (G-CSF), el estimulador de colonias granulocito-macrofágicas (GM-CSF) y el estimulador de macrófagos (M-CSF) son los más relevantes en las defensas del huésped frente a los hongos (tabla 1).
Tabla 1El G-CSF actúa sobre los leucocitos polimorfonucleares (PMN) y promueve su maduración e incrementa su número en la sangre periférica.4,6 A través del aumento del estallido (burst) oxidativo, regula la función de los PMN intactos contra Candida albicans, Aspergillus fumigatus7-9 Rhizopus arrhizus y Cryptococcus neoformans.10 El GM-CSF promueve la diferenciación y proliferación de las células mononucleares (CMN) y de los PMN11,12 y potencia sus actividades antimicóticas contra C. albicans,13 A. fumigatus14 y otros hongos menos frecuentes como Scedosporium spp.,15 Fusarium spp.16 y cigomicetos.17 El M-CSF promueve la diferenciación y activación de las CMN y de los macrófagos y realza su actividad antimicótica contra Candida spp.18,19 y A. fumigatus.20
Entre las citoquinas más potentes, el interferón gamma (IFN-γ) potencia el estadillo oxidativo y la actividad antimicótica de los macrófagos y PMN de los seres humanos contra un espectro amplio de patógenos fúngicos como Candida spp., A. fumigatus, C. neoformans, Paracoccidioides brasiliensis y Blastomyces dermatitidis (tabla 1).21
Otras citoquinas Th1, como la interleuquina-12 (IL-12) y la IL-15, tienen una actividad antimicótica prometedora contra patógenos como Candida spp., Aspergillus spp., y C. neoformans.22 En particular, se observó que la IL-15 potencia las actividades antimicóticas de los PMN y CMN para fagocitar e inhibir el crecimiento de C. albicans (tabla 1)23 y también para aumentar el daño inducido por los PMN de las hifas de A. fumigatus, Scedosporium prolificans y Fusarium spp., pero no de Aspergillus flavus o de Scedosporium apiospermum.24,25 Entre las citoquinas Th2, IL-4, IL-10 e IL-13 son fundamentales para dirigir la respuesta humoral y están más especializadas en la disminución de la extensa inflamación creada por las citoquinas Th1. De la misma manera, IL-4 e IL-10 disminuyen la respuesta oxidativa y la actividad antifúngica de los PMN y CMN contra C. albicans26-28 y A. fumigatus29,30 (Tabla 1).
Citoquinas en huéspedes neutropénicos y no neutropénicos
Las citoquinas recombinantes y los FCH han sido utilizados para aumentar las defensas del huésped contra patógenos fúngicos importantes. Como se mencionó previamente, las poblaciones de pacientes con alto riesgo de IMI son aquellos que presentan neutropenia y aquellos que no la tienen, pero que presentan diversas deficiencias funcionales de los linfocitos y fagocitos. Las citoquinas pueden ser administradas a pacientes en diferentes etapas de sus enfermedades (Tabla 2).
Tabla 2Las neoplasias y las neutropenias relacionadas con las enfermedades o con los tratamientos implementados constituyen el campo más amplio de defectos adquiridos en las defensas del huésped y la mayor necesidad de reconstitución inmunológica. Así, la mayoría de los estudios se centraron sobre esta población de pacientes. El empleo de citoquinas y de FCH en huéspedes neutropénicos se estudió extensamente en modelos animales experimentales de IMI, tanto profilácticos como terapéuticos (tabla 3).
Tabla 3El riesgo de IMI es también elevado en determinados pacientes no neutropénicos. Entre ellos, los que recibieron trasplante de células madre hematopoyéticas (TCMH) luego de la recuperación de la neutropenia y en especial durante la realización del injerto, o el tratamiento con esteroides posterior a la enfermedad injerto versus huésped, son los huéspedes más vulnerables.11 Otros pacientes no neutropénicos con alto riesgo de IMI que podrían beneficiarse de la inmunoterapia, son aquellos con HIV, linfoma, receptores de trasplante de órganos sólidos y los que presentan trastornos autoinmunes que reciben corticosteroides u otros inmunosupresores, que presentan disfunción fagocitaria junto con defectos linfocíticos y desregulación de citoquinas. Como se mencionó más arriba, los pacientes con defectos cualitativos congénitos de los fagocitos (en especial, aquellos que padecen de enfermedad granulomatosa crónica) también presentan un riesgo incrementado de IMI, particularmente aspergilosis invasiva, con elevada mortalidad.51
El uso clínico de FCH, en muchas partes del mundo G-CSF y GM-CSF exclusivamente, ha sido rápidamente adoptado por el hecho de que ambos factores son capaces de disminuir la gravedad y la duración de la neutropenia.52,53 El G-CSF y el GM-CSF han recibido un papel central en el cuidado de sostén de los pacientes con cáncer, trasplantes, aplasia de médula ósea y neutropenia congénita. En los primeros, estos factores han sido administrados en varias etapas durante la neutropenia. Por ejemplo, al comienzo, para evitar las infecciones (figura 1).54-56 En ese ámbito, se notaron efectos beneficiosos en algunos estudios, pero el número de IMI ha sido demasiado pequeño para evaluar cualquier efecto posible (tabla 4).
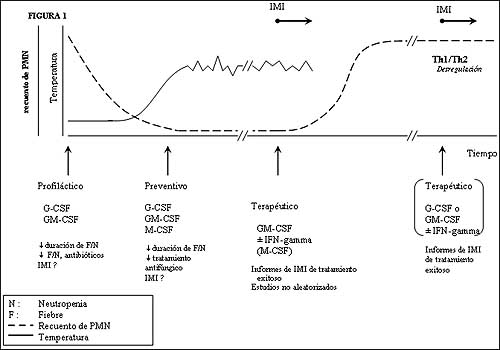
Figura 1. Curso típico de un trasplante de médula ósea, en el que se indican los escenarios y períodos con neutropenia y sin neutropenia en que se pueden presentar IMI. La administración de citoquinas se halla indicada en los períodos indicados por flechas; los pocos datos clínicos publicados están resumidos abajo.
Tabla 4Por esta razón, la American Society of Clinical Oncology no recomienda el uso de FCH con fines rutinarios en la neutropenia afebril.63 Existe una carencia similar de efectos beneficiosos concretos para apoyar el empleo rutinario preventivo de estos factores en el comienzo de la neutropenia febril.64,65 Sin embargo, cuando se administró GM-CSF a pacientes con neoplasias sometidos a quimioterapia o trasplante de médula ósea, se halló que mejoró la supervivencia y que disminuyó la tasa de infecciones bacterianas y micóticas.66 En el grupo de Eastern Cooperative Oncology Study, la administración de GM-CSF a pacientes añosos con leucemia mielógena provocó una reducción en la mortalidad relacionada con IMI (2% en el grupo GM-CSF versus 19% en el grupo placebo) y una tasa más elevada de respuesta completa. No se hallaron diferencias significativas entre la aspergilosis y la candidiasis.67 Sin embargo, ése fue el único estudio aleatorizado que halló un efecto significativo.
Recomendaciones para el empleo prudencial de las citoquinas en las IMI
Con respecto a las IMI documentadas en pacientes neutropénicos, en el año 2000 el panel de expertos sobre factores de crecimiento de la American Society of Clinical Oncology63 enunció las recomendaciones para el empleo de estos factores, lo cual fue continuado por las guías de enfermedades infecciosas del grupo de trabajo de la German Society of Hematology and Oncology en 2003.68 De acuerdo con estas guías, las aplicaciones directas potenciales de las citoquinas y los FCH contra las IMI están limitadas a las indicaciones que se enumeran más abajo.
La administración primaria de FCH (G-CSF y GM-CSF) debería reservarse solamente para aquellos pacientes en quienes se considera que tienen un riesgo elevado de presentar neutropenia febril debido a circunstancias especiales y puede estar, con excepciones, justificada en pacientes con riesgo aumentado por complicaciones infecciosas inducidas por la quimioterapia. Si no hay neutropenia febril se puede considerar el empleo de FCH si la neutropenia prolongada provoca una reducción excesiva en la dosis del tratamiento quimioterápico o una demora en su administración.
Los FCH pueden acortar exitosamente el período de neutropenia y reducir las complicaciones infecciosas en pacientes sometidos a terapia citotóxica en dosis elevadas por trasplante autólogo de médula ósea. Los FCH son también efectivos para la movilización de las células madre hematopoyéticas autólogas a partir de la sangre periférica para el trasplante. Se vio que el trasplante autólogo de estas células conduce a una recuperación hematopoyética más temprana que el trasplante autólogo de médula ósea.69,70
Aunque en general no se demostraron beneficios claros con el empleo de FCH en pacientes con leucemia linfocítica aguda, éste parece ser clínicamente significativo a través del acortamiento de la duración de la neutropenia luego de la quimioterapia de consolidación. En determinadas circunstancias asociadas con deterioro de las defensas en el huésped, aún sin neutropenia (por ejemplo, en la enfermedad injerto versus huésped), un FCH con IFN-γ o sin él puede estar justificado como terapéutica adyuvante para las IMI. No se conoce si las indicaciones de los FCH también incluyen pacientes quirúrgicos u otros estados inmunodeficientes no neutropénicos con IMI, como las personas con trasplante de órganos sólidos, la infección por HIV o el nacimiento prematuro. La profilaxis con IFN-γ en pacientes con enfermedad granulomatosa crónica es efectiva. Las guías recomendadas para los adultos son, por lo general, aplicables en la población pediátrica.
Citoquinas en combinación con tratamiento antifúngico
Los FCH han sido utilizados en combinación con drogas antifúngicas para el tratamiento de IMI en pacientes con cáncer pero las conclusiones obtenidas fueron contradictorias.61,62 De hecho, los hallazgos varían desde la ausencia de efecto en la supervivencia y en la tasa de infección hasta una reducción significativa de ambos. El único FCH que ha sido investigado es el G-CSF en pacientes no neutropénicos. En un ensayo multicéntrico sobre la utilidad de este factor como tratamiento adyuvante de la candidiasis invasiva, se halló una tendencia favorable hacia la resolución más temprana de la infección y una reducción en la mortalidad en pacientes que lo recibieron.71 Este ensayo avaló con firmeza los hallazgos de estudios in vivo y ex vivo en relación con que el número y la función de las células inmunológicas del huésped son de gran importancia en la recuperación de estas infecciones micóticas.11,72
Existen diversos informes de casos que sugieren efectos beneficiosos con la terapia de combinación con G-CSF más agentes antifúngicos para casos de IMI refractarias.73-77 Por ejemplo, la zigomicosis invasiva, la cual tiene un pronóstico muy malo, fue tratada exitosamente con el complejo lipídico de anfotericina B (AnB) a una dosis de 4 mg/kg/d más G-CSF (300 μg 3 veces a la semana).75 La fusariosis es otra IMI de difícil tratamiento, en la cual se intentó la adición de G-CSF o de GM-CSF a la terapéutica antimicótica convencional, con algunos resultados prometedores pero mixtos.78
No existen hasta la fecha ensayos clínicos que se hayan completado con suficiente poder estadístico y que analicen la utilidad del GM-CSF junto con agentes antifúngicos. En un estudio que investigó la combinación de AnB más GM-CSF en pacientes con neutropenia grave (menor de 100 PMN/μl) y con infecciones micóticas de órganos importantes o infección diseminada documentada, se observaron resultados prometedores.61 Sin embargo, estos resultados no han sido confirmados con ensayos aleatorizados más importantes.
Mientras que el M-CSF fue estudiado antes en combinación con el tratamiento antifúngico contra IMI,62 la posterior interrupción del desarrollo de este agente en los Estados Unidos y en Europa evitó la realización de ensayos clínicos más recientes.
El IFN-γ fue empleado con éxito en el tratamiento de la aspergilosis invasiva en pacientes con enfermedad granulomatosa crónica, en combinación con agentes antimicóticos.79,80 Además, dos pacientes con leucemia y candidiasis hepatoesplénica81 fueron tratados con IFN-γ y la infección se resolvió completamente luego de seis semanas de terapéutica. Sin embargo, otros informes de casos de la administración combinada de IFN-γ con fármacos antifúngicos convencionales han tenido resultados mixtos y requieren investigaciones adicionales para determinar el marco clínico adecuado de su utilidad. En general, la reconstitución de la respuesta inmune a través de diversas acciones tiene que ser tomada con seria consideración.
Transfusiones de granulocitos para el tratamiento de las IMI
Durante las dos últimas décadas, se incrementaron los esfuerzos para reconstituir las defensas del huésped con el tratamiento con transfusiones de granulocitos (TxG).82 Dos avances principales en el campo del tratamiento de apoyo condujeron a este nuevo intento, mediante la disponibilidad comercial de FCH recombinantes y de prácticas transfusionales modernas.83 Las indicaciones clínicas son las personas (con neutropenia persistente o con un defecto inmunitario subyacente, como la enfermedad granulomatosa crónica) que presentan una infección progresiva. Mientras que un estudio clínico previo no mostró una mejoría significativa en los resultados, en informes recientes se observaron resultados alentadores que requieren de estudios de seguimiento.84-89
En un trabajo reciente se empleó TxG en 22 pacientes con neoplasias hematológicas que contrajeron infecciones bacterianas y micóticas refractarias y relacionadas con neutropenia.90 Se consiguió el control de la infección al trigésimo día luego del primer TxG en el 50% de los pacientes con recuperación final de la médula que se correlacionó significativa e independientemente con una respuesta favorable al TxG. El empleo profiláctico del TxG se describió en nueve receptores de trasplante de células madre hematopoyéticas con aspergilosis invasiva previa o que fueron considerados como de alto riesgo para la aparición de esta micosis durante su trasplante. En comparación con el grupo control, hubo una reducción significativa en la incidencia y en la duración de la fiebre, menor cantidad de días con neutropenia y mejoría radiológica de los infiltrados pulmonares en algunos de los casos.91
Una aplicación potencial de la terapéutica combinada con citoquinas más fagocitos y agentes antifúngicos es la transfusión de las citoquinas obtenidas de PMN para ayudar a la recuperación en las IMI refractarias al tratamiento quimioterapéutico antimicótico. Informes recientes aportaron datos alentadores con el TxG obtenido de G-CSF en comparación con los estudios que emplearon TxG convencional estimulado con esteroides, los cuales requieren trabajos de seguimiento.84-89,92-94 (tabla 5).
Tabla 5El efecto beneficioso de las transfusiones pareció estar potenciado por su administración a pacientes con un buen estado clínico, así como por su administración precoz durante la neutropenia y poco tiempo después del comienzo de la IMI. A mayor número de células transfundidas por metro cuadrado de superficie corporal, mayor es la respuesta clínica al TxG.96,97 Para la movilización de PMN en donantes sanos, la mayoría de los expertos se pronunciaron a favor del G-CSF, el cual es, en verdad, el método estándar en los centros hemoterapéuticos de procesamiento.96
El G-CSF incrementa el rédito de los PMN en cerca de 5 veces, el cual es mejor que el beneficio del doble o triple que se logra con los corticosteroides.9,88,89 Como dosis óptima y segura se recomiendan 450 μg en los adultos para la movilización de PMN.9 Sólo se necesita una dosis, 12 a 24 horas antes de la recolección. Trabajos recientes evaluaron el papel de la combinación de G-CSF y corticosteroides y sugieren que las dosis más altas del primero junto con los últimos provoca el rédito más elevado (incremento de 12 veces por sobre los valores previos a la movilización).98 Se requieren futuros estudios aleatorizados en centros que posean la infraestructura necesaria para establecer la efectividad de esta estrategia antes de que sea más empleada.99
Sinopsis
Además del tratamiento antifúngico con drogas, la reconstitución y el aumento de la respuesta inmune, ya sea mediante la administración exógena de citoquinas o por transfusión de citoquinas obtenidas de fagocitos alogénicos, parecen ser adyuvantes prometedores a la quimioterapia antifúngica para estas infecciones que ponen en riesgo la vida de los pacientes. El objetivo de los estudios futuros deberían ser los pacientes con riesgo muy elevado de presentar infecciones micóticas. Es probable que el gran número de defectos de la inmunidad que predisponen a este tipo de infecciones, las diferencias biológicas entre los hongos y las respuestas variables a los inmunomoduladores compliquen el diseño de estudios clínicos, por lo que serán necesarios trabajos con un número elevado de pacientes para poder obtener conclusiones valederas.
Los autores no manifiestan “conflictos de interés”.
 Bibliografía del artículo
Bibliografía del artículo
- Clark TA, Hajjeh RA. Recent trends in the epidemiology of invasive mycoses. Curr Opin Infect Dis 2002; 15:569-74.
- Pappas P. Immunotherapy for invasive fungal infections: from bench to bedside. Drug Resistance Updates 2004; 7:3-10.
- Lehrnbecher T, Fleischhack G, Hanisch M, et al. Circulating levels and promoter polymorphisms of interleukins-6 and 8 in pediatric cancer patients with fever and neutropenia. Haematologica 2004; 89:234-6.
- Casadevall A, Pirofski LA. Adjunctive immune therapy for fungal infections. Clin Infect Dis 2001; 33:1048-56.
- Lohmeyer J. Role of hemopoietic growth factors and cytokines in host defense against fungal infections. Mycoses 1997; 40 Suppl 2:37-9.
- Hubel K, Engert A. Clinical applications of granulocyte colony-stimulating factor: an update and summary. Ann Hematol 2003; 82:207-13.
- Roilides E, Uhlig K, Venzon D, et al. Prevention of corticosteroid-induced suppression of human polymorphonuclear leukocyte-induced damage of Aspergillus fumigatus hyphae by granulocyte colony-stimulating factor and interferon-g. Infect Immun 1993; 61:4870-7.
- Roilides E, Holmes A, Blake C, et al. Effects of granulocyte colony-stimulating factor and interferon-g on antifungal activity of human polymorphonuclear neutrophils against pseudohyphae of different medically important Candida species. J Leukoc Biol 1995; 57:651-6.
- Liles WC, Huang JE, Van Burik JA, et al. Granulocyte colony-stimulating factor administered in vivo augments neutrophil-mediated activity against opportunistic fungal pathogens. J Infect Dis 1997; 175:1012-5.
- Vecchiarelli A, Morani C, Baldelli F, et al. Beneficial effect of recombinant human granulocyte colony-forming factor on fungicidal activity of polymorphonuclear leukocytes from patients with AIDS. J Infect Dis 1995; 171:1448-54.
- Rodriguez-Adrian LJ, Grazziutti ML, Rex JH, et al. The potential role of cytokine therapy for fungal infections in patients with cancer: is recovery from neutropenia all that is needed Clin Infect Dis 1998; 26:1270-8.
- Hubel K, Dale DC, Liles WC. Therapeutic use of cytokines to modulate phagocyte function for the treatment of infectious diseases: current status of granulocyte colony-stimulating factor, granulocyte-macrophage colony-stimulating factor, macrophage colony-stimulating factor, and interferon-gamma. J Infect Dis 2002; 185:1490-501.
- Smith PD, Lamerson CL, Banks SM, et al. Granulocyte-macrophage colony-stimulating factor augments human monocyte fungicidal activity for Candida albicans. J Infect Dis 1990; 161:999-1005.
- Roilides E, Holmes A, Blake C, et al. Antifungal activity of elutriated human monocytes against Aspergillus fumigatus hyphae: Enhancement by granulocyte-macrophage colony-stimulating factor and interferon-g. J Infect Dis 1994; 170:894-9.
- Gil-Lamaignere C, Winn RM, Simitsopoulou M, et al. IFN-γ and GM-CSF augment the antifungal activity of human polymorphonuclear leukocytes against Scedosporium spp.: comparison with Aspergillus spp. Med Mycol (in press).
- Winn RM, Maloukou A, Gil-Lamaignere C, et al. Interferon-gamma and granulocyte-macrophage colony stimulating factor enhance hyphal damage of Aspergillus and Fusarium spp. by human neutrophils (J-134). In: 41st Interscience Conference Antimicrob Agents Chemother, Chicago IL., 2001. p. 366.
- Gil-Lamaignere C, Simitsopoulou M, Roilides E, et al. IFN-γ and GM-CSF enhance the activity of human polymorphonuclear leukocytes against medically important zygomycetes. J Infect Dis (in press).
- Gioulekas E, Goutzioulis M, Farmakis C, et al. Effects of macrophage colony-stimulating factor on antifungal activity of neonatal monocytes against Candida albicans. Biol Neonate 2001; 80:251-6.
- Roilides E, Lyman CA, Sein T, et al. Antifungal activity of splenic, liver and pulmonary macrophages against Candida albicans and effects of macrophage colony-stimulating factor. Med Mycol 2000; 38:161-8.
- Roilides E, Sein T, Holmes A, et al. Effects of macrophage colony-stimulating factor on antifungal activity of mononuclear phagocytes against Aspergillus fumigatus. J Infect Dis 1995; 172:1028-34.
- Roilides E, Farmaki E, Lyman CA. Immune reconstitution against human mycoses. In: Calderone R, Cihlar R, editors. Fungal pathogenesis: Principles and clinical applications. New York: Marcel Dekker Inc; 2001.p. 433-60.
- Romani L, Puccetti P, Bistoni F. Interleukin-12 in infectious diseases. Clin Microbiol Rev 1997; 10:611-36.
- Vazquez N, Walsh TJ, Friedman D, et al. Interleukin-15 augments superoxide production and microbicidal activity of human monocytes against Candida albicans. Infect Immun 1998; 66:145-50.
- Winn RM, Gil-Lamaignere C, Roilides E, et al. Selective effects of interleukin-15 on antifungal activity and interleukin-8 release by polymorphonuclear leukocytes in response to hyphae of Aspergillus spp. J Infect Dis 2003; 188:585-90.
- Winn RM, Gill-Lamaignere C, Roilides E, et al. Effects of interleukin-15 on antifungal responses of human polymorphonuclear leukocytes against Fusarium spp. and Scedosporium spp. Cytokine (in press).
- Roilides E, Kadiltsoglou I, Dimitriadou A, et al. Interleukin-4 suppresses antifungal activity of human mononuclear phagocytes against Candida albicans in association with decreased uptake of blastoconidia. FEMS Immunol Med Microbiol 1997; 19:169-80.
- Lilic D, Gravenor I, Robson N, et al. Deregulated production of protective cytokines in response to Candida albicans infection in patients with chronic mucocutaneous candidiasis. Infect Immun 2003; 71:5690-9.
- Altamura M, Casale D, Pepe M, et al. Immune responses to fungal infections and therapeutic implications. Curr Drug Targets Immune Endocr Metabol Disord 2001; 1:189-97.
- Roilides E, Dimitriadou A, Kadiltsoglou I, et al. IL-10 exerts suppressive and enhancing effects on antifungal activity of mononuclear phagocytes against Aspergillus fumigatus. J Immunol 1997; 158:322-9.
- Grazziutti ML, Savary CA, Ford A, et al. Aspergillus fumigatus conidia induce a Th1-type cytokine response. J Infect Dis 1997; 176:1579-83.
- Kullberg BJ, van der Meer JW, Meis JF, et al. Recombinant murine granulocyte colony-stimulating factor protects against acute disseminated Candida albicans infection in nonneutropenic mice. J Infect Dis 1998; 177:175-81.
- Polak-Wyss A. Protective effect of human granulocyte colony-stimulating factor on Candida infections in normal and immunosuppressed mice. Mycoses 1991; 34:109-18.
- Hamood M, Bluche PF, De Vroey C, et al. Effects of rhG-CSF on neutropenic mice infected with C. albicans: acceleration of recovery from neutropenia and potentiation of anti-Candida resistance. Mycoses 1994; 37:93-9.
- Uchida K, Yamamoto Y, Klein TW, et al. Granulocyte-colony stimulating factor facilitates the restoration of resistance to opportunistic fungi in leukopenic mice. J Med Vet Mycol 1992; 30:293-300.
- Polak-Wyss A. Protective effect of human granulocyte colony-stimulating factor on Cryptococcus and Aspergillus infections in normal and immunosuppressed mice. Mycoses 1991; 34:205-15.
- Graybill JR, Bocanegra R, Najvar LK, et al. Granulocyte colony-stimulating factor and azole antifungal therapy in murine aspergillosis: role of immune suppression. Antimicrob Agents Chemother 1998; 42:2467-73.
- Mayer P, Schutze C, Lam C, et al. Recombinant murine granulocyte-macrophage colony-stimulating factor augments neutrophil recovery and enhances resistance to infections in myelosuppressed mice. J Infect Dis 1991; 163:584-90.
- Cenci E, Bartocci A, Puccetti P, et al. Macrophage colony-stimulating factor in murine candidiasis: Serum and tissue levels during infection and protective effect of exogenous administration. Infect Immun 1991; 59:868-72.
- Vitt CR, Fidler JM, Ando D, et al. Antifungal activity of rhM-CSF in models of acute and chronic candidiasis in the rat. J Infect Dis 1994; 169:369-74.
- Kuhara T, Uchida K, Yamaguchi H. Therapeutic efficacy of human macrophage colony-stimulating factor, used alone and in combination with antifungal agents, in mice with systemic Candida albicans infection. Antimicrob Agents Chemother 2000; 44:19-23.
- Gonzalez CE, Lyman CA, Lee S, et al. Recombinant human macrophage colony-stimulating factor augments pulmonary host defences against Aspergillus fumigatus. Cytokine 2001; 15:87-95.
- Kullberg BJ, Van’t Wout JW, Hoogstraten C, et al. Recombinant interferon-g enhances resistance to acute disseminated Candida albicans infection in mice. J Infect Dis 1993; 168:436-43.
- Nagai H, Guo J, Choi H, et al. Interferon-gamma and tumor necrosis factor-alpha protect mice from invasive aspergillosis. J Infect Dis 1995; 172:1554-60.
- Schelenz S, Smith DA, Bancroft GJ. Cytokine and chemokine responses following pulmonary challenge with Aspergillus fumigatus: obligatory role of TNF-a and GM-CSF in neutrophil recruitment. Med Mycol 1999; 37:183-94.
- Mehrad B, Strieter RM, Standiford TJ. Role of TNF-alpha in pulmonary host defense in murine invasive aspergillosis. J Immunol 1999; 162:1633-40.
- Van’t Wout JW, Van der Meer JWM, Barza M, et al. Protection of neutropenic mice from lethal Candida albicans infection by recombinant interleukin 1. Eur J Immunol 1988; 18:1143-6.
- Tonnetti L, Spaccapelo R, Cenci E, et al. Interleukin-4 and -10 exacerbate candidiasis in mice. Eur J Immunol 1995; 25:1559-65.
- Cenci E, Mencacci A, Del Sero G, et al. Interleukin-4 causes susceptibility to invasive aspergillosis through suppression of protective type 1 responses. J Infect Dis 1999; 180:1957-68.
- Romani L, Puccetti P, Mencacci A, et al. Neutralization of IL-10 upregulates nitric oxide production and protects susceptible mice from challenge with Candida albicans. J Immunol 1994; 152:3514-21.
- Del Sero G, Mencacci A, Cenci E, et al. Antifungal type 1 responses are upregulated in IL-10-deficient mice. Microbes Infect 1999; 1:1169-80.
- Winkelstein JA, Marino MC, Johnston RB, et al. Chronic granulomatous disease. Report on a national registry of 368 patients. Medicine (Baltimore) 2000; 79:155-69.
- American Society of Clinical Oncology recommendations for the use of hematopoietic colony-stimulating factors: Evidence-based, clinical practice guidlines. J Clin Oncol 1994; 12:2471-508.
- Boogaerts MA, Demuynck HM. Consensus on the clinical use of myeloid growth factors. Curr Opin Hematol 1996; 3:241-6.
- Crawford J, Ozer H, Stoller R, et al. Reduction by granulocyte colony-stimulating factor of fever and neutropenia induced by chemotherapy in patients with small-cell lung cancer. N Engl J Med 1991; 325:164-70.
- Rowe JM, Anderson JW, Mazza JJ, et al. A randomized placebo-controlled phase III study of granulocyte-macrophage colony-stimulating factor in adult patients (> 55 to 70 years) with acute myelogenous leukemia: a study by the Eastern Cooperative Oncology Group (E1490). Blood 1995; 86:457-62.
- Seipelt G. Clinical use of hematopoietic growth factors. Antibiot Chemother 2000; 50:94-105.
- Nemunaitis J, Buckner CD, Dorsey KS, et al. Retrospective analysis of infectious disease in patients who received recombinant human granulocyte-macrophage colony-stimulating factor versus patients not receiving a cytokine who underwent autologous bone marrow transplantation for treatment of lymphoid cancer. Am J Clin Oncol 1998; 21:341-6.
- Aviles A, Guzman R, Garcia EL, et al. Results of a randomized trial of granulocyte colony-stimulating factor in patients with infection and severe granulocytopenia. Anti-Cancer Agents 1996; 7:392-7.
- Ohno R, Miyawaki S, Hatake K, et al. Human urinary macrophage colony-stimulating factor reduces the incidence and duration of febrile neutropenia and shortens the period required to finish three courses of intensive consolidation therapy in acute myeloid leukemia: a double-blind controlled study. J Clin Oncol 1997; 15:2954-65.
- Peters BG, Adkins DR, Harrison B, et al. Antifungal effects of yeast-derived rhu-GM-CSF in patients receiving high-dose chemotherapy given with or without autologous stem cell transplantation: a retrospective analysis. Bone Marrow Transplant 1996; 18:93-102.
- Bodey GP, Anaissie E, Gutterman J, et al. Role of granulocyte-macrophage colony-stimulating factor as adjuvant therapy for fungal infection in patients with cancer. Clin Infect Dis 1993; 17:705-7.
- Nemunaitis J, Shannon-Dorcy K, Appelbaum FR, et al. Long-term follow-up of patients with invasive fungal disease who received adjunctive therapy with recombinant human macrophage colony-stimulating factor. Blood 1993; 82:1422-27.
- Ozer H, Armitage JO, Bennett CL, et al. 2000 update of recommendations for the use of hematopoietic colony-stimulating factors: evidence-based, clinical practice guidelines. American Society of Clinical Oncology Growth Factors Expert Panel. J Clin Oncol 2000; 18:3558-85.
- Anaissie EJ, Vartivarian S, Bodey GP, et al. Randomized comparison between antibiotics alone and antibiotics plus granulocyte-macrophage colony-stimulating factor (Escherichia coli-derived) in cancer patients with fever and neutropenia. Am J Med 1996; 100:17-23.
- Maher DW, Lieschke GJ, Green M, et al. Filgrastim in patients with chemotherapy-induced febrile neutropenia. A double-blind, placebo-controlled trial. Ann Intern Med 1994; 121:492-501.
- Giles FJ. Monocyte-macrophages, granulocyte-macrophage colony-stimulating factor, and prolonged survival among patients with acute myeloid leukemia and stem cell transplants. Clin Infect Dis 1998; 26:1282-9.
- Rowe JM. Treatment of acute myeloid leukemia with cytokines: effect on duration of neutropenia and response to infections. Clin Infect Dis 1998; 26:1290-4.
- Bohme A, Ruhnke M, Buchheidt D, et al. Treatment of fungal infections in hematology and oncology Guidelines of the Infectious Diseases Working Party (AGIHO) of the German Society of Hematology and Oncology (DGHO). Ann Hematol 2003; 82 Suppl 2:S133-S140.
- Beyer J, Schwella N, Zingsem J, et al. Hematopoietic rescue after high-dose chemotherapy using autologous peripheral-blood progenitor cells or bone marrow: A randomized comparison. J Clin Oncol 1995; 13:1328-35.
- Schmitz N, Linch DC, Dreger P, et al. Randomized trial of filgrastim-mobilized peripheral blood progenitor cell transplantation versus autologous bone marrow transplantation in lymphoma patients. Lancet 1996; 347:353-7.
- Kullberg BJ, Van de Woude K, Aoun M, et al. A double-blind, randomized, placebo-controlled phase II study of filgrastim (recombinant granulocyte colony-stimluating factor) in combination with fluconazole for treatment of invasive candidiasis and candidemia in nonneutropenic patients (J-100). In: Program and Abstracts of the 38th Interscience Conference Antimicrob Agents Chemother; 1998; San Diego CA; 1998.
- Mencacci A, Cenci E, Bacci A, et al. Host immune reactivity determines the efficacy of combination immunotherapy and antifungal chemotherapy in candidiasis. J Infect Dis 2000; 181:686-94.
- Grauer ME, Bokemeyer C, Bautsch W, et al. Successful treatment of a Trichosporon beigelii septicemia in a granulocytopenic patient with amphotericin B and granulocyte colony-stimulating factor. Infection 1994; 22:283-6.
- Hennequin C, Benkerrou M, Gaillard JL, et al. Role of granulocyte colony-stimulating factor in the management of infection with Fusarium oxysporum in a neutropenic child. Clin Infect Dis 1994; 18:490-1.
- Gonzalez CE, Couriel DR, Walsh TJ. Successful treatment of disseminated zygomycosis in a neutropenic patient with amphotericin B lipid complex and granulocyte colony-stimulating factor. Clin Infect Dis 1997; 24:192-6.
- Dornbusch HJ, Urban CE, Pinter H, et al. Treatment of invasive pulmonary aspergillosis in severely neutropenic children with malignant disorders using liposomal amphotericin B, granulocyte colony-stimulating factor and surgery: report of 5 cases. Pediatr Hematol Oncol 1995; 12:577-86.
- Spielberger RT, Falleroni MJ, Coene AJ, et al. Concomitant amphotericin B therapy, granulocyte transfusions, and GM-CSF administration for disseminated infection with Fusarium in a granulocytopenic patient. Clin Infect Dis 1993; 16:528-30.
- Boutati EI, Anaissie EJ. Fusarium, a significant emerging pathogen in patients with hematologic malignancy: ten years’ experience at a cancer center and implications for management. Blood 1997; 90:999-1008.
- Cohen-Abbo A, Edwards KM. Multifocal osteomyelitis caused by Paecilomyces varioti in a patient with chronic granulomatous disease. Infection 1995; 23:55-7.
- Pasic S, Abinun M, Pistignjat B, et al. Aspergillus osteomyelitis in chronic granulomatous disease: treatment with recombinant gamma-interferon and itraconazole. Pediatr Infect Dis J 1996; 15:833-4.
- Poynton CH, Barnes RA, Rees J. Interferon gamma and granulocyte-macrophage colony-stimulating factor for the treatment of hepatosplenic candidosis in patients with acute leukemia. Clin Infect Dis 1998; 26:239-40.
- Bensinger WI, Price TH, Dale DC, et al. The effects of daily recombinant human granulocyte colony-stimulating factor adminstration on normal granulocyte donors undergoing leukapheresis. Blood 1993; 81:1883-8.
- Van Burik JA, Weisdorf DJ. Is it time for a new look at granulocyte transfusions Transfusion 2002; 42:1394-5.
- Catalano L, Fontana R, Scarpato N, et al. Combined treatment with amphotericin-B and granulocyte transfusion from G-CSF-stimulated donors in an aplastic patient with invasive aspergillosis undergoing bone marrow transplantation. Haematologica 1997; 82:71-2.
- Di Mario A, Sica S, Salutari P, et al. Granulocyte colony-stimulating factor-primed leukocyte transfusions in candida tropicalis fungemia in neutropenic patients. Haematologica 1997; 82:362-3.
- Dignani MC, Freireich EJ, Andersson BS, et al. Treatment of neutropenia-related fungal infections with granulocyte colony-stimulating factor-elicited white blood cell transfusions: a pilot study. Leukemia 1997; 11:1621-30.
- Ozsahin H, Von Planta M, Muller I, et al. Successful treatment of invasive aspergillosis in chronic granulomatous disease by bone marrow transplantation, granulocyte colony-stimulating factor-mobilized granulocytes, and liposomal amphotericin-B. Blood 1998; 92:2719-24.
- Peters C, Minkov M, Matthes-Martin S, et al. Leucocyte transfusions from rhG-CSF or prednisolone stimulated donors for treatment of severe infections in immunocompromised neutropenic patients. Br J Haematol 1999; 106:689-96.
- Price TH, Bowden RA, Boeckh M, et al. Phase I/II trial of neutrophil transfusions from donors stimulated with G-CSF and dexamethasone for treatment of patients with infections in hematopoietic stem cell transplantation. Blood 2000; 95:3302-9.
- Rutella S, Pierelli L, Sica S, et al. Efficacy of granulocyte transfusions for neutropenia-related infections: retrospective analysis of predictive factors. Cytotherapy 2003; 5:19-30.
- Kerr J, Liakopolou E, Brown J, et al. The use of stimulated granulocyte transfusions to prevent recurrence of past severe infections after allogeneic stem cell transplantation. Br J Haematol 2003; 123:114-8.
- Briones M, Josephson CD, CD. H. Granulocyte transfusion: revisited. Curr Hematol Rep 2003; 2:522-7.
- Liang D. The role of colony-stimulating factors and granulocyte transfusion in treatment options for neutropenia in children with cancer. Paediatr Drugs 2003; 5: 673-84.
- Hubel K, Carter RA, Liles WC, et al. Granulocyte transfusion therapy for infections in candidates and recipients of HPC transplantation: a comparative analysis of feasibility and outcome for community donors versus related donors. Transfusion 2002; 42:1414-21.
- Cesaro S, Chinello P, De Silvestro G, et al. Granulocyte transfusions from G-CSF-stimulated donors for the treatment of severe infections in neutropenic pediatric patients with onco-hematological diseases. Support Care Cancer 2003; 11:101-6.
- Hubel K, Dale DC, Engert A, et al. Current status of granulocyte (neutrophil) transfusion therapy for infectious diseases. J Infect Dis 2001; 183:321-8.
- Roilides E, Lyman CA, Panagopoulou P, et al. Immunomodulation of invasive fungal infections. Infect Dis Clin N Am 2003; 17:193-219.
- Dale DC, Liles WC, Llewellyn C, et al. Neutrophil transfusions: kinetics and functions of neutrophils mobilized with granulocyte colony-stimulating factor and dexamethasone. Transfusion 1998; 38:713-21.
- Van Burik JA. Granulocyte transfusions as treatment or prophylaxis for fungal infections. Curr Opin Investig Drugs 2003; 4:921-5.
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC





 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: