REARREGLOS DEL GEN BCL-2 EN PACIENTES ARGENTINOS CON LINFOMA NO HODGKIN
(especial para SIIC © Derechos reservados)
Coautores
Carlos Daniel De Brasi* Marina Narvaitz** Irma Rosa Slavutsky***
Doctor de la Universidad de Buenos Aires, Instituto de Investigaciones Hematológicas “Mariano R. Castex”, Academia Nacional de Medicina, Buenos Aires, Argentina*
Médica. Instituto de Investigaciones Hematológicas “Mariano R. Castex”, Academia Nacional de Medicina, Buenos Aires, Argentina**
Doctora en Medicina. Instituto de Investigaciones Hematológicas “Mariano R. Castex”, Academia Nacional de Medicina, Buenos Aires, Argentina***
Recepción del artículo: 10 de febrero, 2005
Aprobación: 22 de febrero, 2005
 Conclusión breve
Evaluación de la frecuencia de la translocación t(14;18) en pacientes argentinos con linfoma folicular y linfoma B difuso a células grandes y comparación con las series ya publicadas.
Conclusión breve
Evaluación de la frecuencia de la translocación t(14;18) en pacientes argentinos con linfoma folicular y linfoma B difuso a células grandes y comparación con las series ya publicadas.
 Resumen
La t(14;18)(q32;q21) es la anomalía más frecuente en linfomas no Hodgkin y da origen al rearreglo molecular BCL-2/IgH. En este trabajo evaluamos la frecuencia y distribución de los rearreglos del gen BCL-2 en 144 pacientes argentinos: 98 con linfoma folicular (LF) y 46 con linfoma B difuso a células grandes (LBDCG) (29 de novo y 17 secundarios). Se utilizó PCR anidada (PCR-N) y de larga distancia (PCR-LD). En LF, 53 pacientes (54.1%) fueron positivos por PCR-N, se encontró un incremento del 24% al emplear la técnica de PCR-LD, que dio un total de 77 pacientes positivos (78.6%). En LBDCG, por PCR-N se detectaron 8 (27.5%) casos positivos para los LBDCG de novo y 9 (52.9%) para los secundarios; con incrementos de 24.1% y 29.4% con PCR-LD, con un total de 51.6% y 82.3%, respectivamente, mostrando un comportamiento diferente para ambas entidades. En LF, la comparación de nuestros resultados por PCR-N con los de otras regiones geográficas mostró diferencias significativas respecto de los datos de EE.UU. (p < 0.0001) y superposición con los de Europa y Asia, lo que sugiere que las diferencias geográficas podrían estar relacionadas con la distribución de puntos de ruptura entre MBR y mcr. Los LBDCG de novo no mostraron diferencias con los datos publicados.
Resumen
La t(14;18)(q32;q21) es la anomalía más frecuente en linfomas no Hodgkin y da origen al rearreglo molecular BCL-2/IgH. En este trabajo evaluamos la frecuencia y distribución de los rearreglos del gen BCL-2 en 144 pacientes argentinos: 98 con linfoma folicular (LF) y 46 con linfoma B difuso a células grandes (LBDCG) (29 de novo y 17 secundarios). Se utilizó PCR anidada (PCR-N) y de larga distancia (PCR-LD). En LF, 53 pacientes (54.1%) fueron positivos por PCR-N, se encontró un incremento del 24% al emplear la técnica de PCR-LD, que dio un total de 77 pacientes positivos (78.6%). En LBDCG, por PCR-N se detectaron 8 (27.5%) casos positivos para los LBDCG de novo y 9 (52.9%) para los secundarios; con incrementos de 24.1% y 29.4% con PCR-LD, con un total de 51.6% y 82.3%, respectivamente, mostrando un comportamiento diferente para ambas entidades. En LF, la comparación de nuestros resultados por PCR-N con los de otras regiones geográficas mostró diferencias significativas respecto de los datos de EE.UU. (p < 0.0001) y superposición con los de Europa y Asia, lo que sugiere que las diferencias geográficas podrían estar relacionadas con la distribución de puntos de ruptura entre MBR y mcr. Los LBDCG de novo no mostraron diferencias con los datos publicados.
 Palabras clave
Linfomas no Hodgkin, linfoma folicular, LBDCG, rearreglos BCL-2, PCR-LD
Clasificación en siicsalud
Palabras clave
Linfomas no Hodgkin, linfoma folicular, LBDCG, rearreglos BCL-2, PCR-LD
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/72407
Especialidades
 Principal: Hematología,
Principal: Hematología,
 Relacionadas: Bioquímica, Diagnóstico por Laboratorio, Epidemiología, Genética Humana, Medicina Interna,
Relacionadas: Bioquímica, Diagnóstico por Laboratorio, Epidemiología, Genética Humana, Medicina Interna,
 Enviar correspondencia a:
Enviar correspondencia a:
María Fernanda Noriega. Departamento de Genética, Instituto de Investigaciones Hematológicas, Academia Nacional de Medicina. Pacheco de Melo 3081 (1425) Buenos Aires, Argentina
 Patrocinio y reconocimiento
Patrocinio y reconocimiento
El presente trabajo fue realizado con subsidios otorgados por el Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), la Agencia Nacional de Promoción Científica y Técnica (ANPCyT), Beca “Ramón Carrillo-Arturo Oñativia”, Ministerio de Salud de la Nación y la Fundación “René Barón”.
BCL-2 GENE REARRANGEMENTS IN ARGENTINEAN NON-HODGKIN LYMPHOMA PATIENTS
 Abstract
Abstract
The translocation t(14;18)(q32;q21) is the most frequent abnormality observed in non-Hodgkin’s lymphoma. It determines the juxtaposition of BCL-2/IgH genes. In this study, we have evaluated the frequency and distribution of BCL-2 gene rearrangements in 144 Argentinean patients: 98 with follicular lymphoma (FL) and 46 with diffuse large B-cell lymphoma (DLBCL) (29 de novo and 17 secondary). Nested (N-PCR) and long-distance PCR (LD-PCR) approaches were used. In FL, 53 positive patients (54.1%) were found by N-PCR. By LD-PCR, additional 24 (24.5%) new positive cases were observed, making a total of 77 patients (78.6%) for BCL-2 gene rearrangements. N-PCR approach detected 8 de novo DLBCL positive cases (27.5%) and 9 (52.9%) secondary ones. By LD-PCR, the frequencies increased to 24.1% and 29.4%, respectively, showing total incidences of 51.6% and 82.3%, for each subtype of DLBCL, indicating the presence of different entities. Our N-PCR results in FL showed statistical differences with respect to the data from USA (p < 0.0001) and overlapped with the frequencies from Asia and Europe, suggesting that the geographical differences may be related with the distribution of breakpoints that are widely spread between MBR and mcr clusters. In de novo DLBCL, no significant differences with respect to the literature were found.
 Key words
Key words
Non-Hodgkin lymphomas, follicular lymphomas, DLBCL, BCL-2 rearrangements, LD-PCR
REARREGLOS DEL GEN BCL-2 EN PACIENTES ARGENTINOS CON LINFOMA NO HODGKIN
(especial para SIIC © Derechos reservados)
Artículo completo
Introducción
Los linfomas no Hodgkin (LNH) constituyen un grupo heterogéneo de neoplasias del sistema linfoide que presentan un amplio espectro de variación desde los puntos de vista clínico, morfológico, inmunofenotípico, citogenético y molecular. Son tumores que resultan de la expansión clonal de células linfáticas B o T transformadas en diferentes puntos de sus vías de diferenciación. Entre las neoplasias a células B maduras los tipos más comunes son los linfomas foliculares (LF) y los B difusos a células grandes (LBDCG), los que juntos constituyen más del 50% de todos los LNH. El LF es una neoplasia indolente caracterizada por la proliferación de células B provenientes del centro folicular del nódulo linfático. Es la forma más común de los LNH del adulto y representa alrededor del 35% al 40% de los casos. El LBDCG es una neoplasia agresiva de células B maduras, clínicamente heterogénea, que representa aproximadamente el 30% al 40% de los LNH.1 El 25% al 35% de los LF muestran transformación a LBDCG secundario (LBDCG-S), situación que se encuentra acompañada de un curso clínico más agresivo, resistencia al tratamiento y corta supervivencia.2-4
La translocación t(14;18)(q32:q21) es la anomalía más frecuente en LNH se la encuentra asociada aproximadamente al 50%-85% de los LF, al 15%-30% de los LBDCG5-7 y, sólo ocasionalmente, a otros subtipos histológicos.5 A nivel molecular esta translocación determina la yuxtaposición del protooncogén BCL-2, ubicado a nivel de 18q21.3, con una de las regiones JH de la cadena pesada de las inmunoglobulinas (Igs), localizada en 14q32.3, resultando en la desregulación y sobreexpresión de dicho oncogen.6,8,9 El gen BCL-2 consta de tres exones, la región codificadora abarca la zona 3’ del segundo exón y la 5’ del tercero, la dirección de trascripción es hacia el centrómero. El 60% a 70% de los puntos de ruptura del gen BCL-2 se encuentran en una región de 150 pb conocida como MBR (mayor breakpoint region) que mapea en la zona 3’ no codificadora del tercer exón,10 en tanto que el 15% al 20% de ellos se producen en un segundo cluster denominado mcr (minor cluster region) que dista aproximadamente 30 kb “río abajo”.11 Jäger y col.12 sugieren que la t(14;18) es un proceso bastante más complejo que el que previamente se había descrito, que involucra la recombinación V(D)J a nivel del cromosoma 14 y un mecanismo adicional, aún no bien identificado, que produce las rupturas iniciales en el cromosoma 18. En todos los casos la región codificadora del gen permanece sin alteración y con sus promotores en la vecindad de secuencias estimuladoras de las Igs. El producto codificado por el gen BCL-2 cumple, entre otras funciones, la tarea fisiológica de bloquear la entrada de las células B en apoptosis; de esta manera, la proteína Bcl-2 en expresión permanente confiere al clon neoplásico con la t(14;18) la capacidad de inmortalizarse.13
En los últimos años se detectaron discrepancias entre los resultados citogenéticos y moleculares de la t(14;18), habiéndose determinado que la falla de los métodos moleculares convencionales se encontraba relacionada con la presencia de un porcentaje importante de casos en los cuales los puntos de ruptura de la translocación se ubican por fuera de las secuencias especificas de los primers utilizados hasta ese momento. Esto impide la amplificación por PCR anidada (PCR-N) y hace necesario el empleo de técnicas de PCR de larga distancia (PCR-LD)14-16 que permiten amplificar largos fragmentos de ADN y detectar translocaciones cuyos puntos de ruptura abarcan una amplia región cromosómica, por lo que es de gran utilidad para el abordaje diagnóstico.
Por otra parte, diferentes trabajos describieron variaciones geográficas en la incidencia y el comportamiento de los LNH17-24 así como en la frecuencia de la translocación t(14;18) en LF, que parece ser significativamente más baja en los países asiáticos que en los occidentales,7,25,26 y con muy escasos datos provenientes de América latina.27,28 Esto determinó nuestro interés en evaluar la frecuencia de la t(14;18) en pacientes argentinos con LF y su progresión a LBDCG-S, así como en LBDCG de novo, y comparar estos datos con las series ya publicadas a fin de caracterizar nuestra población dentro de las diferentes regiones geográficas.
Materiales y métodos
Se analizaron 144 pacientes con LNH: 98 con diagnóstico de LF y 46 con LBDCG –29 de novo y 17 LBDCG-S a LF– admitidos en nuestro instituto entre 1993 y 2004. La distribución por sexo y edad se muestra en la tabla 1. En cuanto a los pacientes con diagnóstico de LBDCG de novo, ninguno presentó historia previa de LF y sus estudios histopatológicos no mostraron estructuras foliculares. Se empleó la clasificación de la Organización Mundial de la Salud.1
La extracción del ADN genómico y las amplificaciones por PCR-N y PCR-LD de los rearreglos moleculares del gen BCL-2 se efectuaron de acuerdo con lo previamente descrito.29 Se utilizaron los oligonucleótidos diseñados por Gribben y col.26 para la técnica de PCR-N y por Akasaka y col.15 para la técnica de PCR-LD. Asimismo, se diseñó una PCR-LD multiplex que permite amplificar simultáneamente los rearreglos MBR/IgH y mcr/IgH (Figura 1). Esta contiene: 0.2 μM de cada primer y 0.7 mM de dNTPs. El ciclado consta de 2 min de desnaturalización a 94ºC, 4 ciclos compuestos por 20 seg a 94ºC y 13 min de annealing a 72ºC, 7 ciclos de 20 seg a 94ºC y 13 min a 70ºC, y de 31 ciclos compuestos por 20 seg a 94C, 13 min a 68ºC, incrementando en 15 segundos cada ciclo, se obtienien bandas de 1.9 a 10.7 kb para MBR/IgH y de 1.9 a 9.4 kb para mcr/IgH.
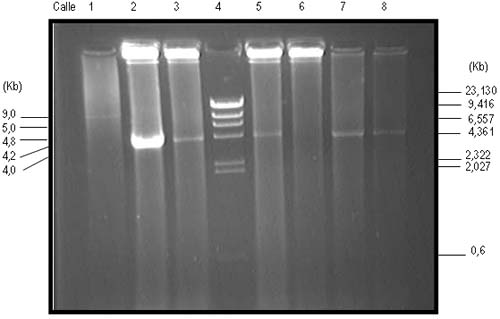
Figura 1. PCR multiplex de larga distancia. Electroforesis en gel de agarosa al 1% teñido con bromuro de etidio, evidenciando los rearreglos moleculares MBR-JH y mcr-JH del gen BCL-2. Calle 4: marcador de peso molecular DNA/lambda Hind III. Calles 1 a 3: pacientes positivos para el rearreglo MBR-JH. Calles 5, 7 y 8: pacientes positivos para el rearreglo mcr-JH. Calle 6: control negativo para ambos rearreglos.
Para el análisis estadístico de las frecuencias poblacionales se utilizó el intervalo de confianza del 95%, calculado como:
a ± 1.96[a(1-a)/n]1/2
donde a es el número de casos positivos en la población estudiada y n el número total de casos evaluados. Se empleó la prueba de χ2 para la comparación entre poblaciones.
Resultados
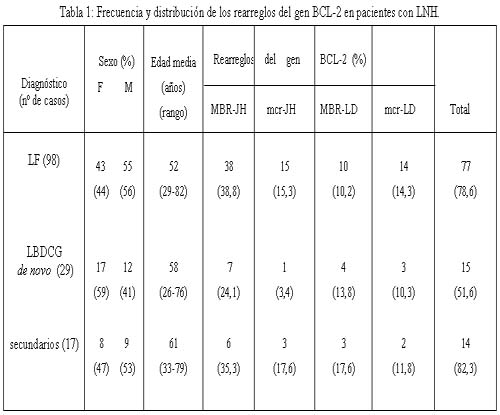
En la tabla 1 se muestran la frecuencia y la distribución de los rearreglos moleculares del gen BCL-2 en pacientes con LF, LBDCG de novo y LBDCG-S.
El análisis de los datos en LF muestra 54.1% (53/98) de rearreglos mediante PCR-N y un incremento del 24.5% al emplear la técnica de PCR-LD, obteniéndose un total de 78.6% de casos positivos para los rearreglos moleculares del gen BCL-2.
Al evaluar los 29 pacientes con diagnóstico de LBDCG de novo utilizando la técnica de PCR-N se halló 27.5% (8/29) de pacientes positivos, y al analizar los restantes con la técnica de PCR-LD se detectaron 7 (24.1%) pacientes positivos adicionales, lo que resultó en un total de 15 casos (51.6%) portadores de la t(14;18).
Por otro lado se analizaron 17 pacientes con LBDCG-S, se observaron 9 (52.9%) casos positivos por PCR-N, con un incremento de 29.4% (5 pacientes) con la PCR-LD: 3 (17.6%) positivos para MBR/IgH y 2 (11.8%) para mcr/IgH, mostrando un total de 14 casos positivos (82.3%).
En conclusión, al comparar el porcentaje total de rearreglos del gen BCL-2 se advierte que los LBDCG-S presentarían una frecuencia similar a la observada en los LF, lo que sugiere la existencia de una entidad diferente de los LBDCG de novo. En lo que respecta a la frecuencia de los rearreglos MBR y mcr en cada subtipo histológico se observa que, en todos los casos, el rearreglo MBR-JH es el que se encuentra en mayor proporción, dato que concuerda con la literatura.
Comparación de los resultados del presente estudio con datos de la literatura
Teniendo en cuenta las frecuencias informadas en la literatura respecto de la variación en la distribución geográfica de los rearreglos moleculares del gen BCL-2, se compararon nuestros datos con los previamente publicados. Para ello se tomaron los resultados de PCR-N tanto para MBR como para mcr que cuentan con mayor número de publicaciones, debido a que la técnica de PCR-LD se ha incorporado recientemente como primer abordaje diagnóstico.
La comparación de nuestros datos de LF con los resultados de la literatura muestra diferencias estadísticamente significativas respecto de los datos agrupados de EE.UU. (p < 0.0001) y superposición con los de las series de Europa y Asia (tabla 2). Estas diferencias desaparecen cuando se utiliza la PCR-LD, lo cual sugiere una distribución diferente de los puntos de ruptura característica de cada región. Asimismo, la correlación de los datos de la población de EE.UU. con las de Europa y Asia también mostró diferencias significativas (p < 0.0001). Cuando se analizaron los puntos de ruptura del gen BCL-2 se observó que nuestros resultados para MBR fueron significativamente menores que los encontrados en la serie de EE.UU. (p < 0.0001), en tanto que los valores de mcr mostraron un incremento significativo respecto de los resultados de Europa (p = 0.002).

Nuestra evaluación de los LBDCG de novo (tabla 2) mostró frecuencias del 27% utilizando la técnica de PCR-N, valor que no presenta diferencias significativas con lo observado en las poblaciones de Europa y EE.UU., encontrándose además una distribución similar en los puntos de ruptura.
Discusión
El análisis genético es quizás el medio más poderoso para resolver la complejidad biológica de los tumores e incrementar el conocimiento de su comportamiento clínico. Esto involucra los análisis citogenéticos, moleculares y citomoleculares que, aplicados al estudio de los LNH, demostraron la presencia de múltiples rearreglos genéticos asociados a diferentes histologías y evolución clínica. Entre ellos se destaca la translocación t(14;18), considerada la anomalía más frecuente en esta neoplasia,5-7 situación que se ve reflejada en nuestros resultados, que muestran su alta incidencia, tanto en LF como en LBDCG.
Simultáneamente, se describieron variaciones geográficas en la incidencia y comportamiento de los LNH. En particular, la mayoría de los linfomas de Occidente son de origen B, mientras que en Oriente son prevalentes los linfomas a células T.19,20 En EE.UU. y los países de Europa occidental aproximadamente un tercio de los LNH son de histología folicular,20,23 a diferencia de los países asiáticos, donde sólo 3% a 13% de los linfomas pertenecen a este subtipo histológico.17,18,21,22,48 Asimismo, los datos provenientes de países africanos muestran frecuencias similares a las asiáticas, con valores entre 1.5% y 13.3%,49,50 con una incidencia mayor en Sudáfrica (33%).20 Los escasos datos de América latina muestran incidencias bajas, tal es el caso de México (4.5%)27 y Ecuador (7.7%).28 Estas variaciones en la frecuencia de los LF en diferentes regiones geográficas parecen estar relacionadas fundamentalmente con el medio ambiente, situación que se ve reflejada en los estudios de emigrantes asiáticos en EE.UU., donde éstos mantienen el riesgo de su país de nacimiento, en tanto que sus descendientes nacidos en EE.UU. presentan incidencias similares a las de la población blanca de ese país.
Diferentes estudios detectaron una marcada variación geográfica en la frecuencia de la t(14;18) en los LF, observándose valores significativamente más altos en la población de EE.UU. que en los países asiáticos (excepto un estudio reciente que muestra valores más altos en diferentes grupos étnicos),44 con frecuencias intermedias en la población europea.20,24 Estos hallazgos parecen sugerir la existencia de diferentes factores que podrían influir la aparición de estos linfomas.
En el presente trabajo evaluamos la frecuencia de la t(14;18) en una serie de pacientes con LF utilizando las técnicas de PCR-N y PCR-LD. Por PCR-N, observamos valores similares a los encontrados en las series provenientes de Europa y Asia, pero significativamente más bajos que los informados en pacientes de EE.UU. De esta manera, nuestros resultados confirmarían, en la frecuencia de los rearreglos moleculares del gen BCL-2, la presencia de un gradiente que va desde rangos relativamente bajos para los países asiáticos y europeos y entre los que se incluye también nuestro estudio (54%) hasta valores más altos (79%) para las series estadounidenses. Con respecto a los puntos de ruptura del gen BCL-2, nuestros datos muestran valores de MBR significativamente menores que aquellos referidos en las series de EE.UU., sin encontrar diferencias respecto de los datos asiáticos y europeos. Por el contrario, nuestra frecuencia de rearreglos en mcr fue similar a la observada en las series de E.UU. y Asia, y más alta respecto de la estimada para Europa.
La introducción de la PCR-LD permitió incrementar el número de casos positivos, llegando así a una frecuencia total del 78.6%, similar a la observada en las series de EE.UU., lo que muestra la alta proporción de puntos de ruptura localizados entre MBR y mcr (24.5%). Estos datos resultan concordantes con los descritos por Albinger-Heigy y col.41 para pacientes europeos, quienes encontraron 36% de casos positivos por PCR-N, alcanzando una frecuencia del 71% por la técnica de PCR-LD. Estos hallazgos, podrían sustentar la hipótesis de que los LF constituirían una enfermedad heterogénea, con entidades morfológicamente similares pero con diferentes rearreglos moleculares y distintas manifestaciones clínicas,24 lo que indica que las diferencias geográficas podrían estar relacionadas con la distribución de los puntos de ruptura que se encuentran ampliamente esparcidos entre MBR y mcr.41
Por otro lado, los LBDCG representan un grupo heterogéneo de enfermedades linfoides en las que no existen indicadores morfológicos, clínicos, inmunohistoquímicos o genéticos confiables que puedan ser usados para definir subtipos.1 Actualmente se considera que existen tres grandes subgrupos de LBDCG de novo: uno, con un perfil de expresión génica correspondiente al de las células del centro germinal (CG); otro, similar al de los linfocitos B activados,52 y un tercero –perfil denominado tipo 3–,51 con expresión heterogénea. Datos recientes52,53 indican que la t(14;18) se encuentra asociada al subtipo CG, lo cual sugiere que desempeñaría un papel importante en la patogénesis de este subgrupo de LBDCG primarios.
Tal como comentamos previamente, los rearreglos del gen BCL-2 han sido detectados en, aproximadamente, un cuarto de los LBDCG de novo. En nuestro estudio, el análisis por PCR-N mostró valores similares a los informados en la literatura, sin verificarse diferencias geográficas. Simultáneamente, los pacientes que resultaron negativos con dicha técnica fueron analizados por PCR-LD, y se observó un incremento del 24.1% en la frecuencia de esta alteración genómica, llegando a un total de 51.6% de los casos con la t(14;18). En este subtipo histológico también encontramos una alta proporción de puntos de ruptura localizados entre MBR y mcr que confirman la importancia del uso de la técnica de PCR-LD en ambos tipos de pacientes. Cabe destacar que éste es, según nuestro conocimiento, el primer análisis de la frecuencia de los rearreglos del gen BCL-2 en LBDCG empleando PCR-LD.
Asimismo, se evaluaron pacientes con LBDCG-S, y se encontró una frecuencia total de rearreglos similar a la observada para los LF (82.3%). Estos datos resultan particularmente interesantes ya que muestran un comportamiento diferente entre los LBDCG de novo y los LBDCG-S, indicando que se trataría de entidades distintas. Esto resulta concordante con un reciente análisis de los perfiles de expresión génica en ambos subtipos de LBDCG, que muestra una expresión diferente en los linfomas de novo respecto de los secundarios, así como una gran similitud entre los linfomas transformados y los LF. Esto podría suger la presencia de caminos alternativos en el desarrollo de ambos subtipos de LBDCG, que podrían estar relacionados con el diferente comportamiento clínico de estos linfomas morfológicamente similares.54
Finalmente, resulta de gran interés el análisis de los puntos de ruptura de los rearreglos del gen BCL-2 a fin de poder establecer su impacto clínico con certeza. Hasta el presente existen resultados escasos y contradictorios sobre su eventual correlación con la evolución clínica de los pacientes con LF,33,55,56 con un estudio reciente que encuentra asociación entre el tipo de rearreglo molecular y el grado histológico de estos linfomas.57 Esta situación muestra la importancia de continuar con este tipo de estudios tendientes a lograr una mejor caracterización biológica de estas entidades.
Los autores no manifiestan “conflictos de interés”.
 Bibliografía del artículo
Bibliografía del artículo
- Harris NL, Jaffe ES, Diebold J y col. World Health Organization classification of neoplastic diseases of the hematopoietic and lymphoid tissues: report of the Clinical Advisory Committee Meeting-Airlie House, Virginia, November 1997. J.Clin Oncol. 1999, 12:3835-3849.
- Horning SJ, Rosenberg SA. The natural history of initially untreated low-grade non-Hodgkin’s lymphomas. N Engl J Med. 1984, 311:1471-1475.
- Gallagher CJ, Gregory WM, Jones AE y col. Follicular lymphoma: prognostic factors for response and survival. J Clin Oncol. 1986, 4:1470-1480.
- Akasaka T, Lossos IS, Levy R. BCL6 gene translocation in follicular lymphoma: a harbinger of eventual transformation to diffuse aggressive lymphoma. Blood. 2003, 102:1931-2.
- Chaganti RSK, Nanjangud G, Schmidt H y col. Recurring chromosomal abnormalities in non-Hodgkin’s lymphoma: Biologic and clinical significance. Sem. Hematol. 2000, 37:396-411.
- Weiss LM, Warnke RA, Sklar J y col. Molecular analysis of the t(14;18) chromosomal translocation in malignant lymphomas. N. Engl. J. Med. 1987, 317:1185-1189.
- Pezzella F, Ralfkiaer E, Gatter KC y col. The 14;18 translocation in European cases of follicular lymphoma: comparison of Southern blotting and the polymerase chain reaction. Br. J Haematol. 1990, 76:58-64.
- Cleary ML, Sklar J. Nucleotide sequence of a t(14;18) chromosome breakpoint in follicular lymphoma and demonstration of a breakpoint cluster region near a transcriptionally active locus on chromosome 18. Proc. Natl. Acad. Sci. USA 1985, 82:7439-7441.
- Tsujimoto Y, Yunis J, Novell PC y col. Cloning of the chromosomal breakpoint of neoplastic B cells with the t(14; 18) chromosome translocation. Science 1984, 226:1097-1099.
- Cleary ML, Smith SD, Sklar J. Cloning and structural analysis of cDNAs for bcl-2 and a hybrid bcl-2/immunoglobulin transcript resulting from the t(14;18) translocation. Cell 1986a, 47:19-28.
- Cleary ML, Sklar J, Galli N. Detection of a second t(14;18) cluster region in follicular lymphomas. J Exp. Med. 1986b, 164:315-320.
- Jäger U, Böcskör S, Le T y col. Follicular lymphomas BCL-2/IgH junctions contain templated nucleotide insertions: Novel insights into the mechanism of t(14;18) translocation. Blood 2000, 95:3520-3529.
- Meijerink JPP. t(14;18), a journey to eternity. Leukemia 1997, 11:2175-2187.
- Akasaka T, Muramatsu M, Ohno H y col. Application of long/distance polymerase chain reaction to detection of junctional sequences created by chromosomal translocation en mature B-cell neoplasma. Blood 1996, 88:985-994.
- Akasaka T, Akasaka H, Yonetani N y col. Refinement of the BCL 2/immunoglobulin heavy chain fusion gene in t(14;18)(q32;q21) by polymerase chain reaction amplification for long targets. Genes Chrom. Cancer 1998, 21:17-19.
- Buchonnet G, Lenain P, Ruminy P y col. Characterization of BCL 2-JH rearrangements in follicular lymphoma: PCR detection of 3’BCL 2 breakpoints and evidence of a new cluster. Leukemia 2000, 14:1563-1569.
- Shih LY, Liang DC. Non-Hodgkin’s lymphomas in Asia. Hematol Oncol Clin North Am 1991, 5:983-1001.
- Kim CW, Kim I, Ko YH y col. Clinicopathological and immunophenotypic study of non-Hodgkin’s lymphoma in Korea: Lymphoreticular Study Group of the Korean Society of Pathologists. J Korean Med Sci 1992, 7:193-198.
- Parkin D, Whelan S, Ferlay J y col. Cancer incidence in five continents, Volume VII. IARC Scientific Publication Nº 143, Lyon, France 1997.
- Anderson JR, Armitage JO, Weisenburger DD. Epidemiology of the non-Hodgkin’s lymphomas: distributions of the major subtypes differ by geographic locations. Non-Hodgkin’s Lymphoma Classification Project. Ann. Oncol. 1998, 9:717-720.
- Ko YH, Kim CW, Park CS y col. REAL classification of malignant lymphomas in the Republic of Korea: incidence of recently recognized entities and changes in Clinicopathologic features: Hematolymphoreticular Study Group of the Korean Society of Pathologists: revised European-American lymphoma. Cancer 1998, 83:806-812.
- Sukpanichnant S, Sonakul D, Piankijagum A y col. Malignant lymphoma in Thailand: changes in the frequency of malignant lymphoma determined from a histopathologic and inmunophenotypic analysis of 425 cases at Siriraj Hospital. Cancer 1998, 83:1197-1204.
- Chiu BC-H. Epidemiology of Non-Hodgkin’s Lymphomas. In: Vose JM, Chiu BC-H, Cheson BD, Dancey J, Wright J. Update on epidemiology and terapeutics for non-Hodgkin’s Lymphoma. American Society of Hematology, Education Program Book 2002, 241-245.
- Biagi J and Seymour J. Insights into the molecular pathogenesis of follicular lymphoma arising from analysis of geographic variation. Blood 2002, 99:4265-4275.
- Mitani S, Aoki N, Mizutani S y col. BCL-2 gene rearrangement analysis of Japanese follicular lymphomas by polymerase chain reaction in formalin-fixed, paraffin-embedded tissue specimens. Jpn J Cancer Res 1993, 84:37-41.
- Gribben JG, Freedman AS, Woo SD y col. All advanced stage non-Hodgkin’s lymphomas with a polymerase chain reaction amplifiable breakpoint of bcl-2 have residual cells containing the bcl-2 rearrangement at evaluation and after treatment. Blood 1991, 78:3275-3280.
- Ortega V, Verastegui E, Flores G y col. Non-Hodgkin’s lymphomas in Mexico. A clinicopathological and molecular analysis. Leuk Lymphoma 1998, 31:575-582.
- Leone PE, Perez JC, Morillo SA, Paz y Miño C. Low incidence of follicular lymphoma and t(14;18)(q32;q21) by polymerase chain reaction analysis. Observations on Ecuadorian patients. Cancer Genet Cytogenet. 2002, 137:72-74.
- Noriega MF, De Brasi C, Narbaitz M, Slavutsky I. Incidence of BCL-2 gene rearrangements in Argentinean non-Hodgkin lymphoma patients: increased frequency of breakpoints outside of MBR and MCR. Blood Cells Mol Dis. 2004, 32:232-9.
- Zelenetz AD, Chu G, Galili N y col. Enhanced detection of the t(14,18) translocation in malignant lymphoma using pulsed-field gel electrophoresis. Blood 1991, 78:1552-1560.
- Liu J, Johnson RM, Traweek ST. Rearrangement of the BCL-2 gene in follicular lymphoma: detection by PCR in both fresh and fixed tissue samples. Diagn Mol Pathol 1993, 2:241-247.
- Guilley ML, Dent GA, Ross DW. Classification and staging of lymphoma by molecular genetics. Cancer 1992, 69:1600-1606.
- López-Guillermo A, Cabanillas F, Mc Donnell TI y col. Correlation of bcl-2 rearrangement with clinical characteristics and outcome in indolent follicular lymphoma. Blood 1999, 93:3081-3087.
- Montoto S, López-Guillermo A, Colomer D y col. Incidence and clinical significance of bcl-2/IgH rearrangement in follicular lymphoma. Leuk. Lymphoma 2003, 44:71-76.
- Benítez J, Robledo M, Santon A y col. Correlation between cytogenetics and molecular analysis of t(14,18) in follicular lymphomas. Cancer Genet Cytogenet 1992, 59:68-72.
- Seité P, Hillion J, D’Agay MF y col. BCL2 gene activation and protein expression in follicular lymphoma: a report on 64 cases. Leukemia 1993, 7:410-417.
- Lee KA, Goepel JR, Winfield DA y col. Investigation of BCL-2 gene rearrangements in a United Kingdom series of low and high grade non-Hodgkin’s lymphomas: Leuk Lymphoma 1993, 11:91-98.
- Lamberchts AC, Hupkes PE, Dorssers LC y col. Translocation (14;18)-positive cells are present in the circulation of the majority of patients with localized (stage I and II) follicular non-Hodgkin’s lymphoma. Blood 1993, 82:2510-2516.
- Poetsch M, Weber-Matthiesen K, Plendl HJ y col. Detection of the t(14;18) chromosomal translocation by interphase cytogenetics with yeast-artificial-chromosome probes in follicular lymphoma and nonneoplastic lymphoproliferation. J Clin Oncol 1996, 14:963-969.
- Johnson A, Brun A, Dictor M y col. Incidence and prognostic significance of t(14;18) translocation in follicle center cell lymphoma of low and high grade: a report from southern Sweden. Ann Oncol 1995, 6:789-794.
- Albinger-Hegyi A, Hochreutener B, Abdou M-T y col. High frequency of t(14;18)-translocation breakpoints outside of major breakpoint and minor cluster regions in follicular lymphomas. Improved polymerase chain reaction protocols for their detection. Am J Pathol 2002, 160:823-832.
- Loke SL, Pittaluga S, Srivastava G y col. Translocation of bcl-2 gene in non-Hodgkin’s lymphomas in Hong Kong Chinese. Br J Haematol 1990, 76:65-69.
- Chen PM, Lin SH, Seto M y col. Rearrangement of bcl-2 genes in malignant lymphomas in Chinese patients. Cancer 1993, 72:3701-3705.
- Peh SC, Shaminie J, Tai YC y col. The pattern and frequency of t(14;18) translocation and immunophenotype in Asian follicular lymphoma. Histopathology 2004, 45:501-10.
- Jacobson JO, Wilkes BM, Kwiatkowski DJ y col. Bcl-2 rearrangements in de novo diffuse large cell lymphoma. Association with distinctive clinical features. Cancer 1993, 72:231-236.
- Gascoyne RD, Adomat SA, Krejewski S y col. Prognostic significance of Bcl-2 protein expression and Bcl-2 gene rearrangement in diffuse aggressive non-Hodgkin’s lymphoma. Blood 1997, 90:244-251.
- Volpe G, Vitolo U, Carbone A y col. Molecular heterogeneity of B-lineage diffuse large cell lymphoma. Genes Chrom Cancer 1996, 16:21-30.
- Intragumtornchai T, Wannakrairoj P, Chaimongkol B y col. Non-Hodgkin’s lymphomas in Thailand: a retrospective pathologic and clinical analysis of 1391 cases. Cancer 1996, 78:1813-1819.
- Obafunwa JO, Akinsete I. Malignant lymphomas in Jos, Nigeria: a ten-year study. Centr Afr J Med 1992, 38:17-25.
- Walter PR, Klotz F, Alfy-Gattas T y col. Malignant lymphomas in Gabon (equatorial Africa): a morphologic study of 72 cases. Hum Pathol 1991, 22:1040-1043.
- Alizadeh AA, Elsen MB, Davis RE y col. Distinct types of diffuse large B-cell lymphoma identidied by gene expression profiling. Nature 2000, 403:503-511.
- Rosenwald A, Wright G, Chan WC y col. The use of molecular profiling to predict survival after chemotherapy for diffuse large-B-cell lymphoma. N Engl J Med. 2002, 346:1937-47.
- Huang JZ, Sanger WG, Greiner TC y col. The t(14;18) defines a unique subset of diffuse large B-cell lymphoma with a germinal center B-cell gene expression profiles. Blood 2002, 99:2285-2290.
- Lossos I, Alizadeh AA, Diehn M y col. Transformation of follicular lymphoma to diffuse large-cell lymphoma: Alternative patterns of c-myc and its regulates genes. PNAS 2002, 99:8886-8891.
- Buchonnet G, Jardin F, Jean N y col. Distribution of BCL-2 breakpoints in follicular lymphoma and correlation with clinical features: specific subtypes or same disease Leukemia 2002, 16:1852-1856.
- Montoto S, López-Guillermo A, Colomer D y col. Incidence and clinical significance of bcl-2/IgH rearrangements in follicular lymphoma. Leuk Lymphoma 2003, 44:71-76.
- Colleoni GW, Duarte LC, Kerbauy FR y col. Correlation between histological subtype and type of bcl-2/IgH rearrangements in follicular lymphomas. Leuk Lymphoma 2004, 45:331-338.
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC





 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: Patrocinio y reconocimiento
Patrocinio y reconocimiento


