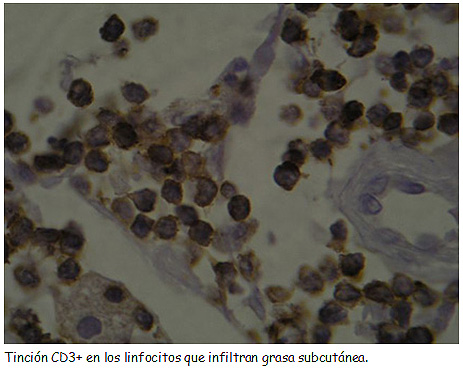
Bibliografía del artículo
Bibliografía del artículo
1. Seçmeer G, Sakalli H, Gök F, et. al. Fatal cytophagic histiocytic panniculitis. Pediatr Dermatol 2005; 21(3):246-249.
2. Kenneth L, McClain. Up to Date. Haemophagocytic lymphohistiocytosis. 2005.
3. Reiner AP, Spivak JL. Haemophagocytic lymphohistiocytosis: a report of 23 new patients and a review of the literature. Medicine (Baltimore) 1998; 67(6):369-388.
4. Wong KF, Hui PK, Chan JK, Chan YW, Ha SY. The acute lupus haemophagocytic syndrome. Ann Intern Med 1991 ; 114 B(5):387-390.
5. Dhote R, Simon J, Papo T, et al. Reactive haemophagocytic syndrome in adult systemic disease: report of 26 cases and literature review. Arthritis Rheum 2003; 49(5):633-639.
6. Karras A, Thervet E, Legendre C. Haemophagocytic syndrome in renal transplant recipients: report of 17 cases and review of literature. Transplantation 2004; 77(2):238-243.
7. De Kerguenec C, Hillaire S, Molinie V, et al. Hepatic manifestations of haemophagocytic syndrome: a study of 30 cases. Am J Gastroenterol 2001; 96(3):852-857.
8. Esumi N, Ikshima S, Hibi S, Todo S, Imashuku S. High serum ferritin level as a marker of malignant histiocytosis and virus-associated haemophagocytic syndrome. Cancer 1988; 61(10):2071-2076.
9. Huilgol SC, Fenton D, Pambakian H, Cerio R, McGibbon DM, Black MM. Fatal cytophagic paniculitis and haemophagocytic syndrome. Clinical & Experimental Dermatology 1998; 23:51-55.
10. Cheng FY, Tsui WMS, Yeung WTC, Ip LS, Ng CS. Intravascular Iymphomatosis: a case presenting with encephalomyelitis and reactive haemophagocytic syndrome diagnosed by renal biopsy. Histopathology 1997; 31:552-554.
11. Stephan JL, Kone-Paut 1, Galambrun C, Mouy R, Bader-Meunier B, Prieur AM. Reactive haemophagocytic syndrome in children with inflammatory disorders. A retrospective study of 24 patients. Rheumatology 2001; 40:1285-1292.
12. Cho K, Kim C, Yang S, Kim B, Kim J. Angiocentric T celllymphoma of the skin presentin as inflarnmatory nodules of the leg. Clinical & Expe Pathol 2000; 53:636-638.
13. Kotz EA, Anderson D, Thiers BH. Cutaneous T-cell lymphoma. J Eur Acad Dermatol Venereol 2003; 17:131-137.
14. Artigues Barceló A, Ferragut Reus M, Sánchez C, Amenguall, Matanza 1, Sanz Parras MS. Síndrome hemofagocítico y !infoma cutáneo de células T. An Med Interna (Madrid) 2004; 21:131-134.
15. Mahadeva U, Allport T, Bain B, Chan WK. Haemophagocytic syndrome and histiocytic necrotising lymphadenitis (Kikuchi's disease). J Clin Path 2000; 53(8):636-638.
16. Iwasaki H, Hashimoto K, Takada N, Nakayama T, Ueda T, Nakamura T. Fulminant Rickettsia tsutsugamushi infection associated with haemophagocytic syndrome. The Lancet 1994, 343 (8907):1236.
17. Aouba A, De Bandt N, Aslangul E, Atkhen N, Patri B. Haemophagocytis syndrome in a rheumatoid artrhtitis patient treated with infliximab. Rheum 2003; 42(6):800-802.





 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: