Bibliografía del artículo
Bibliografía del artículo
1. Esch BE, Carr JE. Secretin as a treatment for autism: a review of the evidence. Journal of Autism and Developmental Disorders 2004; 34(5):543-556.
2. Gomut M, Bernard FA, Davis MH et al. Change detection in children with autism:an auditory event-related fMRI study. NeuroImage 2006; 29:475-484.
3. Ozonoff S, Rogers SJ. From Kanner to the Millennium. Scientific advances that have shaped clinical practice. In Ozonoff S, Rogers SJ, Hendren RL. Autism spectrum disorders: a research review for practitioners, 2003; pp. 3-33. American Psychiatric Publishing Inc.: Arlington, VA.
4. Fombonne E. Epidemiology of autistic disorder and other pervasive developmental disorders. Journal of Clinical Psychiatry 2005; 66(10):3-8.
5. Steingard RJ, Connor DF, Au T. Approaches to psychopharmaology. In Bauman ML, Kemper TL. The neurobiology of autism (2nd edition) 2005; pp. 79-102. The John Hopkins University Press: Baltimore, Maryland.
6. Veenstra-VanderWeele J, Christian SL, Cook EH Jr. Autism as a paradigmatic complex genetic disorder. Annual Review of Genomics and Human Genetics 2004; 5:379-405.
7. Molloy CA, Morrow AL, Meinzen-Derr J et al. Elevated cytokine levels in children with autism spectrum disorder. Journal of Neuroimmunology 2006; 172(1-2):198-205.
8. Hazlett HC, Poe MD, Gerig G, Smith RG, Piven J. Cortical gray and white brain tissue volume in adolescents and adults with autism. Biological Psychiatry 2006; 59:1-6.
9. Geier MR, Geier DA. The potential importance of steroids in the treatment of autistic spectrum disorders and other disorders involving mercury toxicity. Medical Hypotheses 2005; 64(5):946-954.
10. Arn TL, Stodgell CJ, Rodier PM. The teratology of autism. International Journal of Developmental Neuroscience 2005; 23:189-199.
11. Bauman M, Filipek PA, Kemper TL. Early infantile autism. In Cerebellum and Cognition. Eds. J. D. Schmahmann, pp 367-386. San Diego: Academic Press.
12. Levy SE, Hyman SL. Novel treatments for autistic spectrum disorders. Mental Retardation and Developmental Disabilities 2005; 11:131-142.
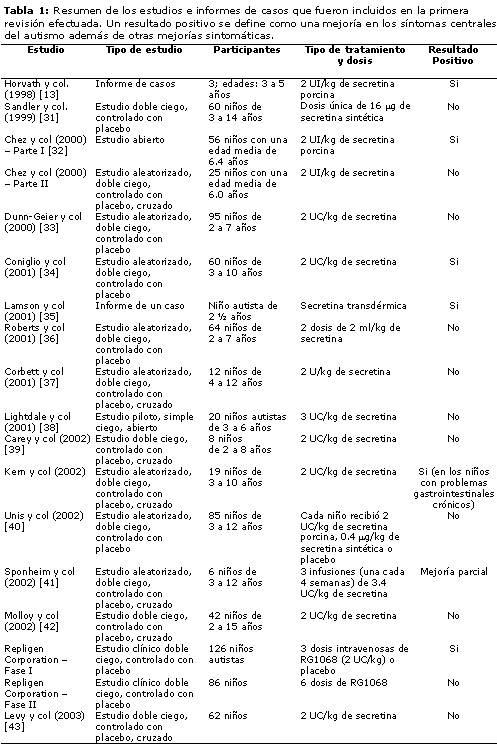
13. Horvath K, Stefanatos G, Sokolski KN, Wachtel R, Nabors L, Tildon J. Improved social and language skills after secretin administration in patients with autistic spectrum disorders. Journal of Association Academy of Minority Physicians 1998; 9:9-15.
14. Dogrukol-Ak D, Tore F, Tuncel N. Passage of VIP/PACAP/ secretin family across the blood-brain barrier: therapeutic effects. Current Pharmacological Design 2004; 10:1325-1340.
15. Koves K, Kausz M, Reser D et al. Secretin and autism: a basic morphological study about the distribution of secretin in the nervous system. Regulatory Peptides 2004; 123:209-216.
16. Kuntz A, Clement HW, Lehnert W et al. Effects of secretin on extracellular amino acid concentrations in rat hippocampus. Journal of Neural Transmission 2004; 111:931-939.
17. Yung WH, Leung PS, Ng SSM et al. Secretin facilitates GABA transmission in the cerebellum. Journal of Neuroscience 2001; 21(18):7063-7068.
18. Pallanti S, Lassi S, La Malfa G et al. Short report: autistic gastrointestinal and eating symptoms treated with secretin: a subtype of autism. Clinical Practice and Epidemiology in Mental Health 2005; 1(24).
19. Horvath K, Papadimitriou JC, Rabsztyn A et al. Gastrointestinal abnormalities in children with autistic disorder. Journal of Pediatrics 1999; 135:559-563.
20. Chung I, Li P, Lee K, Chang T, Chey WY. Dual inhibitory mechanism of secretin action on acid secretion in totally isolated, vascularly perfused rat stomach. Gastroenterology 1994; 107:1751-1758.
21. Kern JK, Miller VS, Evans PA, Trivedi MH. Efficacy of porcine secretin in children with autism and pervasive developmental disorder, Journal of Autism and Developmental Disorders 2002; 32(3):153-160.
22. Toda Y, Mori K, Hashimoto T et al. Administration of secretin for autism alters dopamine metabolism in the central nervous system. Brain and Development 2005; (in press).
23. Segawa M. A neurological model of infantile autism (in Japanese). No No Kagaku 1998; 20:169-75.
24. Ratliff-Schaub K, Carey T, Reeves GH, Rogers MM. Randomized controlled trial of transdermal secretin on behavior of children with autism. Autism 2005; 9(3):256-265.
25. Repligen Corporation. Phase 3 study of secretin for autism fails to meet dual primary endpoints development of secretin for schizophrenia to continue. Press Release, 2004.
26. Welch MG, Keune JD, Welch-Horan TB, Anwar N, Anwar M, Ruggiero DA. Secretin activates visceral brain regions in the rat including areas abnormal in autism. Cellular and Molecular Neurobiology 2003; 23:817-837.
27. Owley T, McMahon W, Cook EH et al. Multisite, double-blind, placebo-controlled trial of porcine secretin in autism. Journal of the American Academy of Child and Adolescent Psychiatry 2001; 40(11):1293-1299.
28. Sandler A. Placebo effects in developmental disabilities: Implication for research and practice. Mental Retardation and Developmental Disabilities Research Reviews 2005; 11:164-170.
29. Handen B, Hofkosh D. Secretin in children with autistic disorder: a double-blind, placebo controlled trial. Journal of Developmental and Physical Disabilities 2005; 17(2):95-106.
30. Richman DM, Reese RM, Daniels D. Use of evidence-based practice as a method for evaluating the effects of secretin on a child with autism. Focus on Autism and Other Developmental Disabilities 1999; 14(4):204-211.
31. Sandler AD, Sutton KA, Deweese J, Girardi MA, Shepard V, Bodfish JW. Lack of benefit of a single dose of synthetic human secretin in the treatment of autism and pervasive developmental disorder. New England Journal of Medicine 1999; 341(24):1801-1806.
32. Chez MG, Buchanan CP, Bagan BT et al. Secretin and autism: a two part clinical investigation. Journal of Autism and Developmental Disorders 2000; 30:87-94.
33. Dunn-Geier J, Ho HH, Auesperg E et al. Effect of secretin on children with autism: a randomized controlled trial. Developmental Medicine and Child Neurology 2000; 42:796-802.
34. Coniglio SJ, Lewis JD, Lang C et al. A randomized, double-blind, placebo-controlled trial of single-dose intravenous secretin treatment for children with autism. Journal of Pediatrics 2001; 138:649-655.
35. Lamson DW, Plaza SM. Transdermal secretin for autism-a case report. Alternative Medicine Review 2001; 6:311-313.
36. Roberts W, Weaver L, Brian J et al. Repeated doses of porcine secretin in the treatment of autism: a randomized, placebo-controlled trial. Pediatrics 2001; 107(5):E71.
37. Corbett B, Khan K, Czapansky-Beilmand D et al. A double-blind, placebo-controlled crossover study investigating the effect of porcine secretin in children with autism. Clinical Pediatrics 2001; 40:327-331.
38. Lightdale JR, Hayer C, Duer A et al. Effects of intravenous secretin on language and behavior of children with autism and gastrointestinal symptoms: a single-blinded, open-label pilot study. Pediatrics 2001; 108(5):E90.
39. Carey T, Ratliff-Schaub K, Funk J, Weinle C, Myers M, Jenks J. Double-blind placebo-controlled trial of secretin: effects on aberrant behavior in children with autism. Journal of Autism and Developmental Disorders 2002; 32(3):161-167.
40. Unis AS, Munson JA, Rogers SJ et al. A randomized, double-blind, placebo-controlled trial of porcine versus synthetic secretin for reducing symptoms of autism. Journal of the American Academy of Child and Adolescent Psychiatry 2002, 44(11):1315-1231.
41. Sponheim E, Oftedal G, Helveschou SB. Multiple doses of secretin in the treatment of autism: a controlled study. Acta Paediatrica 2002; 91:540-545.
42. Molloy CA, Manning-Courtney P, Swayne S et al. Lack of benefit of intravenous synthetic human secretin in the treatment of autism. Journal of Autism and Developmental Disorders 2002; 32(6):545-551.
43. Levy SE, Souders MC, Wray J et al. Children with autistic spectrum disorders. Comparison of placebo and single dose of human synthetic secretin. Archives of Disease in Childhood 2003; 88:731-736.





 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: