Bibliografía del artículo
Bibliografía del artículo
1. Rayner B. Selective imidazoline agonist moxonidine plus the ACE inhibitor ramipril in hypertensive patients with impaired insulin sensitivity: partners in a successful MARRIAGE? Curr Med Res Opin 2004; 20:359-67.
2. Eckel RH, Frundy SM, Zimmet PZ. The metabolic syndrome. Lancet 2005; 365:1415-28.
3. Alberti KGMM, Zimmet P, Shaw J for the IDF Epidemiology Task Force Consensus Group. The metabolic syndrome - a new worldwide definition. Lancet 2005; 366:1059-62.
4. Kahn R, Buse J, Ferrannini E, Stern M. The metabolic syndrome: time for a critical appraisal. Joint statement from the American Diabetes Association and the European Association for the Study of Diabetes. Diabetologia 2005; 48:1684-99.
5. Gale EAM. The myth of the metabolic syndrome. Diabetologia 2005; 10:1873-5.
6. Various. The metabolic syndrome (letters). Lancet 2005; 366:1921-4.
7. Florez H, Silva E, Fernandez V et al. Prevalence and risk factors associated with the metabolic syndrome and dyslipidemia in White, Black, Amerindian and Mixed Hispanics in Zulia State, Venezuela. Diabetes Res Clin Pract 2005; 69:63-77.
8. Rosenbaum P, Gimeno SG, Sanudo A, Franco LJ, Ferreira SR; Japanese-Brazilian Diabetes Study Group. Analysis of criteria for metabolic syndrome in a population-based study of Japanese-Brazilians. Diabetes Obes Metab 2005; 7:352-9.
9. Ko GT, Cockram CS, Chow CC et al. High prevalence of metabolic syndrome in Hong Kong Chinese - comparison of three diagnostic criteria. Diabetes Res Clin Pract 2005; 69:160-8.
10. Gu D, Reynolds K, Wu X et al for the InterASIA Collaborative Group. Prevalence of the metabolic syndrome and overweight among adults in China. Lancet 2005; 365:1398-405.
11. Lorenzo C, Williams K, González Villalpando C, Haffner SM. The prevalence of the metabolic syndrome did not increase in Mexico City between 1990-1992 and 1997-1999 despite more central obesity. Diabetes Care 2006; 29:685-91.
12. Fraser B. Latin America's urbanization is boosting obesity. Lancet 2005; 365:1955-6.
13. Prentice AM. The emerging epidemic of obesity in developing countries. Int J Epidemiol 2006; 35:93-9.
14. International Diabetes Federation. www.idf.org. Last accessed 8 May 2006.
15. Minstério do Planejamento, Orçamento e Gestao. www.ibge.gov.br/home/statistics/populacao. Last accessed 2 May 2006.
16. Ford ES, Giles WH, Dietz WH. Prevalence of the metabolic syndrome among US adults: findings from the third National Health and Nutrition Examination Survey. JAMA 2002; 287:356-9.
17. Czupryniak L, Saryusz-Wolska M, Pawlowski M, Loba J. Elevated systolic blood pressure is present in almost all individuals with newly diagnosed diabetes. J Hum Hypertens 2006; 20:231-3.
18. Hoffmann IS, Cubeddu LX. Clustering of silent cardiovascular risk factors in apparently healthy Hispanics. J Hum Hypertens 2002; 16(Suppl 1):S137-41.
19. Zeller M, Steg PG, Ravisy J et al for the Observatoire des Infarctus de Cote-d'Or Survey Working Group. Prevalence and impact of metabolic syndrome on hospital outcomes in acute myocardial infarction. Arch Intern Med 2005; 165:1192-8.
20. Isomaa B, Almgren P, Tuomi T et al. Cardiovascular morbidity and mortality associated with the metabolic syndrome. Diabetes Care 2001; 24:683-9.
21. Lakka HM, Laaksonen DE, Lakka TA et al. The metabolic syndrome and total and cardiovascular disease mortality in middle-aged men. JAMA 2002; 288:2709-16.
22. Girman CJ, Rhodes T, Mercuri M et al for the 4S Group and the AFCAPS/TexCAPS Research Group. The metabolic syndrome and risk of major coronary events in the Scandinavian Simvastatin Survival Study (4S) and the Air Force/Texas Coronary Atherosclerosis Prevention Study (AFCAPS/TexCAPS). Am J Cardiol 2004; 93:136-41.
23. Malik S, Wong ND, Franklin SS et al. Impact of the metabolic syndrome on mortality from coronary heart disease, cardiovascular disease, and all causes in United States adults. Circulation 2004; 110:1245-50.
24. Bonora E, Targher G, Formentini G et al. The metabolic syndrome is an independent predictor of cardiovascular disease in type 2 diabetic subjects. Prospective data from the Verona Diabetes Complications Study. Diabes Med 2004; 21:52-8.
25. Ford ES. The metabolic syndrome and mortality from cardiovascular disease and all-causes: findings from the National Health and Nutrition Examination Survey II Mortality Study. Atherosclerosis 2004; 173:309-14.
26. Dekker JM, Girman C, Rhodes T et al. Metabolic syndrome and 10-year cardiovascular disease risk in the Hoorn Study. Circulation 2005; 112:666-73.
27. Sundström J, Risérus U, Byberg L, Zethelius B, Lithell H, Lind L. Clinical value of the metabolic syndrome for long term prediction of total and cardiovascular mortality: prospective, population based cohort study. BMJ 2006; 332:878-82.
28. Rédon J, Lazano JV, Cea-Calvo L et al. Metabolic syndrome increases the risk of hypertension-induced organ damage in hypertensive patients attending primary care centers: ERIC-HTN study. Am J Hypertens 2005; 18(No. 5, part 2):203A (abstract).
29. Burlando G, Sánchez RA, Ramos FH, Mogensen CE, Zanchetti A for the Latin American Experts Group. Latin American consensus on diabetes mellitus and hypertension. J Hypertens 2004; 22:2229-41.
30. Haffner SM, Lehto S, Ronnemaa T, Pyörälä K, Laakso M. Mortality from coronary heart disease in subjects with type 2 diabetes and in nondiabetic subjects with and without prior myocardial infarction. N Engl J Med 1998; 339:229-34.
31. Boden-Abela B. Current understanding of multiple risk factors as the metabolic syndrome: distillation of deconstruction? Semin Neurol 2006; 26:108-16.
32. Davis TM, Millns H, Stratton IM, Holman RR, Turner RC. Risk factors for stroke in type 2 diabetes mellitus: United Kingdom Prospective Diabetes Study (UKPDS) 29. Arch Intern Med 1999; 159:1097-103.
33. Grundy SM, Hansen B, Smith SC Jr, Cleeman JI, Kahn RA for the American Heart Association; National Heart, Lung, and Blood Institute; and American Diabetes Association. Clinical management of metabolic syndrome: report of the American Heart Association/National Heart, Lung, and Blood Institute/American Diabetes Association conference on scientific issues related to management. Circulation 2004; 109:551-6.
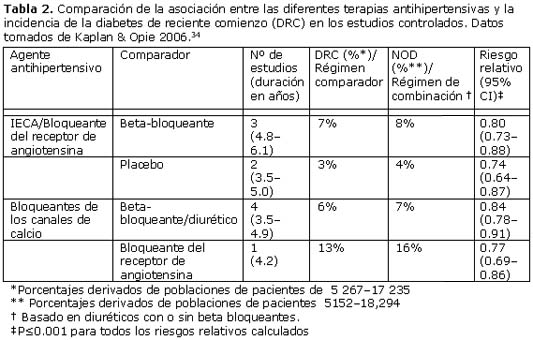
34. Kaplan NM, Opie LH. Controversies in cardiology 2: controversies in hypertension. Lancet 2006; 367:168-76.
35. Beevers G. The end of blockers for uncomplicated hypertension? Lancet 2005; 366:1510-11.
36. Gillespie EL, White CM, Kardas M, Lindberg M, Coleman CI. The impact of ACE inhibitors or angiotensin II type 1 receptor blockers on the development of new-onset type 2 diabetes. Diabetes Care 2005; 28:2261-6.
37. Cheung BM, Cheung GT, Lauder IJ, Lau CP, Humana CR. Meta-analysis of large outcome trials of angiotensin receptor blockers in hypertension. J Hum Hypertens 2006; 20:37-43.
38. Abuissa H, Jones PG, Marso SP, O'Keefe JH Jr. Angiotensin-converting enzyme inhibitors or angiotensin receptor blockers for prevention of type 2 diabetes: a meta-analysis of randomized clinical trials. J Am Coll Cardiol 2005; 46:821-6.
39. Dahlof B, Devereux RB, Kjeldsen SE, et al for the LIFE Study Group. Cardiovascular morbidity and mortality in the Losartan Intervention For Endpoint reduction in hypertension study (LIFE): a randomised trial against atenolol. Lancet 2002; 359:995-1003. 40. Dahlof B, Sever PS, Poulter NR et al for the ASCOT Investigators. Prevention of cardiovascular events with an antihypertensive regimen of amlodipine adding perindopril as required versus atenolol adding bendroflumethiazide as required, in the Anglo-Scandinavian Cardiac Outcomes Trial-Blood Pressure Lowering Arm (ASCOT-BPLA): a multicentre randomised controlled trial. Lancet 2005; 366:895-906.
41. Verdecchia P, Reboldi G, Angeli F et al. Adverse prognostic significance of new diabetes in treated hypertensive. Hypertension 2004; 43:963-9.
42. Alderman MH, Cohen H, Madhavan S. Diabetes and cardiovascular events in hypertensive patients. Hypertension 1999; 33:1130-34.
43. Dunder K, Lind L, Zethelius B, Berglund L, Lithell H. Increase in blood glucose concentration during antihypertensive treatment as a predictor of myocardial infarction: population based cohort study. BMJ 2003; 326:681-6.
44. Moser M. Is new-onset diabetes of clinical significance in treated hypertensive patients? Con J Clin Hypertens (Greenwich) 2006; 8:126-32.
45. Verdecchia P, Angeli F, Gattobigio R. New-onset diabetes in treated hypertensive patients. Curr Hypertens Rep 2003; 7:174-9.
46. Olsen MH, Fossum E, Hoieggen A et al. Long-term treatment with losartan versus atenolol improves insulin sensitivity in hypertension: ICARUS, a LIFE substudy. J Hypertens 2005; 23:891-8.
47. Kurtz TW. New treatment strategies for patients with hypertension and insulin resistance. Am J Med 2006; 119(Suppl 1):S24-30.
48. Haenni A, Lithell HO. Moxonidine improves insulin sensitivity in insulin-resistant hypertensives. J Hypertens 1999; 17(suppl 3):S29-S35.
49. Palaniappan L, Carnethon MR, Wang Y et al for the Insulin Resistance Atherosclerosis Study. Predictors of the incident metabolic syndrome in adults: the Insulin Resistance Atherosclerosis Study. Diabetes Care 2004; 27:788-93.
50. Lerario DDG, Gimeno SG, Franco LJ et al for the Grupo de Estudo de Diabetes na Comunidade Nipo-Brasiliera. Weight excess and abdominal fat in the metabolic syndrome among Japanese-Brazilians. Rev Saúde Pública 2002; 36:4-11.
51. Sanjuliani AF, Genelhu de Abreu J, Braga U. Francischetti EA. Effects of moxonidine on the sympathetic nervous system, blood pressure, plasma renin activity, plasma aldosterone, leptin, and metabolic profile in obese hypertensive patients. J Clin Basic Cardiol 2004; 7:19-25.
52. Bastard JP, Maachi M, Lagathu C et al. Recent advances in the relationship between obesity, inflammation, and insulin resistance. Eur Cytokine Netw 2006; 17:4-12.
53. Vettor R, Milan G, Rossato M, Federspil G. Review article: adipocytokines and insulin resistance. Aliment Pharmacol Ther 2005; 22(Suppl 2):3-10.
54. Sharma AM, Wagner T, Marsalek P. Moxonidine in the treatment of overweight and obese patients with the metabolic syndrome: a postmarketing surveillance study. J Hum Hypertens 2004; 18:669-75.
55. Abellan J, Leal M, Hernandez-Menarguez F et al. Efficacy of moxonidine in the treatment of hypertension in obese, noncontrolled hypertensive patients. Kidney Int Suppl 2005; 93:S20-S24.
56. Jacob S, Klimm HJ, Rett K, Helsberg K, Haring HU, Godicke J. Effects of moxonidine vs. metoprolol on blood pressure and metabolic control in hypertensive subjects with type 2 diabetes. Exp Clin Endocrinol Diabetes 2004; 112:315-22.
57. Esler M, Wiesner G. Development of the metabolic syndrome along the female biological life-path. J Hypertens 2006; 24:43-5.
58. Kaaja R, Manhem K, Tuomilehto J. Treatment of postmenopausal hypertension with moxonidine, a selective imidazoline receptor agonist. Int J Clin Pract Suppl 2004; 139:26-32.
59. Orynchak MA, Neyko EM, Chovganyuk OS. Role of moxonidine in insulin secretion and endothelial dysfunction in the patients with insulin resistance. Am J Hypertens 2005; 18(No. 5, part 2):202A-203A (abstract).
60. Chazova I, Almazov VA, Shlyakhto E. Moxonidine improves glycaemic control in mildly hypertensive, overweight patients: a comparison with metformin. Diabetes, Obesity and Metabolism 2006; 8:456-465.
61. Fenton C, Keating GM, Lyseng-Williamson KA. Moxonidine: a review of its use in essential hypertension. Drugs 2006; 66:477-96.
62. Schachter M. Moxonidine: a review of safety and tolerability after seven years of clinical experience. J Hypertens Suppl 1999; 17:S37-9.
63. Clement D. Tolerability profile of the antihypertensive moxonidine in clinical use: data from 14 post-marketing surveillance studies involving > 91,000 patients (article in preparation, May 2006).
64. Konrady AO, Kasherininov YR, Shavarov AA et al. How can we block sympathetic overactivity? Effects of rilmenidine and atenolol in overweight hypertensive patients. J Hum Hypertens 2006; 20:398-406.
65. Chen J, Muntner P, Hamm LL et al. The metabolic syndrome and chronic kidney disease in U.S. adults. Ann Intern Med 2004; 140:167-74.
66. Kincaid-Smith P. Hypothesis: obesity and the insulin resistance syndrome play a major role in end-stage renal failure attributed to hypertension and labelled 'hypertensive nephrosclerosis'. J Hypertens 2004; 22:1051-55.
67. Koomans HA, Blankestijn PJ, Joles JA. Sympathetic hyperactivity in chronic renal failure: a wake-up call. J Am Soc Nephrol 2004; 15:524-37.
68. Neumann J, Ligtenberg G, Klein II, Koomans HA, Blankestijn PJ. Sympathetic hyperactivity in chronic kidney disease: pathogenesis, clinical relevance, and treatment. Kidney Int 2004; 65:1568-76.
69. Blankestijn PJ. Sympathetic hyperactivity in chronic kidney disease. Nephrol Dial Transplant 2004; 19:1354-7.
70. El Nahas AM, Bello AK. Chronic kidney disease: the global challenge. Lancet 2005; 365:331-40.
71. Strojek K, Grzeszczak W, Gorska J, Leschinger MI, Ritz E. Lowering of microalbuminuria in diabetic patients by a sympathicoplegic agent: novel approach to prevent progression of diabetic nephropathy? J Am Soc Nephrol 2001; 12:602-5.
72. Neumann J, Ligtenberg G, Oey L, Koomans HA, Blankestijn PJ. Moxonidine normalizes sympathetic hyperactivity in patients with eprosartan-treated chronic renal failure. J Am Soc Nephrol 2004; 15:2902-7.
73. Vonend O, Marsalek P, Russ H, Wulkow R, Oberhauser V, Rump LC. Moxonidine treatment of hypertensive patients with advanced renal failure. J Hypertens 2003; 21:1709-17.
74. Cosio FG, Kudva Y, Van der Velde M et al. New onset hyperglycemia and diabetes are associated with increased cardiovascular risk after kidney transplantation. Kidney Int 2005; 67:2415-21.
75. Krentz AJ, Wheeler DC. New-onset diabetes after transplantation: a threat to graft and patient survival. Lancet 2005; 365:640-42.
76. Radermacher J, Mengel M, Ellis S et al. The renal arterial resistance index and renal allograft survival. N Engl J Med 2003; 349:115-24.
77. Punzi HA, Punzi CE. Metabolic issues on the Antihypertensive and Lipid-Lowering Heart Attack Trial study. Curr Hypertens Res 2004; 6:106-10.
78. Nosadini R, Tonolo G. Relationship between blood glucose control, pathogenesis and progression of diabetic nephropathy. J Am Soc Nephrol 2004; 15(Suppl 1):S1-S5.
79. Mason JM, Dickinson HO, Nicolson DJ, Campbell F, Ford GA, Williams B. The diabetogenic potential of thiazide-type diuretic and beta-blocker combinations in patients with hypertension. J Hypertens 2005; 23:1777-81.
80. Salvetti A, Ghiadoni L. Thiazide diuretics in the treatment of hypertension. J Am Soc Nephrol 2006; 17(Suppl 2):S25-S29.
81. Gress TW, Nieto FJ, Shahar E, Wofford MR, Brancati FL. Hypertension and antihypertensive therapy as risk factors for type 2 diabetes mellitus. Atherosclerosis Risk in Communities Study. N Engl J Med 2000 30; 342:905-12.
82. Lindholm LH, Carlberg B, Samuelsson O. Should blockers remain first choice in the treatment of primary hypertension? A meta-analysis. Lancet 2005; 366:1545-53.
83. Various blockers for the treatment of primary hypertension. Lancet 2006; 367:208-10 (letters) [Authors' response Ibid 210].






 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: