Bibliografía del artículo
Bibliografía del artículo
1. Pearson D, Shively JE, Clark BR, Geschwind II, Barkley M, Nishioka RS, Bern HA. Urotensin-II: a somatostatin like-peptide in the caudal neurosecretory system of fishes. Proc Natl Acad Sci USA 77:5021-5024, 1980.
2. Totsune K, Takahashi K, Arihara Z, Sone M, Satoh F, Ito S, Kimura Y, Sasano H, Murakami O. Role of urotensin II in patients on dialysis. Lancet 358:810-811, 2001.
3. Coulouarn Y, Lihrmann I, Jegou S, Anouar Y, Tostivint H, Beauvillain JC, Conlon JM, Bern HA, Vaudry H. Cloning of the cDNA encoding the urotensin II precursor in frog and human reveals intense expression of the urotensin II gene in motorneurons of the spinal cord. Proc Natl Acad Sci USA 95:15803-15808, 1998.
4. Maguire JJ, Kuc RE, Wiley KE, Kleinz MJ, Davenport AP. Cellular distribution of immunoreactive urotensin-II in human tissues with evidence of increased expression in atherosclerosis and a greater constrictor response of small compared to large coronary arteries. Peptides 25(10):1767-74, 2004.
5. Affolter J, Webb DJ. Urotensin II: a new mediator in cardiopulmonary regulation? Lancet 358:774-775, 2001.
6. Bottrill FE, Douglas SA, Hiley CR, White R. Human urotensin-II is an endothelium-dependent vasodilator in rat small arteries. Br J Pharmacol 130:1865-1870, 2000.
7. Cheung BM, Leung R, Man YB, Wong LY. Plasma concentration of urotensin II is raised in hypertension. J Hypertens 22(7):1341-1344, 2004.
8. Russell FD, Meyers D, Galbraith AJ, Bett N, Toth I, Kearns P, Molenaar P. Elevated plasma levels of human urotensin-II immunoreactivity in congestive heart failure. Am J Physiol Heart Circ Physiol 285:H 1576-H1581, 2003.
9. Lapp H, Boerrigter G, Costello-Boerrigter LC, Jaekel K, Scheffold T, Krakau I, Schramm M, Guelker H, Stasch JP. Elevated plasma human urotensin-II-like immunoreactivity in ischemic cardiomyopathy. Int J Cardiol 94:93-97, 2004.
10. Balat A, Pakir HI, Gök F, Anarat R, Sahinoz S. Urotensin-II levels in children with minimal change nephrotic syndrome. Pediatr Nephrol 20:42-45, 2005.
11. Balat O, Aksoy F, Kutlar I, Ugur MG, Iyikosker H, Balat A, Anarat R. Increased plasma levels of Urotensin-II in preeclampsia-eclampsia: a new mediator in pathogenesis? Eur J Obstet Gynecol Reprod Biol 120(1):33-38, 2005.
12. Ong KL, Lam KSL, Cheumng BMY. Urotensin-II: Its function in health and its role in disease. Cardiovascular Drugs and Therapy 19:65-75, 2005.
13. Zhang AY, Chen YF, Zhang DX, Yi FX, Qi J, Andrade-Gordon P, De Garavilla L, Li PL, Zou AP. Urotensin-II is a nitric oxide-dependent vasodilator and natriuretic peptide in the rat kidney. Am J Physiol Renal Physiol 285(4):F792-F798, 2003.
14. Totsune K, Takahashi K, Arihara Z, Sone M, Ito S, Murakami O. Increased plasma urotensin II levels in patients with diabetes mellitus. Clin Sci 104(1):1-5, 2003.
15. Gendron G, Simard B, Gobeil F, Sirois P, D'Orleans-Juste P,Regoli D. Human urotensin-II enhances plasma extravasation in specific vascular districts in Wistar rats. Can J Physiol Pharmacol 82:16-21, 2004.
16. Shenouda A, Douglas SA, Ohlstein EH, Giaid A. Localization of urotensin-II immunoreactivity in normal human kidneys and renal carcinoma. J Histochem Cytochem 50:885-889, 2002.
17. Bern HA, Pearson D, Larson BA, Nishioka RS. Neurohormones from fish tails: the caudal neurosecretory system. I. "Urophysiology" and the caudal neurosecretory system in fishes. Recent Prog Horm Res 41:533-552, 1985.
18. Kelsall CJ, Balment RJ. Native urotensins influence cortisol secretion and plasma cortisol concentrations in the euryhaline flounder, Platichthys flesus. Gen Comp Endocrinol 112:210-219, 1998.
19. Sauzeau V, Le ME, Bertoglio J, Scalbert E, Pacaud P, Loirand G. Human urotensin-II induced contraction and arterial smooth muscle cell prolipheration are mediated by RhoA and Rho kinase. Circ Res 88:1102-1104, 2001.
20. Watanebe T, Pakala R, Katagiri T, Benedict CR. Synergistic effect of urotensin-II with mildly oxidized LDL on DNA synthesis in vascular smooth muscle cells. Circulation 104:16-18, 2001.
21. Matsushita M, Shichiri M, Fukai N, Ozawa N, Yoshimoto T, Takasu N, Hirata Y. Urotensin-II is an autocrine/paracrine growth factor for the porcine epithelial cell line, LLCPK1. Endocrinology 144 (5):1825-1831, 2003.
22. Loretz CA, Howard ME, Siegel AJ. Ion transport in goby intestine: cellular mechanism of urotensin-II stimulation. Am J Physiol 249:G 284-293, 1985.
23. Ames RS, Sarau HM, Chambers JK, Willette RN, Aiyar NV, Romanic AM, Louden CS, Foley JJ, Sauermelch CF, Coatney RW, Ao Z, Disa J, Holmes SD, Stadel JM, Martin JD, Liu WS, Glover GI, Wilson S, McNulty DE, Ellis CE, Elshourbagy NA, Shabon U, Trill JJ, Hay DW, Ohlstein EH, Bergsma DJ, Douglas SA. Human urotensin- II is a potent vasoconstrictor and agonist for the orphan receptor GPR 14. Nature 401:282-286, 1999.
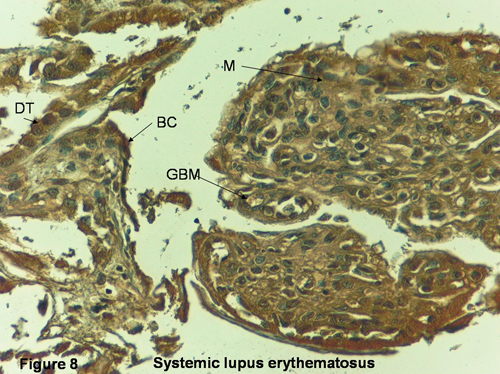
24. Eddy AA. Immune mechanisms of glomerular injury. In: Pediatric Nephrology. Barratt TM, Avner ED, Harmon WE (eds). 4th Ed. Lippincott Williams & Wilkins: Baltimore, pp. 641-668, 1999.
25. Rosen S. Crescentic glomerulonephritis. Occurrence, mechanisms and prognosis. Pathol Annu 10:37-61, 1975.
26. Cole BR, Salinas-Madrigal L. Acute proliferativeglomerulonephritis and crescentic glomerulonephritis. In: Pediatric Nephrology. Barratt TM, Avner ED, Harmon WE (eds). 4th Ed. Lippincott Williams& Wilkins: Baltimore, pp. 669-689, 1999.
27. Tzanidis A, Hannan RD, Thomas WG, Onan D, Autelitano DJ, See F, Kelly DJ, Gilbert RE, Krum H. Direct actions of urotensin II on the heart: implications for cardiac fibrosis and hypertrophy. Circ Res 93:246-253, 2003.
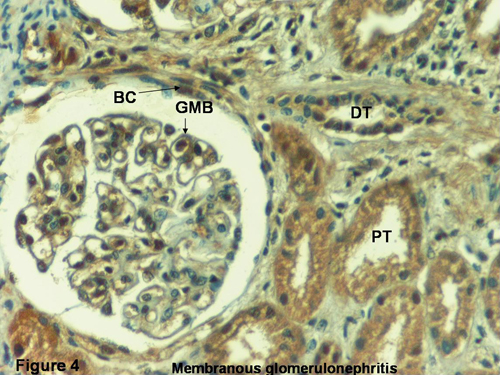
28. Makker SP. Membranous glomerulonephropathy. In: Pediatric Nephrology. Barratt TM, Avner ED, Harmon WE (eds). 4th Ed. Lippincott Williams & Wilkins: Baltimore, pp. 719-730, 1999.
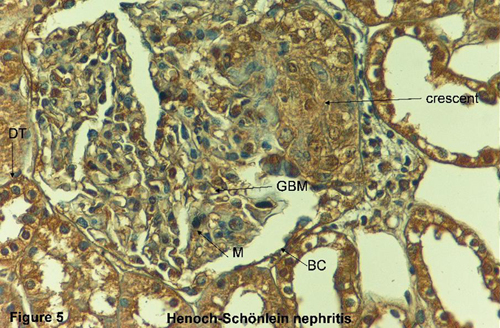
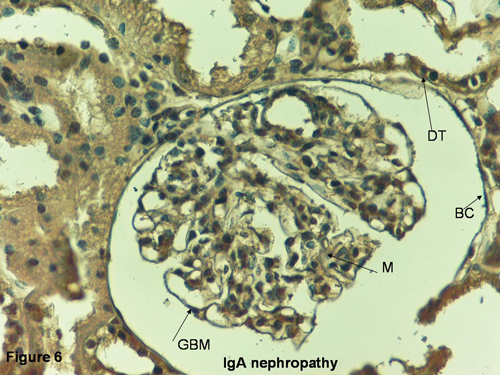
29. White RHR, Yoshikawa N, Feehally J. IgA nephropathy and Henoch-Schönlein nephritis. In: Pediatric Nephrology. Barratt TM, Avner ED, Harmon WE (eds). 4th Ed. Lippincott Williams & Wilkins: Baltimore, pp. 691-706, 1999.
30. Niaudet P. Steroid-resistant idiopathic nephrotic syndrome. In: Pediatric Nephrology. Barratt TM, Avner ED, Harmon WE (eds). 4th Ed. Lippincott Williams & Wilkins: Baltimore, pp. 749-763, 1999.
31. Clozel M, Hess P, Qiu C, Ding SS, Rey M. The urotensin-II receptor antagonist palosuran improves pancreatic and renal function in diabetic rats. J Pharmacol Exp Ther 316(3):1115-1121, 2006.





 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: Patrocinio y reconocimiento
Patrocinio y reconocimiento