Varsovia, Polonia
(especial para SIIC)
La expresión del receptor de interleuquina
4 en monocitos y macrófagos parece crucial en la regulación de la
producción de citoquinas proalérgicas y antialérgicas.
RESUMEN
En la patogenia de las enfermedades alérgicas están involucrados múltiples
elementos, entre los que se cuentan la influencia del medioambiente
y varios factores intrínsecos de los cuales las modificaciones en
la función del sistema inmunológico, escasamente comprendidas aún,
parecen los más importantes. Cada vez hay más evidencia a favor de
la participación crucial del desequilibrio de la red de citoquinas
regulatorias - descenso del interferón gamma (IFN-g)
y mayor producción de interleuquina (IL) 4- en la patogenia de los
trastornos alérgicos. Recientemente se informó que el descenso del
IFN-g podría ser consecuencia de la disminución
de otra citoquina importante, la IL-12, que ejerce un fuerte efecto
estimulante sobre la producción de IFN-g.
De hecho, se ha visto que los pacientes con patología alérgica producen
menos IL-12 que los individuos no alérgicos. En un trabajo nuestro
anterior observamos la mayor expresión de CD124, subunidad alfa específica
del receptor de IL-4, en los monocitos de las personas con alergia.
Más aún, encontramos que la mayor expresión de CD124 en monocitos
se correlaciona con menor producción de IL-12 por células de individuos
alérgicos después de la estimulación en presencia de IL-4. Nuestros
estudios posteriores revelaron que la inmunoterapia específica podría
indirectamente influir en la producción de IFN-g,
dependiente del CD124 de los monocitos. En el artículo actual analizamos
las posibles consecuencias de las observaciones.
Palabras clave: alergia, CD124, IFN-g,
IL-12, IL-4, monocitos.
ABSTRACT
The pathogenesis of allergic diseases involves numerous elements,
including influence of environment and several intrinsinc factors.
Among them, the most important seem to be still poorly understood
changes in the immunological system function. Currently, there is
an increasing evidence suggesting pivotal role of some inbalance
in immunoregulatory cytokines network. These changes include decrease
of interferon-g (IFN-g)
level and/or increase of interleukin-4 (IL-4) production. Recently,
it has been reported that decrease of IFN-g
could be due to decrease of another important cytokine – IL-12,
which is known as a strong stimulator of IFN-g
production. Indeed, it has been found that allergic patients produce
less IL-12 than healthy individuals. In our previous study we emphasized
increased expression of CD124 – the specific a subunit of IL-4 receptor
on monocytes of allergic patients. Moreover, we found that increased
monocyte CD124 expression correlates with lower IL-12 production
by allergic monocytes after stimulation in presence of IL-4. Our
further studies revealed that allergen-specific immunotherapy could
indirectly influence monocyte CD124-dependent production of IFN-g.
In this report we anounce presumable implications of those peculiarities.
Key words: allergy; CD124; IFN-g;
IL-4; IL-12; monocytes.
La patogenia de las reacciones de hipersensibilidad no se ha esclarecido
aún. Sin embargo, entre las numerosas hipótesis postuladas para
explicar el desarrollo de alergia, importante cantidad de estudios
indican que el desequilibrio entre las poblaciones de linfocitos
colaboradores (Th1, Th2) tendría un impacto crucial [1,2]. La actividad
de los linfocitos Th1 y Th2 se antagoniza recíprocamente mediante
un patrón de citoquinas particular producido por cada uno de ellos.
Sobre la base de la observación de
varios grupos de que la producción de IFN-g
es defectuosa en pacientes con alergia [3,4], la disminución de
la influencia inhibitoria del IFN-g
podría promover la actividad de los Th2.
Cada vez existe mayor información que sugiere una actividad dominante
de estos últimos o supresión de la actividad de los Th1 en pacientes
alérgicos [5]. El resultado final es la mayor producción de IL-4.
Sin embargo, el origen de dichas alteraciones aún se desconoce.
La IL-4 tiene múltiples funciones. Es producida principalmente
por los linfocitos Th activados, células cebadas, basófilos y eosinófilos
[6,7]. La molécula blanco de la IL-4 es el receptor unido a la membrana
celular [8]. El receptor de la IL-4 (IL-4R) está formado por dos
componentes. La subunidad alfa específica de 140 kDa (CD124) es
responsable de la unión de la IL-4 [9] mientras que el elemento
de transducción de señales es la cadena gamma común (CD132) de 65
kDa. Esta cadena es compartida por los receptores de la IL-2, IL-7,
IL-9 e IL-15 [10]. El IL-4R se expresa constitutivamente en muchos
tipos de células, como linfocitos T y B, células cebadas, células
endoteliales, fibroblastos y monocitos [11]. La función más importante
de la IL-4 es regular el cambio de clase de inmunoglobulinas e inducción
de la síntesis de IgE [12]. Además, aumenta la reacción inflamatoria
mediante la inducción de algunas moléculas de adhesión (por ejemplo,
VCAM-1 en células endoteliales) y por la activación de la 15-lipooxigenasa
[13]. La IL-4 también aumenta la expresión de los componentes del
receptor en las células blanco [14]. La estimulación de linfocitos
CD4+ nativos purificados, derivados de sangre del cordón, con IL-4
y anticuerpos monoclonales antiCD3 se asocia con la formación de
células Th2 [15]. En cambio, La IL-4 inhibe directamente la expresión
del IFN-g y suprime la diferenciación
de los linfocitos Th1, productores de este factor [16]. La importancia
de la IL-4 quedó demostrada en ensayos en fase II que revelaron
que el uso de IL-4R recombinante inhibe la actividad de la IL-4
[17].
Recientemente se encontró que las biopsias de mucosa nasal y bronquial
de individuos alérgicos tienen mayor expresión de IL-4R [18]. Sin
embargo, las células responsables en este efecto aún no se han identificado
con certeza. Los linfocitos T y B que infiltran la mucosa y, tal
como ha sido demostrado en forma reciente, las células dendríticas
CD1a positivas son posibles candidatos [19]. Los hallazgos nos estimularon
a verificar la hipótesis que considera al IL-4R como un elemento
esencial en la patogenia de la alergia.
Inicialmente analizamos in vitro la
síntesis de IL-4, IL-12 e IFN-g
por parte de células mononucleares de sangre periférica [PBMC] de
sujetos alérgicos con sensibilización única a polen de gramíneas.
El estudio abarcó pacientes con pruebas cutáneas positivas, nivel
sérico de IgE total por encima de las 400 IU/ml y síntomas moderados
de alergia estacional. Los pacientes fueron evaluados en un período
fuera de la época de polinización, al menos dos meses antes de la
exposición natural esperada a los alergenos polínicos ambientales.
Los enfermos no estaban tratados con esteroides ni con antiinflamatorios
no esteroideos desde, por lo menos, un mes antes y durante el estudio.
El grupo control estuvo integrado por voluntarios sanos sin historia
de enfermedad alérgica y con una concentración plasmática de IgE
total por debajo de las 50 IU/ml.
La estimulación de los PBMC con fitohemaglutinina
(PHA) durante 24 horas se asoció con marcado aumento de la concentración
de IL-4 e IFN-g
en los sobrenadantes de cultivo, en comparación con las células
no estimuladas. El efecto de la PHA sobre la producción de IL-4
no difirió entre personas sanas y enfermos con alergia. Sin embargo,
como era de esperar, el nivel de IFN-g
sintetizado por los PBMC estimulados de pacientes alérgicos fue
significativamente inferior, en comparación con las células de sujetos
control. Sorprendentemente, a diferencia de la IL-4 e IFN-g
, la estimulación de los PBMC con PHA
se asoció con reducción significativa de la concentración de IL- 12
en los sobrenadantes de cultivo. No obstante, el nivel promedio de
la IL-12 no difirió significativamente entre los cultivos de pacientes
y controles.
Con la finalidad de explicar los mecanismos involucrados en las
observaciones mencionadas, realizamos otros experimentos con anticuerpos
neutralizantes de la acción de citoquinas, antiIL-4 y antiIFN-g.
Ambos suprimieron la proliferación de los PBMC, tal como lo reveló
la captación de timidina marcada (con H3) y los ensayos de proliferación.
Más aún, el agregado de antiIL-4, aunque no de antiIFN-g,
se asoció con la recuperación de la producción de IL-12 por PBMC
de individuos alérgicos, estimulados con PHA. Los resultados sugirieron
que el descenso en la producción de IL-12 por los PBMC después de
la estimulación con PHA podría depender de la presencia de IL-4
en los sobrenadantes.
Se sabe que los monocitos y macrófagos
son los principales productores de IL-12 [20] por lo que también
es posible que sean un blanco importante en la regulación de la
IL-4 y en el desarrollo de alergia. Ciertamente, se ha visto que
la IL-4 suprime la liberación de IL-12 por parte de los monocitos
[21]. Se considera que la IL-12 que deriva de los monocitos es un
potente estimulante de la producción de IFN-g
[22]. Por lo tanto, es posible que la
inhibición que ejerce la IL-4 sobre la producción de IL-12 se asocie
finalmente con menor expresión de IFN-g.
Esta teoría estaría avalada, en parte, por la demostración de varios
grupos de que el menor nivel sérico de IFN-g,
en pacientes alérgicos, se correlaciona con una menor producción de
IL-12 [23].
Recientemente, van der Pouw Kraan y colaboradores demostraron
que los monocitos de individuos alérgicos producían menor cantidad
de IL-12 [24]. Por lo tanto, realizamos nuevos experimentos utilizando
la fracción adherente de los PBMC, que consiste en un 80% a un 90%,
aproximadamente, de monocitos. Finalmente, pudimos observar que
la estimulación de esta fracción de células con PHA se asociaba
con incremento significativo en la expresión de IL-12. Sin embargo,
la capacidad de los monocitos de producir IL-12 después de la estimulación
con PHA fue comparable en pacientes y controles. No obstante, el
agregado de IL-4 humana recombinante a los monocitos tratados con
PHA inhibió más eficazmente la producción de IL-12 por parte de
células de enfermos con alergia en comparación con controles. La
distinta expresión de IL-4R en monocitos de sujetos con y sin alergia
podría explicar esta distinta sensibilidad a la IL-4. Así, comparamos
la expresión de la subunidad alfa del IL-4R, CD124, en PBMC recientemente
aislados de sujetos con alergia y controles, mediante citometría
de flujo. En el ensayo también empleamos anticuerpos antiCD14, un
marcador específico de la población de monocitos.
La citometría de flujo no reveló diferencias en el porcentaje
de células CD124 positivas en alérgicos y controles. Al considerar
aquellas células con expresión débil del marcador, aproximadamente
la mitad de las células CD124 positivas también expresó la molécula
de superficie CD14. En cambio, la mayoría de las células CD14 positivas
expresaron intensamente CD124. En base a las propiedades morfológicas
se vio que la población CD14+CD124+ tenía características de monocitos
mientras que las células CD14-CD124+ y las CD14-CD124- fueron identificadas
como linfocitos. No hubo diferencias significativas en el porcentaje
de PBMC doblemente positivos (CD14+CD124+) entre pacientes con alergia
o controles. Sin embargo, la intensidad de la fluorescencia, correspondiente
a la expresión de CD124 en cada célula, fue significativamente más
alta en los monocitos de los pacientes alérgicos. No hubo diferencias
significativas en la expresión de CD124 sobre los PBMC CD14- entre
enfermos y controles.
La sobreexpresión de CD124, componente
específico del IL-4R, en monocitos de pacientes con alergia podría
ser responsable de su mayor sensibilidad a la inhibición de la producción
de IL-12, mediada por IL-4, aún en concentración comparable a la
de sujetos normales [figura 1]. El fenómeno podría asociarse con
una menor estimulación en la expresión de IFN-g
por linfocitos de individuos con alergia
y, por lo tanto, inducción de la formación de la subpoblación Th2.
Aunque la hipótesis parece muy atractiva, se requiere mayor investigación
aún.
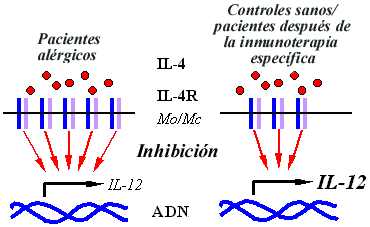
Figura 1. Papel potencial del receptor de la interleuquina
4 (IL-4R) en la inhibición de la expresión de IL-12. En pacientes
alérgicos, en presencia de mayor cantidad de complejos de IL-4R
en la superficie de los monocitos, una misma cantidad de IL-4 se
asocia con mayor supresión de la producción de IL-12 en comparación
con lo que ocurre en personas sanas. Fue interesante constatar que
en el transcurso de la inmunoterapia específica se registra menor
expresión de IL-4R en la superficie de los monocitos.
La inmunoterapia específica con alergenos (AIT) podría ser un modelo
interesante para comprobar las observaciones comentadas. Se ha visto
que la AIT es un tratamiento eficaz para la alergia polínica o alergia
al veneno de Hymenopthera [25,26]. El tratamiento reduce
la mayoría de las manifestaciones clínicas, probablemente al modificar
la producción de citoquinas regulatorias [27]. De hecho, varios
grupos encontraron descenso de IL-4 y aumento en el nivel de IFN-g
en asociación con la AIT [25,27]. Al menos, la AIT podría restaurar
parcialmente el equilibrio entre Th1 y Th2 [28] mediante el incremento
en la producción de IL-12 por los monocitos de los pacientes con
alergia.
Por este motivo, analizamos los cambios
en la producción de IL-4, IFN-g
e IL-12 y en la expresión de la molécula
CD124 en PBMC de individuos alérgicos en tratamiento con AIT. El estudio
incluyó a un pequeño número de pacientes (n = 16) sensibilizados exclusivamente
al polen de gramíneas, seleccionados en base a los siguentes criterios
clínicos: rinitis alérgica estacional importante, conjuntivitis o
asma y escaso control de los síntomas en años anteriores a pesar del
uso regular de drogas antialérgicas. Los enfermos debían tener un
nivel de IgE en suero por encima de las 400 IU/ml, IgE específica
para el polen involucrado, confirmado por el ensayo AllergodipTM y
pruebas cutáneas positivas. La AIT se realizó con una preparación
alergoide de polen de gramíneas (AllergovitTM) según un protocolo
estándar. Durante las primeras cinco a seis semanas se aplicaron inyecciones
semanales con concentraciones crecientes de AllergovitTM. En cada
paciente, la AIT se realizó al menos un mes antes de la época esperada
de polinización. En ese tiempo y durante el estudio, los pacientes
no recibieron corticoides sistémicos o antiinflamatorios no esteroides.
Sólo se permitió el uso de drogas sintomáticas, como antihistamínicos
orales y locales, beta agonistas en aerosol y bajas dosis de esteroides
tópicos. La estimación de la eficacia de la AIT durante el primer
año se efectuó en la estación de la exposición natural, mediante el
registro sintomático en planillas diarias. Los parámetros valorados
incluyeron rinitis (rinorrea, estornudos y obstrucción nasal), conjuntivitis
(secreción conjuntival, congestión o prurito) y asma (sibilancias
y dificultad para respirar). La gravedad de los síntomas y la medicación
empleada se cuantificaron y se calculó un puntaje promedio para cada
individuo. El puntaje máximo fue de 10 (síntomas extremos y necesidad
de usar frecuentemente medicación sintomática) y el mínimo de 0, sin
manifestaciones clínicas y uso esporádico de drogas antialérgicas.
La evaluación clínica se realizó durante la época de polinización
natural y se comparó con el período previo a la AIT. El cálculo del
puntaje de síntomas y de medicación reveló mejoría moderada o escasa
después del primer año de estudio.
La concentración promedio de IL-4 en el sobrenadante de cultivos
de PBMC no estimulados, antes y después de la AIT, fue comparable.
La estimulación de los PBMC con PHA se asoció con un aumento marcado
en el nivel de IL-4 en los sobrenadantes.
Sin embargo, la AIT no afectó en forma
visible el efecto de la estimulación con PHA sobre la producción
de IL-4. Tampoco se comprobó efecto de la AIT sobre la producción
espontánea de IFN-g
pero, al contrario de lo que ocurrió con la síntesis de IL-4, la
AIT se asoció con aumento significativo de la concentración de IFN-g
en los sobrenadantes de cultivos de PBMC
estimulados con PHA.
La concentración promedio de IL-12 en los sobrenadantes de la
fracción adherente de los PBMC no estimulados no fue distinta antes
y después de la AIT. Si bien en el transcurso de la AIT registramos
un incremento en el nivel promedio de IL-12 en sobrenadantes de
cultivos de monocitos de pacientes estimulados con PHA, la diferencia
no fue estadísticamente significativa. Una observación sorprendente
fue el aumento marcado en la concentración de IL-12 en los sobrenadantes
de cultivos de monocitos estimulados con PHA, en presencia de IL-4,
después de la AIT. Más aún, la influencia inhibitoria mínima de
la IL-4 sobre la producción de IL-12 por la fracción de monocitos
adherentes fue significativamente más baja luego de la AIT en comparación
con los registros anteriores al tratamiento. Debido a que la producción
de IL-4 por los PBMC no se vio afectada por la AIT, es posible que
la menor sensibilidad de los monocitos a la IL-4 dependa de la menor
expresión del IL-4R o de su componente específico, CD124.
Por ende, mediante citometría de flujo analizamos PBMC frescos
y encontramos que la AIT no influía visiblemente en el número total
o el porcentaje de células CD124 positivas. Más aún, no hubo modificaciones
significativas en la cantidad y proporción de las subpoblaciones
CD14-CD124+ o CD14+CD124+. El análisis de la población CD14+CD124+
reveló un descenso significativo en la expresión de la subunidad
alfa - CD124- después de la inmunoterapia. En cambio, la expresión
de CD124 en la población CD14-CD124+ (identificada como linfocitos),
no se modificó significativamente en el curso de la AIT.
Nuestro resultados confirman y extienden
observaciones anteriores que sugerían la importancia del IL-4R en
la patogenia de la alergia [18,29]. Además explicarían, al menos
en parte, la mayor producción de IL-12, seguida de un aumento en
la liberación de IFN-g
(figura 2). Por lo tanto, las modificaciones
en la expresión del CD124 en los monocitos podría ser responsable
de la restauración del equilibrio normal de la red de citoquinas.
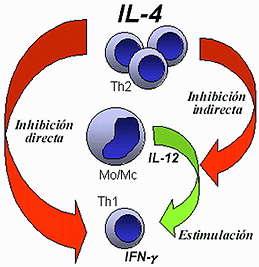
Figura 2. Regulación de la
expresión del interferón gamma (IFN-g)
por la interleuquina 4 (IL-4). El linfocito colaborador (Th) 1 es
la célula blanco en la acción inhibitoria directa de la IL-4. La
inhibición indirecta de la IL-4 sobre el IFN-g
ocurre a través de la supresión de la
liberación de IL-12, potente estimulante de la producción de IFN-g,
por parte de monocitos.
La estimación clínica de la eficacia de la AIT reveló una mejoría
relativamente débil en el grupo analizado. Sin embargo, nuestros
resultados coinciden con observaciones de otros grupos que no encontraron
efecto alguno o sólo observaron un efecto mínimo después del primer
año de estudio [30], seguido de una reducción significativa de los
síntomas clínicos de alergia después del segundo o tercer año de
tratamiento [31].
Más aún, nuestros hallazgos sugieren que la normalización de algunos
parámetros inmunológicos -como el incremento en la producción de
IFN-g- podría preceder y, habitualmente
se correlaciona con la mejoría clínica obtenida con la AIT [32].
Por lo tanto, en el trabajo actual, a pesar de no registrarse una
mejoría sintomática satisfactoria después del primer año de inmunterapia,
creemos que las modificaciones inmunológicas inducidas por el tratamiento
podrían, al menos, anunciar la respuesta clínica esperada. El monitoreo
de la expresión del CD124 en monocitos de pacientes con alergia
parece interesante ya que podría representar un marcador inmune
precoz para anticipar la mejoría clínica. Sin embargo, el motivo
por el cual la AIT induce cambios en la expresión del CD124 en monocitos
de pacientes con alergia requiere mayor investigación aún.
AGRADECIMIENTOS
El estudio fue apoyado por el Comité de Investigación Nacional,
subsidio Nº 6 P05E 159 21. Allergodip TM y AllergovitTM son preparados
comerciales de Allergopharma, Rainbek, Alemania.
BILIOGRAFIA
- Robinson DS, Hamid Q, Ying S, Tsicopoulos A, Barkans J, Bentley
AM, Corrigan C, Durham SR, Kay AB (1992) Predominant TH2-like
bronchoalveolar T-lymphocyte population in atopic asthma. N. Engl.
J. Med. 326: 298-304
- van der Heijden FL, Wierenga EA, Bos JD, Kapsenberg ML (1991)
High frequency of IL-4-producing CD4+ allergen-specific T lymphocytes
in atopic dermatitis lesional skin. J. Invest. Dermatol. 97: 389-394
- Tang M, Kemp A. (1994) Production and secretion of interferon-gamma
(IFN-g) in children with atopic dermatitis.
Clin. Exp. Immunol. 95: 66-72
- Esnault S, Benbernou N, Lavaud F, Shin HC, Potron G, Guenounou
M (1996) Differential spontaneous expression of mRNA for IL-4,
IL-10, IL-13, IL-2 and interferon-gamma (IFN-gamma) in peripheral
blood mononuclear cells (PBMC) from atopic patients. Clin. Exp.
Immunol. 103: 111-118
- Seder RA, Paul WE, Davis MM, Fazekas de St Groth B (1992) The
presence of interleukin 4 during in vitro priming determines the
lymphokine-producing potential of CD4+ T cells from T cell receptor
transgenic mice. J. Exp. Med. 176: 1091-1098
- Chen H, Paul WE (1997) Cultured NK1.1+ CD4+ T cells produce
large amounts of IL-4 and IFN-gamma upon activation by anti-CD3
or CD1. J. Immunol. 159: 2240- 2249
- Dubucquoi S, Desreumaux P, Janin A, Klein O, Goldman M, Tavernier
J, Capron A, Capron M (1994) Interleukin 5 synthesis by eosinophils:
association with granules and immunoglobulin-dependent secretion.
J. Exp. Med. 179: 703-708
- Nelms K, Keegan AD, Zamorano J (1999) The IL-4 receptor: signalling
mechanisms and biologic function. Ann. Rev. Immunol. 17: 701-738
- Gessner A, Rollinghoff M (2000) Biologic functions and signalling
of the interleukin- 4 receptor complexes. Immunobiology 201: 285-307
- Callard RE, Matthews DJ, Hibbert L (1996) IL-4 and IL-13 receptors:
are they one and the same? Immunol. Today 17: 108-110
- Ohara J, Paul WE (1987) Receptors for B-cell stimulatory factor-1
expressed on cells of haematopoietic lineage. Nature 325: 537-540
- Del Prete G, Maggi E, Parronchi
P, Chretien I, Tiri A, Macchia D, Ricci M, Banchereau J, de Vries
J, Romagnani S (1988) IL-4 is an essential cofactor for the IgE
synthesis induced in vitro by human T cell clones and their supernatants.
J.
Immunol. 140: 4193-4198
- Schleimer RP, Sterbinsky SA, Kaiser J, Bickel CA, Klunk DA,
Tomioka K, Newman W, Lucinskas FW, Gimbrone MA Jr, McIntyre BW
(1992) IL-4 induces adherence of human eosinophils and basophils
but not neutrophils to endothelium. Association with expression
of VCAM-1. J. Immunol. 148: 1086-1092
- Ohara J, Paul WE (1988): Up-regulation of interleukin 4/B-cell
stimulatory factor 1 receptor expression. Proc. Natl. Acad. Sci.
USA 85: 8221-8225
- Sornasse T, Larenas PV, Davis KA, de Vries JE, Yssel H (1996)
Differentiation and stability of T helper 1 and 2 cells derived
from naive human neonatal CD4+ T cells, analyzed at the single-cell
level. J. Exp. Med. 184: 473-483
- Seder RA, Paul WE, Davis MM, Fazekas de St Groth B (1994) The
presence of interleukin 4 during in vitro priming determines the
lymphokine-producing potential of CD4+ T cells from T cell receptor
transgenic mice. J. Exp. Med. 176: 1091-1098
- Borish LC, Nelson HS, Lanz MJ, Claussen L, Whitmore JB, Agosti
JM, Garrison L (2000): Interleukin-4 receptor in moderate atopic
asthma. A phase I/II randomized, placebo-controlled trial. Am
J Resp Critical Care Medicine 160: 1816-1823
- Kotsimbos TC, Ghaffar O, Minshall
EM, Humbert M, Durham S, Pfister R, Menz G, Kay B, Hamid Q (1998):
Expression of the IL-4 receptor alpha-subunit is increased in
bronchial biopsy specimens from atopic and nonatopic asthmatic
subjects. J.
Allergy Clin. Immunol. 102: 859-866
- Bertorelli G, Bocchino V, Zhou X, Zanini A, Bernini MV, Damia
R, Di Comite V, Grima P, Olivieri D (2000): Dendritic cell number
is related to IL-4 expression in the airways of atopic asthmatic
subject. Allergy 55: 449-454
- Kobayashi M, Fitz L, Ryan M, Hewick RM, Clark SC, Chan S, Loudon
R, Sherman F, Perussia B, Trinchieri G (1989): Identification
and purification of natural killer cell stimulatory factor (NKSF),
a cytokine with multiple biologic effects on human lymphocytes.
J. Exp. Med. 170: 827-845
- Bonder CS, Finlay-Jones JJ, Hart PH (1999): Interleukin-4 regulation
of human monocyte and macrophage interleukin-10 and interleukin-12
production. Role of a functional interleukin-2 receptor gamma-chain.
Immunology 96: 529-536
- Manetti R, Gerosa F, Giudizi MG,
Biagotti R, Parronchi P, Piccinni M, Sampognaro S, Maggi E, Romagnani
S, Trinchieri G (1994): Interleukin 12 induces stable priming
for interferon ? (IFN-g) production
during differentiation of human T helper (Th) cells and transient
IFN-g
production in established Th2 cell clones. J. Exp. Med.
179: 1273-1283
- Hamid QA, Schotman E, Jacobson MR,
Walker SM, Durham SR (1997): Increases in IL-12 messenger RNA+
cells accompany inhibition of allergen-induced late skin responses
after successful grass pollen immunotherapy. J. Allergy Clin.
Immunol.
99: 254-260
- van der Pouw Kraan T, Boeije L, de Groot E, Stapel S, Snijders
A, Kapsenberg ML, van der Zee J, Aarden L (1997): Reduced production
of IL-12 and IL-12-dependent IFN-g
release in patients with allergic asthma. J. Immunol. 158: 5560-5565
- Pastorello EA, Pravettoni V, Incorvaia C, Mambretti M, Franck
E, Wahl R, Zanussi C (1992): Clinical and immunological effects
of immunotherapy with alum-absorbed grass allergoid in grass-pollen-induced
hay fever. Allergy 47: 281-290
- Jutel M, Pichler WJ, Skrbic D, Urwyler A, Dahinden C, Muller
UR (1995): Bee venom immunotherapy results in decrease of IL-4
and IL-5 and increase of IFN-g secretion
in specific allergen-stimulated T cell cultures. J. Immunol. 154:
4187-4194
- Secrist H, Chelen CJ, Wen Y, Marshall JD, Umetsu DT (1993):
Allergen immunotherapy decreases interleukin 4 production in CD
4+ T cells from allergic individuals. J. Exp. Med. 178: 2123-2130
- Bellinghausen I, Metz G, Enk AH, Christmann S, Konp J, Saloga
J (1997): Insect venom immunotherapy induces interleukin-10 production
and a Th2-to-Th1 shift, and changes surface marker expression
in venom-allergic subjects. Eur. J. Immunol. 27: 1131-1139
- de Vries JE, Carballido JM, Aversa G (1999): Receptors and cytokines
involved in allergic Th2 cell responses. J. Allergy Clin. Immunol.
103: S492-496
- Hirsch T, Sahn M, Leupold W (1997):
Double-blind placebo-controlled study of sublingual immunotherapy
with house dust mite extract (D.pt.) in children. Pediatr.
Allergy Immunol. 8: 21-27
- Osterballe O (1982): Immunotherapy with grass pollen major allergens:
clinical results from a prospective 3-year double-blind study.
Allergy 37: 379-388
- Grzela K, Grzela T, Chmielewska-Szewczyk
D, Zawadzka-Krajewska A, Malejczyk J (1999): Effect of allergen
immunotherapy on interleukin-4 and interferon-g
production by peripheral blood mononuclear cells of grass pollen-sensitive
atopic children. Centr. Eur. J. Immunol. 24: 239-247
|


![]()