Palabras clave: material dentario, hipersensibilidad, urticaria,
raíz dental
ABSTRACT
Background: we present a patient who experienced generalized
urticaria and angioedema twice, following application of tooth root
devitalizing material containing lidocaine, paraformaldehyde and
excipient fibers (phenol, titaniumdioxide, polyethylene fibres,
vinyl acetate chloride copolymer). On both occasions she took an
analgesic (nimesulide and metamizole) after the dental intervention.
Methods and results: attempting to examine the
hypersensitivity we performed parenteral (lidocaine hydrochloride
2%) and oral (nimesulide, metamizole, K-metabisulfite, Na-bensoate,
bensoic acid) dose-provocation testing that was negative. Prick
tests with latex, formaldehyde, paraformaldehyde, phenol,
titaniumdioxide and polyvinyl chloride acetate copolymer were
negative, as well as patch tests with the same substances (but not
performed with latex) and with the European standard series od
contact allergens. Patch test with the original tooth root
devitalizing material was found positive after 24 h. The level of
anti-latex IgE, total IgE and C4 in the serum, as well as CH50 and
C1- inhibitor activity were normal. C3 serum concentration was found
elevated. Conlusion: results suggest hypersensitivity to the
original substance, but not to it’s components. The explanation
could be acting of one of the components as a hapten and the other
one as a carrier. We advised the patient to undergo vital instead of
mortal nerve extirpation in case of another necessity of tooth root
devitalization
Key words: dental material, hypersensitivity, urticaria, tooth
root.
INTRODUCCION
Las reacciones alérgicas en odontología pueden ser inducidas por múltiples
sustancias: anestésicos locales y los preservadores contenidos en
ellos,1 goma látex natural2 y su isómero
gutapercha,3 materiales de llenado dental (incluyendo la
raíz)4-12, soluciones desinfectantes,13
metales usados en la restauración del diente,14 resinas
dentales14 y sus colorantes,15 agentes de unión
ortodóncica,16 tejido de fibrina utilizado como esponja
hemostática en la extracción del diente17 y selladores
de fisuras.18
COMUNICACION DE UN CASO
Se aplicó material desvitalizador de raíz dental (Caustinerf
fort, producido por Septodont, Francia) en una mujer de 52 años
sin antecedente de enfermedades atópicas. El material contiene
paraformaldehído, lidocaína y fibras excipientes (fenol, óxido de
titanio, fibras de polietileno y copolímero de cloruro y acetato de
vinilo). Luego de aproximadamente 9 horas y media, la mujer
experimentó prurito y desarrolló varias ronchas pequeñas en el
dorso del muslo. Una hora después presentó una erupción cutánea
en la parte posterior del cuello. A la mañana siguiente (23 horas
después de la intervención dentaria) presentó edema de labios y párpados,
y prurito y urticaria generalizados. Una hora más tarde se le
administró metilprednisolona, 20 mg por vía intravenosa, y
astemizol, por vía oral, con lo cual las manifestaciones clínicas
comenzaron a atenuarse para desaparecer por completo en las
siguientes 48 horas, con el uso concomitante de astemizol. Al cuarto
día el material desvitalizante fue removido. Dieciocho días después
se aplicó nuevamente Caustinerf fort en otra raíz dental.
Luego de transcurridas unas 10 horas, la paciente comenzó con
dificultad para tragar. En la hora siguiente desarrolló prurito de
cuello y edema auricular y de párpados. Las manifestaciones
evolucionaron a urticaria generalizada. La paciente fue tratada con
maleato de dimetindeno, en dosis de 4 mg por vía intravenosa, y
metilprednisolona, en dosis de 40 mg por vía intravenosa y 40 mg
por vía intramuscular, con lo cual el angioedema y la urticaria
comenzaron a desaparecer gradualmente, con remisión absoluta en los
siguientes 5 días, período durante el cual la paciente continuó
el tratamiento con clorpiramina por vía intramuscular y
metilprednisolona por vía intramuscular más terfenadina y
ranitidina por vía oral. El Caustinerf fort se extrajo al
cuarto día de su aplicación. En ambas ocasiones, horas después de
la intervención dentaria, la paciente había ingerido un analgésico,
nimesulida más metamizol.
MATERIALES Y METODOS
La enferma fue sometida a prueba de provocación oral (con
nimesulida, metamizol, metabisulfito de potasio, benzoato de sodio,
ácido benzoico) y parenteral con clorhidrato de lidocaína al 2%.
Se efectuó prick test con látex. Se realizaron pruebas cutáneas
(prick test y del parche) con soluciones acuosas al 1% de
formaldehído, paraformaldehído y fenol, óxido de titanio (solución
acuosa al 7%) y copolímero de cloruro y acetato de polivinilo (al
7% en solución acuosa). También se efectuó prueba del parche con
paraformaldehído en la misma concentración que la presente en el Caustinerf
fort (46%), con la serie estándar de alergenos de contacto, Caustinerf
fort y Toxavit (que contiene paraformaldehído,
clorhidrato de lidocaína, cresol, eugenol, glicerol).
Las sustancias utilizadas en la prueba del parche se colocaron en
el área interescapular mediante cintas adhesivas estandarizadas
(Beiersdorf AG, Hamburgo, Alemania) y la lectura se realizó a los
30 minutos (parche abierto) y a las 24 y 72 horas.
En su valoración se empleó el Sistema de Clasificación del
Grupo Internacional de Dermatitis de Contacto. La presencia de IgE
antilátex y de IgE total se determinó con el sistema Unicap
(Pharmacia, Uppsala, Suecia) y la concentración de C3, C4 y de C1
inhibidor, por inmunodifusión radial (Behringwerke, Alemania). Se
utilizó nefelometría con láser en la determinación de la
actividad CH50 (Blood Transfusion Institute, Belgrado, Yugoslavia).
RESULTADOS
Todas las pruebas de provocación fueron negativas. El prick test
y las pruebas del parche con formaldehído, paraformaldehído,
fenol, óxido de titanio, copolímero de cloruro y acetato de
polivinilo, y Toxavit fueron negativos, así como también el prick
test con látex. La prueba del parche con Caustinerf fort
fue positiva (3+) luego de 24 horas (figura 1). No se detectó IgE
antilátex en suero. El nivel total de IgE (62.2 kU/l), C4 (0.378
g/l), CH50 (8.76 HU/ml) y la actividad de C1 Inhibidor (93.82%)
estuvieron dentro de los parámetros normales. La concentración de
C3 (2.01 g/l) estuvo ligeramente aumentada.
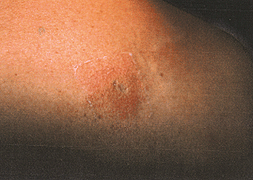
Figura 1. Reacción cutánea luego de 24
horas de realizada la prueba del parche con Caustinerf fort.
DISCUSION
En función de los resultados de las pruebas cutáneas, nuestra
paciente muestra alergia al material desvitalizador original, Caustinerf
fort. No se encontró hipersensibilidad a ninguno de sus
componentes. Existen escasos antecedentes de reacciones alérgicas
luego del llenado de la raíz dental con material que contiene
formaldehído o paraformaldehído, fundamentalmente con pruebas cutáneas
negativas a sus componentes e IgE positiva antiformaldehído en
todos los pacientes en quienes se realizó la determinación.5-12
Ebner y Kraft5 describieron tres enfermos con urticaria
generalizada y angioedema que surgieron luego del tratamiento
dentario con material con paraformaldehído (pasta Trio y Toxavit,
respectivamente). La prueba del parche y la prueba por fricción con
formaldehído y otros componentes de los materiales usados fueron
negativas así como también el prick test con formaldehído.
En el suero de los 3 pacientes se encontró IgE específica
antiformaldehído-albúmina sérica humana. Asimismo, Wantke y cols6
describieron urticaria generalizada luego del tratamiento dentario
con Toxavit. Su paciente tenía prick test y prueba del
parche negativas con formaldehído, pruebas del parche negativas con
la serie estandarizada de alergenos de contacto y con los
componentes del Toxavit. La IgE antilátex fue negativa. En el suero
del enfermo se detectó IgE antiformaldehído.
Forman y cols7 describieron, en una paciente con
antecedente de respuesta alérgica previa al formaldehído tópico,
erupción cutánea pruriginosa generalizada y angioedema luego del
llenado del canal de la raíz dental con pasta Endomethasone, que
contiene paraformaldehído.
Un enfermo de la serie referida por Fehr y cols8
presentó urticaria generalizada y edema de Quincke luego del
tratamiento radicular con pasta antiséptica Trio, que contiene
paraformaldehído. En el paciente, las pruebas cutáneas con
formaldehído y paraformaldehído fueron negativas mientras que la
prueba de raspado (scratch test) con pasta Trio fue positiva.
En el suero se detectó IgE antiformaldehído. Otros pacientes en la
misma serie experimentaron urticaria y/o edema de Quincke luego del
tratamiento de la raíz dental con Asphalin A, que contiene
paraformaldehído. La respuesta cutánea tardía (luego de 48 horas)
fue positiva con paraformaldehído al 2% o al 10% (concentraciones más
altas que la estándar del 1% recomendada para la prueba cutánea).
El Sayed y cols9 demostraron hipersensibilidad al
formaldehído con el scratch test pero no por la prueba del
parche. El enfermo desarrolló urticaria del maxilar inferior luego
de la aplicación de material de llenado del canal dentario (pasta
Spad que contiene formaldehído). Las pruebas del parche con todos
sus componentes permanecieron sin reacción, pero las scratch
test con uno de los constituyentes con formaldehído y las
realizadas con formaldehído al 1% fueron positivas.
La pasta Spad también fue aplicada en un paciente de la serie de
Haikel y cols10 que desarrolló posteriormente shock
anafiláctico. La prueba del parche con la sustancia completa fue
positiva, el prick test con dos fases líquidas (una de ellas
con formaldehído) fue negativo y se detectó IgE antiformaldehído.
Modre y Kranke11 describieron un paciente que
experimentó urticaria y síntomas cardiovasculares luego del
segundo tratamiento con Toxavit. El enfermo tuvo prick test negativo
con la solución acuosa de formaldehído al 1%, prueba del parche
positiva con formaldehído en solución acuosa al 1% y se detectó
IgE antiformaldehído.
Tas y cols12 encontraron prick test positivo,
prueba del parche positiva e IgE antiformaldehído en un paciente
que desarrolló urticaria aguda después de tratamientos con dos
compuestos distintos de llenado del canal de la raíz dentaria.
Las observaciones de estos autores indican que las pruebas cutáneas
y las pruebas del parche con los componentes de los materiales de
llenado del canal dental que contienen formaldehído (inclusive
formaldehído en concentración estándar) no puede identificar la
causa de la hipersensibilidad, mientras que la detección de IgE
antiformaldehído puede apuntar a ella.
Se ha descripto que la simple sensibilización al formaldehído
(en términos de presencia de IgE específica) no es suficiente para
desencadenar una reacción alérgica. Wantke y cols19
observaron la aparición de IgE antiformaldehído-albúmina en
estudiantes de medicina en el curso de disección, aunque sin
presentar síntomas de hipersensibilidad. Se refiere a la forma volátil
del formaldehído. Luego de que algunos de ellos fueron sometidos al
llenado del canal dentario con material con formaldehído,
desarrollaron reacciones adversas y se detectó IgG antiformaldehído-albúmina.
También existe un registro de una reacción de hipersensibilidad
al formaldehído no mediada por IgE20 supuestamente de
tipo retardado. Una enferma experimentó en forma repetida cefalea,
faringitis, disfonía y dolor tipo colitis varias horas después de
la ingesta de cápsulas con formaldehído. Asimismo, la paciente
presentó dificultad respiratoria al exponerse al formaldehído en
el trabajo. El RAST al formol fue negativo mientras que la prueba
del parche al formaldehído fue positiva.
En nuestro estudio realizamos prueba del parche con paraformaldehído
en la concentración que aparece en Caustinerf fort, 46%
(luego de la prueba con concentración al 1%), y no se observó
reacción alguna. Wantke y cols6 también encontraron
prueba del parche negativa con paraformaldehído al 46% a pesar de
hallar hipersensibilidad al formaldehído tal como lo indicaba la
presencia de IgE antiformaldehído en suero. En relación con la
hipersensibilidad al formaldehído (liberado a partir del
paraformaldehído), realizamos posteriormente prueba del parche con
otro material desvitalizador que contiene paraformaldehído en la
misma concentración (Toxavit). La prueba fue negativa y no avaló
hipersensibilidad al formaldehído.
La posible explicación de la reacción alérgica desarrollada
por nuestro paciente podría ser la sensibilización a uno de los
componentes del Caustinerf fort actuando como hapteno (por
ejemplo, formaldehído) mientras que el otro actúa como
transportador. En el caso de otros materiales desvitalizadores con
contenido similar (distinto del Toxavit) podría ocurrir el mismo
fenómeno. También existe la posibilidad de algún antígeno en el
compuesto de Caustinerf fort no revelado por el productor.
Tampoco puede excluirse hipersensibilidad a componentes metabólicamente
alterados.
Aconsejamos a la enferma a que, en caso de requerir otra
desvitalización de la raíz dentaria, se someta a extirpación
neural vital.
BIBLIOGRAFIA
- Seng GF, Kraus K, Cartwright G, et al. Confirmed allergic
reactions to amide local anesthetics. Gen Dent 1996;44:52-4.
- Knowles KI, Ibarrola JL, Ludlow MO, et al. Rubber latex
allergy and the endodontic patient. J Endod 1998;24:760-762.
- Gazelius B, Olgart L, Wrangsjo K. Unexpected symptoms to root
filling with gutta-percha. A case report. Int Endod J
1986;19:202-204.
- Tabakov N, Popova E. [A case of allergic reaction during
devitalization of dental pulp with Caustinerf-Rapide.]
Stomatologiia 1987;69:32-4.
- Ebner H, Kraft D. Formaldehyde-induced anaphylaxis after
dental treatment? Contact Dermatitis 1991;24:307-9.
- Wantke F, Hemmer W, Haglmuller T, et al. Anaphylaxis after
dental treatment with a formaldehyde-containing tooth-filling
material. Allergy 1995;50:274-276.
- Forman GH, Ord RA. Allergic endodontic angio-oedema in
response to periapical Endomethasone. Br Dent J
1986;160:348-350.
- Fehr B, Huwyler T, Wuthrich B. [Formaldehyde and
paraformaldehyde allergy. Allergic reactions to formaldehyde and
paraformaldehyde after tooth root treatments.] Schweiz
Monatsschr Zahnmed 1992;102:94-7.
- El Sayed F, Seite-Bellezza D, Sans B, et al. Contact urticaria
from formaldehyde in a root-canal dental paste. Contact
Dermatitis 1995;33:353.
- Haikel Y, Braun JJ, Zana H, et al. Anaphylactic shock during
endodontic treatment due to allergy to formaldehyde in a root
canal sealant. J Endod 2000;26:529-531
- Modre B, Kranke B. Anaphylactic reaction to formaldehyde.
Allergy 2001;56:263- 264
- Tas E, Pletscher M, Bircher AJ. IgE mediated urticaria from
formaldehyde in a dental root canal compound. J Invest Allergol
Clin Immunol 2002;12:130-3
- Cusano F, Luciano S. Contact allergy to benzalkonium chloride
and glutaraldehyde in a dental nurse. Contact Dermatitis
1993;28:127.
- Wiltshire WA, Ferreira MR, Ligthelm At J. Allergy to dental
materials. Quintessence Int 1996; 27:513-20.
- Barclay SC, Forsyth A, Felix DH, et al. Case report –
hypersensitivity to denture materials. Br Dent J 1999:187:350-2
- Hutchinson I. Hypersensitivity to an orthodontic bonding
agent. A case report. Br J Orthod 1994;21:331-3.
- Wuthrich B, Bianchi-Kusch E, Johansson SGO. Allergic urticaria
and angioedema caused by a hemostatic sponge of bovine fibrin
used in tooth extraction. Allergy 1996;51:49-51.
- Hallstrom U. Adverse reaction to a fissure sealant: report of
a case. ASDC J Dent Child 1993; 60:143-6.
- Wantke F, Focke M, Hemmer W, et al. Exposure to formaldehyde
and phenol during an anatomy dissecting course: sensitizing
potency of formaldehyde in medical students. Allergy
2000;55:84-87.
- Charpin D, Dutau H, Falzon S. Hypersensitivity to
formaldehyde. Allergy 2000, 55:986-987


![]()