Introducción
La hiperfuncionalidad de los linfocitos Th2 es una característica inherente a las enfermedades alérgicas, en las que encontramos una elevación de las interleucinas (IL) proinflamatorias, entre ellas IL4, IL5, IL10, IL13 e IL18,1-5 con una disminución de las interleucinas antiinflamatorias como la IL-2, interferón gamma (IFN-γ)?e IL12, producidas por los linfocitos Th1.6- 9
Esta disfunción celular se ha podido estudiar mejor en la alergia respiratoria, especialmente en la sensibilización a los ácaros del polvo casero10 y al polen de abedul.11 Los pacientes que presentan rinitis alérgica (RA) o asma alérgica o extrínseca (AA) sensibles a estos alergenos han sido un buen modelo para estudiar los mecanismos celulares y moleculares que regulan estas alteraciones.
La inmunoterapia específica es una importante opción de tratamiento en pacientes cuyas medidas de control del medio ambiente son ineficientes. La eficacia de la inmunoterapia a largo plazo se demostró en diversos estudios clínicos.12,13
Se han logrado varias modificaciones en la respuesta inmune en enfermos sometidos a regímenes de inmunoterapia, se produce una estimulación de los linfocitos Th1 a expensas de una inhibición de los linfocitos Th2, lo que equilibra la inmunorregulación. Este efecto puede ser detectado midiendo la producción de sus respectivas citocinas.14-16
Las interleucinas 4 (IL-4) y 10 (IL-10) son las citocinas más relevantes producidas por los linfocitos Th2, cuyos efectos se ven reflejados principalmente en la hipergammaglobulinemia de IgE y la agresión eosinofílica a los tejidos de los órganos blanco.17-19 El IFN-γ es uno de los más importantes mediadores de las células Th1, al estimular la proliferación y diferenciación de los linfocitos Th1 y neutralizar la hiperrespuesta Th2 que se presenta en este tipo de pacientes;20-24 en los pacientes con RA y AA está disminuido el IFN-γ y con la inmunoterapia se restablece.
La inmunoterapia específica con el alergeno es el único método curativo en la alergia también específica tipo I.25-27 Los cambios en la respuesta en las células T ante sus antígenos respectivos en esta hipersensibilidad han sido ampliamente corroborados,28-30 por lo cual nosotros quisimos sumarnos a estos hallazgos que nos indican la regulación entre los linfocitos.
Objetivos
Contabilizar los niveles de linfocitos Th1 y Th2 inicialmente y evaluar la forma de regularse la respuesta después del tratamiento con inmunoterapia monoespecífica, mediante la cuantificación de citocinas intracelulares en pacientes con rinitis alérgica y asma extrínseca.
Material y método
Pacientes
Se seleccionaron 10 pacientes (6 con rinitis y 4 con asma) diagnosticados clínicamente y por análisis de laboratorio con edades entre 15 y 45 años, de uno u otro sexo, habitantes de la ciudad de México. Se incluyeron 10 testigos sanos, sin antecedentes de alergia, dentro del mismo rango de edad y sexo.
Tratamiento
Al grupo de pacientes se le administró por vía subcutánea dosis crecientes del alergeno D. pteronyssinus (10 000 AU/ml [Dome-Hollister Stier]) empezando con una dosis dos veces por semana de una dilución 1:10 000 hasta llegar a una dilución de 1:100, lo que logramos en 52 semanas sin que los pacientes tuvieran efectos adversos.
Se tomó una muestra de sangre periférica con anticoagulante antes del tratamiento y al finalizar éste.
Evaluaciones inmunológicas
Se midió la síntesis de citocinas intracelulares en los linfocitos T. Para los Th1 se midió IFN-γ -FITC (B-D). Para los Th2 la IL4 -PE (B-D), IL-10-PE (Serotec) e IL13 -PE (B-D). También se evaluaron los linfocitos que sintetizaban IL- 10, si expresaban CD4 (anti-CD4-FITC, B-D) o CD8 (anti-CD8-FITC, B-D). Se utilizó citometria de flujo y anticuerpos monoclonales para hacer estas evaluaciones.
Técnica para medir citocinas intracelulares
1 -
Obtener muestra de sangre periférica con anticoagulante (heparina).
2 - Colocar 0.5 ml de la muestra y 0.5 ml de medio de cultivo AIM-V en cuatro pozos estériles de una placa de cultivo.
3 - Adicionar a cada pozo los siguientes reactivos:
a) PMA (Phorbol 12 Myristate 13 Acetate), (25 ng) e ionomicina (1 μg)
b) PMA, ionomicina y brefeldina (10 μg)
c) El estimulo antigénico (D. pteronyssnus), previamente estandarizado.
d) Solo brefeldina (basal).
4 - Incubar durante cuatro horas en atmósfera de CO2.
5 - Transcurrido ese tiempo, tomar una muestra de 60 μl de cada pozo y colocarla en tubos a los cuales se les adicionó previamente el anticuerpo anti-CD3- PerCP.
6 - Incubar 15 min a temperatura ambiente.
7 - Adicionar el reactivo de lisis e incubar 10 minutos.
8 - Centrifugar y después adicionar PBS, centrifugar y eliminar el sobrenadante.
9 - Adicionar la solución permeabilizadora de la membrana e incubar 20 minutos.
10 - Lavar con PBS y adicionar 5 μl de cada uno de los siguientes anticuerpos:
a) Al primer tubo control de isotipo γ-1-FITC, γ-2 PE (B-D) y CD3 - PerCP (B-D), la muestra sanguínea se tomó del pozo a.
b) Al segundo tubo, anti-CD69-PE (B-D), la muestra sanguínea se tomo del pozo b.
c) Al tercer tubo, anti-IFN-γ-FITC y anti-IL-10 -PE, la muestra sanguínea se tomó del pozo b.
d) Al cuarto tubo, anti-IFN-γ-FITC y anti-IL-10-PE, la muestra sanguínea se tomó del pozo c.
e) Al quinto tubo, anti-IFN-γ-FITC y anti-IL-10-PE, la muestra sanguínea se tomó del pozo d.
11 - Incubar 30 minutos a temperatura ambiente y lavar con PBS.
12 - Resuspender en solución de paraformaldehído al 1 % en PBS.
13 - Leer en el citómetro de flujo con un programa de tres colores.
Resultados
Los linfocitos Th2 de los pacientes –después de estimularlos con el alergeno sin haber sido sometidos a inmunoterapia– no sintetizaron IL-4 (0.89 ± 1.4) ni IL-13 (0.80 ± 1.3), únicamente IL-10 e IFN-γ, la IL-10 obviamente no se sintetizó en el grupo de testigos sanos.
Los Th1 sólo produjeron bajas concentraciones de IFN-γ (Tabla I, Gráfica I).
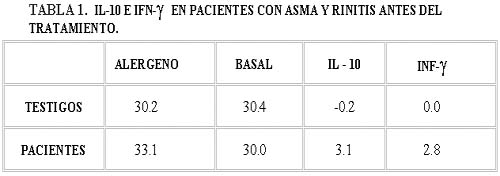
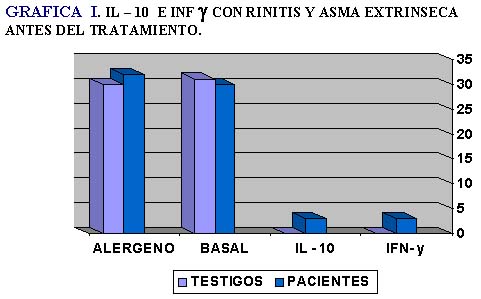
En ambas subpoblaciones de linfocitos T después de empleo de la inmunoterapia específica encontramos que la IL-10 disminuye hasta en un 28.3% en comparación con el valor de estimulación con el alergeno (Tabla II, Gráfica II).
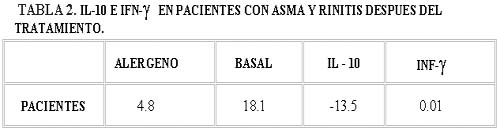
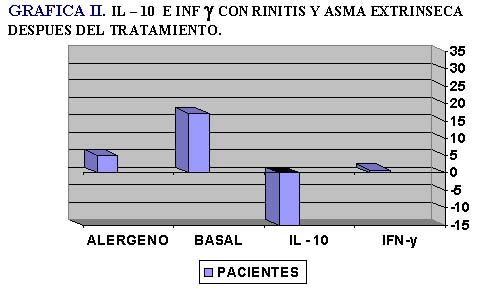
Observamos que INF-γ se detectó en niveles bajos antes del tratamiento y disminuyó aun mas después de la inmunoterapia (tabla I, Gráfica II, tabla II, Gráfica II).
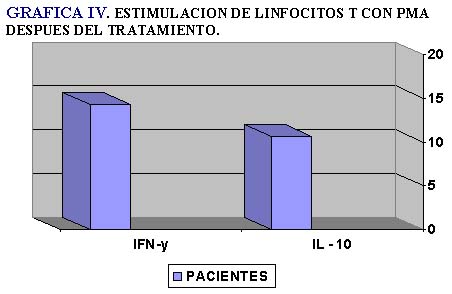
Al realizar estudios in vitro estimulando los linfocitos con PMA encontramos que los pacientes tienen clones capaces de responder a un estímulo que los induzca a dividirse y sintetizar citocinas (Tablas III y IV) (Gráficas III y IV).
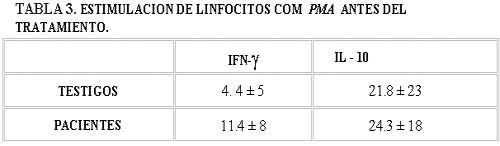

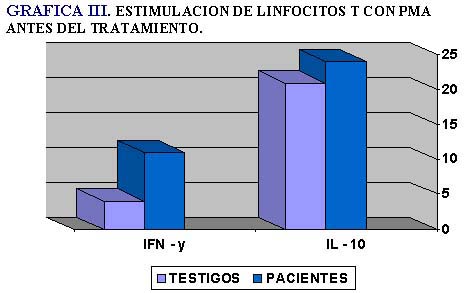
Lo que nos llamó la atención es encontrar que los linfocitos CD8 sintetizaron también IL-10 antes de iniciar la inmunoterapia (Tabla V, Gráfica V).
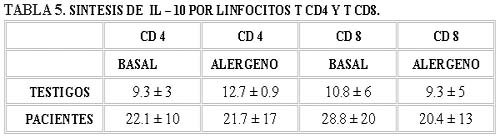
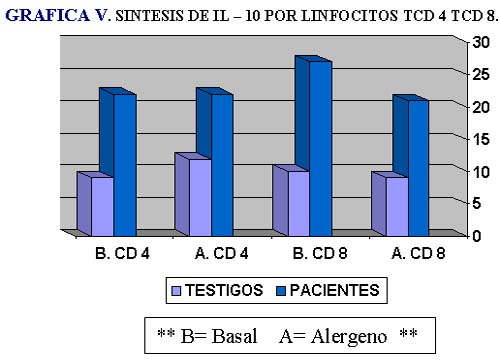
La diferencia que se encontró en el grupo de los pacientes respecto de los testigos sanos es notoria, tanto para los linfocitos T CD4 (diferencia basal 12.8%, alergeno 9.0%); como para los T CD8 (basal 18.0%, alergeno 11.1%); no así, cuando se compara con la basal del mismo grupo. Estos niveles no se midieron después de la inmunoterapia.
Discusión
De acuerdo con lo propuesto por Mosmann y Cofman,31,32 los linfocitos T cooperadores se pueden dividir en linfocitos T cooperadores (Th) 1 y 2, los resultados obtenidos por estos investigadores en modelos murinos también han sido aceptados y demostrados en humanos.30,31
En los pacientes alérgicos se demostró la participación de linfocitos Th2 sintetizando principalmente las citocinas IL-4, IL-10, IL-13. La forma de evaluar la síntesis de estas citocinas ha sido por medio de la técnica de ELISA en suero, por ARNm (PCR); sin embargo, una forma más precisa de hacerlo es mediante la medición intracelular de las mismas en los linfocitos T usando citometría de flujo.
Los resultados obtenidos en este estudio mediante citometría de flujo indican que la respuesta obtenida por los linfocitos Th2 se pudo medir únicamente mediante la síntesis de IL-10; se encontró que la IL-10 es sintetizada en forma basal y con el estímulo antigénico, tanto en el grupo de testigos sanos como en el de los pacientes.
En los linfocitos Th1 se demostró su funcionalidad únicamente por la presencia del IFN-γ, que se encontró en bajas concentraciones. No se encontraron niveles basales o de fondo de IFN-γ, como sucedió para la IL-10.
En el grupo de los pacientes, la IL-10 antes del tratamiento por hiposensibilización con D. pteronyssynus, no se encuentra en niveles altos, sin embargo, después del tratamiento su síntesis disminuye en forma notoria; si comparamos la lectura anterior al tratamiento con inmunoterapia y posterior a ello, para la IL-10 tenemos una diferencia de 28.3%, atribuimos esta diferencia al efecto de la inmunoterapia que lleva a una hipofuncionalidad de los linfocitos Th2. En cambio, para el IFN-γ producido por los linfocitos Th1, aunque está disminuido al inicio, nos llamó la atención que no se observaron cambios notorios, como los obtenidos para la IL-10. Estos datos nos hacen plantear la hipótesis de que el proceso de regulación de la respuesta inmunológica hacia el alergeno, después de la inmunoterapia específica, se lleva a cabo a través de la disminución de la síntesis de la IL-10 (disminuye la participación de los linfocitos Th2); no pudimos demostrar la síntesis del IFN-γ y con esto la participación de los linfocitos Th1.3,13,14,21
Uno de los controles de veracidad de la técnica fue el estimular los linfocitos de los pacientes y de los testigos con PMA e incubar bajo las mismas condiciones que con el alergeno; se obtuvo una buena respuesta tanto para el IFN-γ como para la IL-10. Esto indica que los linfocitos T de los individuos sanos incluidos en este estudio son capaces de responder a ese estímulo.
El resultado esperado es que los linfocitos T CD4+ sean los únicos que sinteticen la IL-10, sin embargo, en esta investigación se encontró que los linfocitos TCD8+ la sintetizan también; esto nos lleva a la reflexión de que la producción de diversas citocinas no es exclusiva de un clon celular y que estamos trabajando en un terreno muy lábil como es el de la inmunorregulación, donde pueden intervenir diversos factores y en diferentes pasos de la respuesta inmune que influyan de tal manera que produzcan los resultados que estamos informando.
Nos surge otra pregunta que consideramos más importante:
¿Cuál es la participación de los linfocitos T CD8+, tanto en los individuos sanos como en los alérgicos?
Probablemente sean linfocitos TCD8+ en la subpoblación Tc-2 los que sinteticen la IL-10. Se puede atribuir este resultado a que los linfocitos TCD8 citotóxicos, también se pueden dividir en Tc1 y Tc2, sobre la base de las citocinas que sintetizan; de acuerdo con los infromes de la literatura son las mismas que para los linfocitos T cooperadores.
Aun así, queda la incógnita acerca de la presencia y la posible participación de los linfocitos TCD8+ en los individuos alérgicos, cuyos niveles se encuentran aumentados tanto en el nivel basal, como al estimularlos con el alergeno.
Conclusiones
Los linfocitos Th2 participan en la rinitis y el asma alérgica.
La inmunoterapia de hiposensibilización disminuye la síntesis de la IL-10.
El IFN-γ no se expresa después del tratamiento.
Los linfocitos de los pacientes responden al PMA.
Los linfocitos T cooperadores y citotóxicos, elaboran IL-10.
La inmunoterapia produce cambios muy complejos en la inmunorregulación, que requieren estudios posteriores.
Los autores no manifiestan “conflictos de interés”.
BIBLIOGRAFÍA
-
Lee Ch, Rhee CS, Oh SH et al. Increase in expression of IL-4 and IL-5 mRNA in
the nasal mucosa of patients with perennial allergic rhinitis during natural allergen
exposure. Ann Otol Rhinol Laryngol 1997; 106:215-19.
-
Yasdanbak HSH, Van Den B, Maizels RM. Th2 responses without atopy:
immunoregulation in chronic helminth infections and reduced allergic diseases.
Trends Immunology 2001; 22:372-77.
-
Akdis CA, Blaser K. Mechanisms of interleukin-10 mediated immune
suppression. Immunology 2001; 103:131-36.
-
Jung T, Shauer U, Heusser C, Neuman C, Reiger C. Detection of intracellular
cytokines by flow cytometry, J Immunol Methods, 1993; 159: 197-207.
-
Pedotti R, De Voss JJ, Steinman L, Gallis J. Involvement of both “allergic” and
“autoimmune” mechanisms in EAE MS and other autoimmune diseases. Trends
Immunology 2003; 479:84.
-
Kay AB. T Lymphocytes and their products in atopic allergy and asthma. Int
Arch Allergy Appl Immunol, 1991; 94:189-93.
-
Robinson DS, Hamid Q, Yings S, Tsicopoulos A, et al. Predominant Th2 like
broncoalveolar T-lymphocite population in atopic asthma. N Eng J Med, 1992;
326:298-304.
-
Bochner BS, Hudson SA, Yiao HQ, Liu MC. Release of both CCR4-active and
CXCR3-active chemokines during human allergic pulmonary late-phase reactions. J
Allergy Clin Immunology 2003; 112:930-34.
-
Christodoulopoulos P, Cameron L, Durham S et al. Molecular phatology of
allergic diseases. II: Upper airways disease. J Allergy Clin Immunol 2000; 105:211-
23.
-
Secrist H, Chelen CJ, Wen Y et al. Allergen immunotherapy decreases
interleukin 4 production in CD4+T cells from allergic individuals. J Exp Med 1993;
178:2123-30.
-
Klimek L, Dormann D, Jarman ER et al. Short-term preseasonal birch pollen
allergoid immunotherapy influences symptoms, specific nasal provocation and
cytokine levels in nasal secretions, but not peripheral T-cell responses in patients
with allergic rhinitis. Clin Exp Allergy 1999; 29:1326-35.
-
Akdis CA, Blaser K, Akdis M. Genes of tolerance. Allergy; 2004: (in press).
-
Jutel M, Akdis M, Budak F, Aebischer-Casaulta C, Wrzyszcz M, Blaser K, Akdis
CA. IL-10 and TGF-β cooperate in the regulatory T cell response to mucosal
allergens in normal immunity and specific immunotherapy. Europ J Immunol 2003;
33:1205-14.
-
Akdis CA, Blesken T, Akdis M, Wuthrich B, Blaser K. Role of IL-10 in specific
immunotherapy. J Clin Invest 1998; 102:98-106.
-
Fleisher TA, Oliveira JB. Functional and molecular evaluation of lymphocytes. J
Allergy Clin Immunol 2004; 114:229-34.
-
Elson LH, Nutman TB, Metcalfe DD, Prussin C, Flow cytometric analysis for
cytokine production identifies T helper 1, T helper 2, and T helper 0 cells within the
human CD4+CD27- lymphocyte subpopulation, J Immunol 1995; 154:4294-301.
-
Bochner BS, Systemic activation of basophils and eosinophil markers and
consequences. J Alergy Clin Immunol 2000; 106 (suppl):S292-302.
-
Moneret-Vautrin DAS, Sainte-Laudy J, Kanny G, Fremont S. Human basophil
activation as measured by CD63 expression and LTC4 release in IgE mediated food
allergy. Ann Allergy Asthma Immunol 1999; 82:33-40.
-
Bochner BS, Sterbinsky SA, Saini SA, Columbo MM, MacGlashan DW. Studies of
cell adhesion and flow cytometric analyses of degranulation, surface phenotype and
viability using human eosinophils, basophils and mast cells. Methods 1997; 13:61-
8.
-
Chen YCH, Bieneman AJ, Creticos PS, Chichester KL, Schroeder J. IFN-
γ inhibitis IL-3 priming of human basophil cytokine secretion but not
leukotriene C4 and histamine release. J Allergy Clin Immunol 2003; 112:944-50.
-
Munthe-Kaas MCH, Carlsen KHG, elms PJ, Gerritsen J et al. CTLA-4
polymorphisms in allergy and asthma and the Th1/Th2 paradigm. J. Allergy Clin
Immunol 2004; 114:280-87.
-
Maggi E, Biswas P, Del Prete M, Parronchi P et al. Acumulation of Th-2 like
helper T cells in the conjunctiva of patients with vernal conjunctivitis. J. Immunol
1991; 146:1169-74.
-
Borish L, Aarons A, Rumbyrt J, Cvietusa P, Negri J, Wenzel S. Interleukin-10
regulation in normal subjects and patients and patients with asthma. J Allergy Clin
Immunol 1996; 97:1288-96.
-
Bousquet J, Becker WM, Hejjaoui A et al. Differences in clinical and
immunologic reactivity of patients allergic to grass pollen and to multiple pollen
species. II Efficacy of a double-blind, placebo-controlled, specific immunotherapy
with standardized extracts. J Allergy Clin Immunol, 1991; 88:43-53.
-
Akdis CA, Blaser K. IL-10 induced anergy in peripheral T cell and reactivation
by microenviromental cytokines: Two key steps in specific immunotherapy. FASEF J
1999; 13:603-9.
-
Durham SR, Till SJ. Immunologic changes associated with allergen
immunotherapy. J Allergy Clin Immunol 1998; 102:157-64.
-
Walker SM, Varney VA, Gaga M et al. Grass pollen immunotherapy: efficacy
and safety during a 4-year follow-up study. Allergy, 1995, 50:405-13.
-
Keskin G, Inal A, Ali Sari R et al. Serum IFN-gamma and IL-10 levels before
and after specific immunotherapy in patients with allergic rhinitis. Allergol
Immunopathol (Madr), 1999; 27:261-64.
-
Kakinoki Y, Ohashi Y, Nakai Y et al. Pollen immunotherapy inhibits T helper l
and 2 cell responses, but suppression of T helper 2 cell response is a more
important mechanism related to the clinical efficacy. Arch Otolaryngol Head Neck
Surg 2000; 126:63-70.
-
Benjaponpitak S, Oro A, Maguire P et al. The kinetics of change in cytokine
production by CD4+T cells during conventional allergen immunotherapy. J Allergy
Clin Immunol 1999; 103:467-75.
-
Mosmann TH, Coffman RL. Two types of mouse helper T cell clones:
implications for immune regulation, Immunol Today, 1987; 8:223-27.
-
Mosmann TR, Coffman Rl. Th1 and Th2 cells: different functional properties.
Ann Rev Immunol 1989; 7:145-73.
|



![]()
