Introducción
Aparte de otras influencias como los irritantes individuales y generales y los factores alérgicos, se sabe que la colonización por Staphylococcus aureus desempeña el papel principal para desencadenar y mantener la dermatitis atópica (DA). El conocimiento acerca del papel fisiopatológico de S. aureus en la DA ha aumentado en los últimos años. La comprensión de los mecanismos subyacentes vinculados con la colonización por S. aureus en la DA y la identificación de las moléculas que desencadenan la inflamación de la piel influyen de manera importante en el enfoque terapéutico de la enfermedad.1- 9
Los factores de provocación individuales ejercen un papel importante en la actividad de la enfermedad razón por la cual deben ser diagnosticados en cada paciente en particular.7,10 Los factores de provocación también incluyen irritantes exógenos no específicos que afectan la barrera cutánea y conducen a la exacerbación. La interrupción de la función de la barrera cutánea en los pacientes con DA es conocida como uno de los aspectos fisiopatológicos principales de esta entidad.11 Los cambios cualitativos y cuantitativos en la composición de lípidos12-14 resultan no sólo en un incremento en la pérdida de agua transepidérmica (PATE),15 sino también en una mayor susceptibilidad hacia los irritantes externos en la piel afectada y en la no afectada.11 La protección con telas adecuadas puede ayudar a reducir la exposición a los factores exógenos desencadenantes.
Sin embargo, las telas pueden actuar como irritantes potentes, y esto depende de su textura y del material. Por lo tanto, para los pacientes con DA es esencial el uso de prendas adecuadas con telas con bajo potencial irritante. Hasta ahora, las telas de algodón son lo más avanzado dentro de las telas recomendadas para los pacientes con DA y se utilizan con frecuencia en el enfoque terapéutico de la enfermedad.16 No obstante, es alta la demanda para encontrar telas que se adapten a los individuos con enfermedades cutáneas, especialmente con eccema atópico.
La combinación de la terapia antimicrobiana con telas compatibles en términos de telas biofuncionales es un enfoque innovador y prometedor. Además, una de las metas principales en la terapia de las enfermedades crónicas es la reducción de los efectos adversos.
Los productos de plata se investigaron en forma intensiva en años recientes con atención especial en la curación de heridas. La actividad antibacteriana de la plata es conocida, así como su bajo potencial para producir efectos colaterales.17- 19 A pesar de que los mecanismos antimicrobianos exactos de la plata no están completamente dilucidados, los productos con plata se emplean en forma amplia en distintos campos de la medicina. Actualmente, los materiales con cubierta de plata se utilizan con frecuencia en cirugía (fijación externa), urología (catéter) u odontología.20-22 Las telas de plata ofrecen nuevas modalidades de tratamiento en la DA con dos ventajas clave como la actividad antimicrobiana de amplio espectro y la escasa resistencia a las drogas.23 Los efectos protectores de las prendas confortables junto con los efectos antibacterianos pueden contribuir con la mejoría clínica de la DA mediante la eliminación de factores desencadenantes importantes.
Telas con filamentos de plata
Las telas con filamentos de plata, actualmente en el mercado (Padycare R) están compuestas por una micromalla (82% poliamida, 18% lycra) con un entramado de filamentos de plata y con un contenido total de plata del 20%. Se encuentran disponibles en todos los talles, para los lactantes como también para los adultos (figura A). Estos géneros deben estar bien ajustados durante su uso para asegurar la interacción entra la fibra y la piel. Se llevaron a cabo estudios in vitro e in vivo con estas telas.24-26

Actividad antibacteriana
En gran medida, la actividad antibacteriana de la plata no se ha aclarado. Las investigaciones con el tratamiento con AgNO3 y bacterias demostraron la separación de la membrana citoplasmática de la pared celular. En el centro de las células apareció una región con electroluminiscencia la cual contenía moléculas de ácido desoxirribonucleico (ADN) condensadas. La existencia de elementos de plata y sulfuro en los gránulos electrodensos y en el citoplasma detectados mediante el microanálisis con rayos X sugirieron el mecanismo antibacteriano de la plata: la pérdida de la capacidad de replicación del ADN y la inactivación de la proteína luego del tratamiento con Ag+.17
Los estudios in vitro de las telas con filamentos de plata investigadas demostraron una disminución significativa de las bacterias (S. aureus y Pseudomonas aeruginosa) como también de Candida albicans.
Por el contrario, se encontró que el efecto citotóxico fue comparativamente bajo.26
En una comparación bilateral controlada con placebo el efecto antibacteriano de las telas con filamentos de plata sobre la colonización por S. aureus en los sitios afectados se evaluó en los pliegues de ambos codos. En 15 pacientes con diagnóstico de DA localizada, estas telas con filamentos de plata demostraron una actividad antibacteriana potente que se acompañó de una mejoría en la gravedad clínica del eccema atópico superior a la del algodón.24 Las telas con filamentos de plata indujeron una reducción significativamente mayor de S.
aureus ya a los dos días luego del inicio del tratamiento con las telas que perduró durante toda la fase de la terapia (figuras 1 y 2). La comparación entre las telas con filamentos de plata y los sitios tratados con algodón revelaron una disminución significativa en la colonización por S. aureus en el día 7 (p = 0.002) y en el momento del control (día 14; p < 0.05) en el sitio tratado con las telas con filamentos de plata. Al inicio, como también al segundo día, no se pudo observar una diferencia significativa entre las dos modalidades terapéuticas (figura 3).
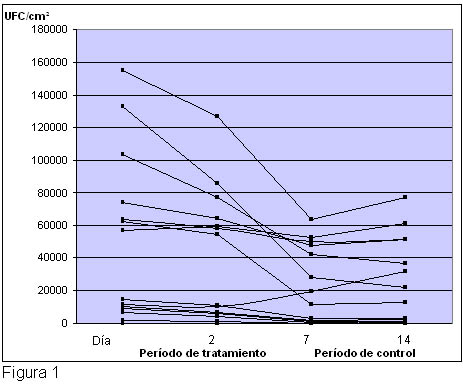
Figura 1.
Colonización bacteriana por S. aureus en los sitios afectados en contacto con las telas con filamentos de plata (pliegue del codo derecho) en los diferentes momentos de la evaluación: días 0, 2, 7 y 14. Los resultados de la colonización por S. aureus en los 15 pacientes se expresaron en UFC/cm2.
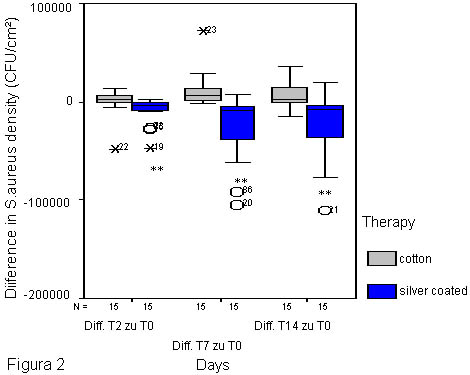
Figura 2.
Diferencia en la densidad de S. aureus dentro de los sitios afectados en contacto con las telas con filamentos de plata (pliegue del codo derecho) y en contacto con el algodón (pliegue del codo izquierdo) en pacientes con DA durante el período estudiado (día 0 vs. días 2, 7 y 14), expresada en UFC/cm2. La reducción de S. aureus fue altamente significativa en los días 2, 7 y 14 en los sitios en contacto con las telas con filamentos de plata (pliegue de codo derecho) (**p < 0.01) comparado con el momento del inicio del estudio (día 0). En los sitios en contacto con el algodón no se observaron diferencias significativas. O * valores extremos fuera del alcance del análisis estadístico.

Figura 3.
Diferencia en la densidad de S. aureus entre los sitios en contacto con las telas con filamentos de plata (pliegue del codo derecho) y aquellos en contacto con el algodón (pliegue del codo izquierdo) en pacientes con DA durante el período estudiado (día 0, 2, 7 y 14), expresada en UFC/cm2. La colonización por S. aureus fue significativamente menor en los días 7 y 14 en los sitios en contacto con las telas con filamentos de plata (pliegue de codo derecho) (*p < 0.05; **p < 0.01) comparados con el algodón. O * valores extremos fuera del alcance del análisis estadístico.
Incluso 7 días después de la finalización del tratamiento, la densidad de S.
aureus fue significativamente menor en comparación con el momento del inicio del estudio o con el algodón, lo cual demuestra un efecto prolongado en la reducción del estafilococo observada durante el período de uso activo. Esto contrasta con los efectos observados con la tinción de violeta de genciano antiestafilocócica, donde la interrupción del tratamiento produjo la recolonización subsiguiente inmediata.27 Estos hallazgos podrían indicar que el uso nocturno de las telas con filamentos de plata puede ser capaz de sostener la disminución constante de S aureus.
En la comparación bilateral, la reducción de S. aureus fue paralela a la disminución de la gravedad clínica.
Eficacia clínica
En los dos estudios realizados se pudo observar la mejoría clínica tanto en la comparación bilateral controlada con placebo como en el ensayo clínico a doble ciego, controlado con placebo.
SCORAD
El Scoring Atopic Dermatitis (SCO
RAD) es una herramienta conocida y apropiada para medir la gravedad clínica de la DA.28,29 Este índice acumulativo combina criterios objetivos (la extensión e intensidad de las diferentes lesiones de la piel) y subjetivos (prurito diurno y la pérdida del sueño). La extensión (A) de las lesiones eccematosas se mide por medio de la regla del nueve, para la intensidad (B) se utilizan 5 ítem: eritema (1), edema/pápulas (2), secreción/costras (3), escoriaciones (4), liquenificación (5). Cada ítem se categorizó en una escala de 4 puntos: 0 = ausente, 1 = leve, 2 = moderado, 3 = grave. El prurito diurno y la pérdida del sueño (C) se evaluaron por el paciente mediante una escala analógica visual de 0 a 10. El SCORAD se calculó por medio de la siguiente fórmula matemática:
SCORAD= A/5 + 7B/2 + C
La gravedad local de la enfermedad se valoró mediante los mismos 6 ítem que miden la intensidad, como en el SCORAD general. Además, el prurito local también se mide con una escala de 4 puntos. El puntaje total de gravedad es la sumatoria de los resultados obtenidos en las diversas escalas; el puntaje máximo posible es igual a 18.
Los SCORAD general y local son herramientas certificadas para la medición objetiva de la gravedad clínica de la DA. Las telas con filamentos de plata fueron capaces de reducir el SCORAD local como también el general en los dos ensayos controlados con placebo que se llevaron a cabo.
En la comparación bilateral, la reducción de S. aureus fue paralela a la mejoría de la gravedad clínica. Luego de dos días se observó una disminución constante del SCORAD local en el sitio en contacto con la tela con filamentos de plata (pliegue del codo derecho) en casi todos los pacientes y este descenso continuó hasta la finalización del tratamiento (día 7). A partir de ahí la gravedad del eccema se evaluó en forma constante en la mitad de los pacientes. La mejoría clínica del eccema local fue significativa en todos los momentos de la evaluación (días 2, 7 y 14) en comparación con el inicio (p = 0.003, p = 0.001, p = 0.004, respectivamente).
Además, al comparar las dos ramas del tratamiento, el SCORAD local fue menor de manera constante en todos los momentos de la evaluación clínica en el sitio en contacto con la tela con filamentos de plata (pliegue del codo derecho) y alcanzó gran significación estadística al séptimo día e incluso luego de 7 días de la finalización del tratamiento (día 14) (figura 4).
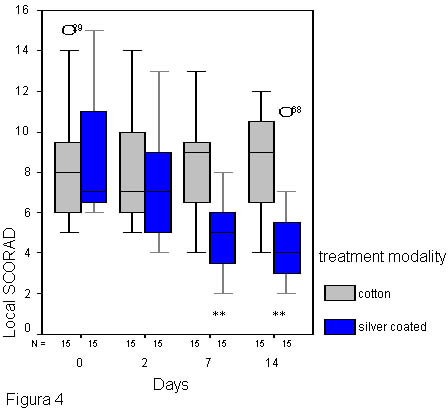
Figura 4.
Diferencias en la gravedad clínica de la dermatitis atópica en los sitios afectados en contacto con las telas con filamentos de plata (pliegue del codo derecho) y en contacto con el algodón (pliegue del codo izquierdo) en pacientes con DA. Se pudo observar la reducción significativa del SCORAD local los días 7 y 14 (** p < 0.01) en los sitios en contacto con las telas con filamentos de plata comparados con aquellos en contacto con el algodón. La gravedad clínica del eccema se expresó mediante el SCORAD local (0-18) en los 15 pacientes. O * valores extremos fuera del alcance del análisis estadístico.
Estos resultados prometedores, sin embargo, no significan demasiado si se toma en cuenta el cuadro clínico complejo de la DA. Debido a que la DA es una enfermedad sistémica y no local con una variedad de factores individuales y generales influyentes, el efecto de las telas con filamentos de plata sobre la gravedad clínica de la DA, incluso los síntomas subjetivos así como el potencial irritante de las prendas constituyen los aspectos de mayor interés.
Para investigar los aspectos de la mejoría clínica general y la comodidad durante el uso de estas telas se llevó a cabo un estudio a doble ciego, aleatorizado, controlado con placebo.
En este estudio, la mejoría del eccema se demostró claramente mediante la reducción significativa del SCORAD. El descenso fue significativo sólo en el grupo de telas con filamentos de plata luego de 7 días (T1) y 14 días (T2), mientras que en el grupo placebo no se registró una diferencia estadística antes y después del estudio (figura 5). Esto podría ser explicado por el efecto antibacteriano de la plata que conduce a la reducción del factor de provocación S. aureus.
La mejoría clínica también se observó en el grupo placebo, probablemente debido al régimen adicional de tratamiento con telas de algodón y al efecto placebo de la atención médica y del investigador.

Figura 5.
SCORAD general (gravedad del eccema): mejoría significativa del SCORAD general luego de una y de dos semanas de tratamiento en el grupo verum (telas con filamentos de plata). No hubo diferencias estadísticas en el grupo placebo (algodón) entre las condiciones previas, durante o después del estudio. *p < 0.05; **p < 0.01.
Síntomas subjetivos
Los síntomas subjetivos, que son realmente importantes en la DA, se redujeron de manera significativa en la primera semana de tratamiento en el grupo placebo (algodón)(figura 6). No obstante, luego de dos semanas, la interrupción del sueño y el prurito también disminuyeron de manera significativa en el grupo tratado con plata (figura 6). Como se registró en un cuestionario entregado, se observaron diferencias significativas entre el grupo de telas con filamentos de plata y el grupo placebo después de 7 días del período de uso, en lo concerniente a la evaluación subjetiva de la mejoría del prurito (p = 0.02). Luego de dos semanas, la mejoría del prurito se mantuvo altamente significativa en el grupo de telas con filamentos de plata en comparación con el placebo (p < 0.001).
Incluso el estado cutáneo se consideró como significativamente mejor (p = 0.003) en el grupo de telas con filamentos de plata, así como la mejoría del sueño (p = 0.02), cuando se evaluó el cuestionario.
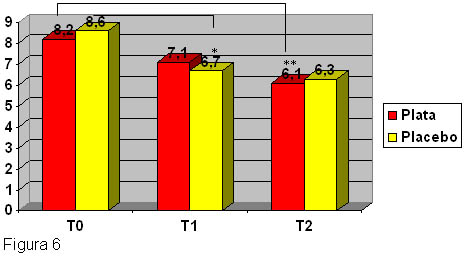
Figura 6.
Síntomas subjetivos en la evaluación del SCORAD (pérdida del sueño y prurito): reducción significativa de los síntomas subjetivos en el grupo placebo (algodón) en la primera semana, pero no al finalizar el estudio. En el grupo verum (telas con filamentos de plata), se observó una disminución significativa del prurito y de la pérdida del sueño, luego de la finalización del estudio en comparación con el inicio. *p < 0.05; **p < 0.01.
Además, las telas de plata fueron capaces de reducir las alteraciones en la calidad de vida (CDV) de manera significativa luego de dos semanas del período de uso y en forma similar al algodón (figura 7). La CDV es un factor importante en las enfermedades crónicas de la piel y muchos estudios demostraron que todos los aspectos diferentes de la CDV se modifican por la enfermedad.30 La necesidad de considerar los síntomas subjetivos es muy importante.
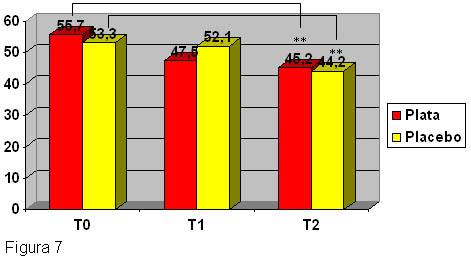
Figura 7.
Alteraciones en la calidad de vida (CDV): mejoría significativa al finalizar el estudio en el grupo placebo (algodón) y en el grupo verum (telas con filamentos de plata). **p < 0.01.
Efectos colaterales
Durante ambos estudios no se registraron efectos colaterales relacionados con las telas estudiadas. Las muestras de sangre extraídas al azar de los pacientes que usaron estas telas en las condiciones del estudio, con su consentimiento, no revelaron elevación en los niveles séricos de plata. Sin embargo, se podría considerar una posible absorción sistémica de la plata debido a la interrupción de la barrera cutánea.
El empleo de corticoides tópicos se documentó en el ensayo controlado con placebo.
Hubo más pacientes en el grupo placebo que en el grupo de telas con filamentos de plata que requirieron corticoides (84.4% versus 68.6%, respectivamente) sin significación estadística. Al inicio, el 42.9% de los pacientes en el grupo de telas con filamentos de plata y el 22.7% del grupo placebo habían utilizado corticoides tópicos. Luego de dos semanas, el consumo de corticoides se redujo al 24.6% en el total, al 28.6% en el grupo tratado con plata y al 18.2% en el grupo placebo. En el grupo de telas con filamentos de plata se observó una tendencia hacia una diferencia más pronunciada en el uso de corticoides. No obstante, no se encontraron diferencias estadísticas entre los dos grupos estudiados o durante el curso del tratamiento.
Potencial irritante
Los factores irritantes en la DA comprenden la radiación ultravioleta, el agua y los detergentes, la sudoración o las temperaturas extremas o los cambios de la temperatura: del calor al frío y viceversa. Como se mencionó anteriormente, las telas pueden poseer un potencial irritante en la barrera cutánea alterada de los pacientes con DA. Por esta razón, las telas para el tratamiento de la DA deben reunir gran cantidad de requisitos para cumplir con las demandas de los pacientes.
Las telas deben producir comodidad en todas las condiciones ambientales: fría, cálida, húmeda y seca. Deben cumplir los requerimientos de los pacientes en cuanto al tipo de piel: pieles grasas o hidratadas como también pieles secas o no hidratadas. Hasta ahora, las prendas de algodón son las telas recomendadas debido a que demostraron un potencial irritante bajo. Los enteritos de algodón para los lactantes se emplean como tratamiento en forma regular.31
En el estudio realizado, la comodidad durante el uso de las telas con filamentos de plata fue comparable a la del algodón, no se observaron diferencias significativas entre ambos grupos. A su vez, se demostró que con las telas con filamentos de plata la regulación de la temperatura era mejor aunque sin relevancia estadística, con respecto al algodón (73.5% y 50%, respectivamente) sin generación de calor importante (8.8% vs. 13.6%).
Conclusión
Tomados en conjunto, los resultados de los estudios realizados con las telas con filamentos de plata en el tratamiento de la DA avalan la importancia del uso de telas confortables en la enfermedad. Se demostró la eficacia clínica de las telas con filamentos de plata junto con un buen perfil antibacteriano. Además se comprobó que son muy funcionales y cómodas.
Se sabe que las prendas adecuadas contribuyen con la estabilización de la barrera cutánea y del eccema.11,16,31
Más allá de los múltiples factores de provocación individuales, los estímulos microbianos como las bacterias y los hongos, en especial S. aureus, son reconocidos como factores de provocación importantes de la DA.1- 7
Se observó que el grado de colonización se asoció con la gravedad de la enfermedad.2,4,8 Las telas con filamentos de plata fueron capaces de reducir significativamente la colonización por S. aureus junto con una importante mejoría terapéutica del eccema de acuerdo con parámetros objetivos y subjetivos. Estos hallazgos concuerdan con la experiencia clínica en cuanto a que la terapia antiséptica es esencial para el tratamiento eficiente de las lesiones de la DA24 y estudios previos, demostraron que la terapia con antibióticos o antisépticos es fundamental para la eliminación más rápida de las lesiones.27,32
El efecto clínico de las telas de algodón también pudo demostrarse, lo cual avala el papel de las telas confortables en la terapia de la DA para proteger la piel de los factores de provocación. Además de los mecanismos irritantes, se sabe que las reacciones alérgicas a los aeroalérgenos son los factores desencadenantes principales y que la exposición a alérgenos importantes puede conducir a la exacerbación o a la persistencia de la DA. Los aeroalérgenos más importantes son los ácaros del polvo doméstico, el polen y la caspa de los animales como el gato, el perro y los caballos. Además de evitar los alérgenos, lo cual puede ser difícil en el caso de los aeroalérgenos ubicuos, como el polen, la protección de la piel expuesta contra los factores de provocación con telas adaptables es la medida más importante. A su vez, las telas protegen la piel sensible e inflamada de las secuelas del rascado (interrumpen el ciclo de prurito-rascado) y por esto pueden ser consideradas como herramientas terapéuticas importantes.16,31
En resumen, se demostró claramente que las telas con filamentos de plata presentan una potente actividad antibacteriana in vivo y son capaces de reducir la gravedad clínica de la DA de manera significativa dentro del período de uso de dos semanas, sin efectos colaterales. Las telas con filamentos de plata son confortables y comparables con el algodón en cuanto a la comodidad de uso y su funcionalidad; el prurito podría disminuir de manera más efectiva que con el algodón. Estos efectos terapéuticos producen la reducción significativa de las alteraciones en la calidad de vida, luego de dos semanas. El uso de las telas con filamentos de plata es posible que disminuya la frecuencia del empleo de corticoides tópicos o que lleve a que se utilicen aquellos con menor potencia, aunque hasta el presente no existen datos disponibles suficientes. También, se deberá investigar, en el futuro, la cantidad y el efecto de los iones de plata que se desprenden de estas telas, como también los posibles efectos debidos a la absorción en los pacientes que las usan.
La autora manifiesta: “no tener conflictos de intereses ni financieros en relación con el contenido de este artículo, ya que no ha recibido apoyo financiero alguno”.
BIBLIOGRAFÍA
-
Leung DYM. Role of Staphylococcus aureus in atopic dermatitis. In:
Atopic Dermatitis (Bieber T, Leung DYM, eds). New York, Basel: Marcel Dekker, Inc.
2002; 401-18.
-
Bunikowski R, Mielke ME, Skarabis H et al. Evidence for a disease-promoting
effect of Staphylococcus aureus-derived exotoxins in atopic dermatitis. J
Allergy Clin Immunol 2000; 105:814-9.
-
Yarwood JM, Leung DY, Schlievert PM. Evidence for the involvement of bacterial
superantigens in psoriasis, atopic dermatitis, and Kawasaki syndrome. FEMS
Microbiol Lett 2000; 192:1-7.
-
Nomura I, Tanaka K, Tomita H et al. Evaluation of the staphylococcal exotoxins
and their specific IgE in childhood atopic dermatitis. J Allergy Clin Immunol 1999;
104:441-6.
-
Mempel M, Schmidt T, Weidinger S et al. Role of Staphylococcus aureus
surface-associated proteins in the attachment to cultured HaCaT keratinocytes
in a new adhesion assay. J Invest Dermatol 1998; 111:452-6.
-
Leung DYM. Atopic dermatitis: the skin as a window into the pathogenesis of
chronic allergic diseases. J Allergy Clin Immunol 1995; 96:302-18.
-
Ring J, Abeck D, Neuber K. Atopic eczema: role of microorganisms on the skin
surface. Allergy 1992; 47:265-9.
-
Williams REA, Gibson AG, Aitchinson TC et al. Assessment of a contact-plate
sampling technique and subsequent quantitative bacterial studies in atopic
dermatitis. Br J Dermatol 1990; 123:493-501.
-
Bode U, Ring J, Neubert U. Intrakutantestungen und bakteriologische
Untersuchungen bei Patienten mit atopischem Ekzem. Allergologie 1982; 5:259-61.
-
Fischer S, Ring J, Abeck D: Atopic eczema. Spectrum of provovocation factors
and possibilities for their effective reduction and elimination. Hautarzt 2003;
54:914-24.
-
Abeck D, Bleck O, Ring J. Skin barrier and eczema. In: Ring J, Behrendt H,
Vieluf D, editors. New Trends in Allergy IV. Berlin. Springer. 1996; 213-220.
-
Bleck O, Abeck D, Ring J et al. Two ceramide subfractions detectable in Cer(AS)
position by HPTLC in skin surface lipids of nonlesional skin of atopic eczema. J
Invest Dermatol. 1999; 113:894-900.
-
Imokawa G, Abe A, Jin K et al. Decreased level of ceramides in stratum
corneum of atopic dermatitis: an etiologic factor in atopic dry skin? J Invest
Dermatol. 1991; 96:523-526.
-
Murata Y, Ogata J, Higaki Y et al. Abnormal expression of sphingomyelin
acylase in atopic dermatitis: an etiologic factor for ceramide deficiency? J Invest
Dermatol. 1996; 106:1242-1249.
-
Werner Y, Lindberg M. Transepidermal water loss in dry and clinically normal
skin in patients with atopic dermatitis. Acta Derm Venereol. 1985; 65:102-105.
-
Ring J, Brockow K, Abeck D. The therapeutic concept of patient management in
atopic eczema. Allergy 1996; 51:206-15.
-
Feng QL, Wu J, Chen GQ et al. A mechanistic study of the antibacterial effect of
silver ions on Escherichia coli and Staphylococcus aureus. J
Biomed Mater Res 2000; 52:662-8.
-
Hollinger MA. Toxicological aspects of topical silver pharmaceuticals. Crit Rev
Toxicol 1996; 26:255-60.
-
Stalder JF, Fleury M, Sourisse M et al. Comparative effect of two topical
antiseptics (chlorhexidine vs KMn04) on bacterial skin flora in atopic dermatitis.
Acta Derm Venereol (Stockh.) 1992; Suppl. 176:132-34.
-
Bosetti M, Masse A, Tobin E et al. Silver coated materials for external fixation
devices: in vitro biocompatibility and genotoxicity. Biomaterials 2002; 23:887-92.
-
Schaeffer AJ, Story KO, Johnson SM: Effect of silver oxide/trichloroisocyanuric
acid antimicrobial urinary drainage system on catheter-associated bacteriuria. J
Urol 1988; 139:69-73.
-
Matsura T, Abe Y, Sato Y et al. Prolonged antimicrobial effect of tissue
conditioners containing silver zeolite. J Dent 1997; 25:373-7.
-
Lansdown AB. Silver. I: Its antibacterial properties and mechanism. J Wound
Care 2002; 11:125-30.
-
Gauger A, Mempel M, Schekatz A et al. Silver-coated textiles reduce
Staphylococcus aureus colonization in patients with atopic eczema.
Dermatology 2003; 207:15-21.
-
Gauger A, Fischer S, Mempel M et al. Efficacy and functionality of silver-coated
textiles in patients with atopic eczema. JEADV 2005; accepted BioService: Test
001118. 2001.
-
Brockow K, Grabenhorst P, Abeck D et al. Effect of gentian violet, corticosteroid
and tar preparations in Staphylococcus-aureus-colonized atopic eczema.
Dermatology 1999; 199:231-236.
-
Kunz B, Oranje AP, Labreze L et al. Clinical validation and guidelines for the
SCORAD index: consensus report of the European Task Force on Atopic Dermatitis.
Dermatology. 1997; 195:10-11.
-
European Task Force on Atopic Dermatitis. Severity scoring of atopic
dermatitis. The SCORAD index. Consensus report of the European Task force on
Atopic Dermatitis. Dermatology. 1993; 186:23-31.
-
Grob JJ, Revuz J, Ortonne JP et al. Comparative study of the impact of chronic
urticaria, psoriasis and atopic dermatitis on the quality of life. Br J Dermatol.
2005;152:289-95.
-
Abeck D, Strom K. Optimal management for atopic dermatitis. Am J Clin
Dermatol. 2000; 1:41-46.
-
Lever R, Hadley K, Downey D et al. Staphylococcal colonization in atopic
dermatitis and the effect of topical mupiricin therapy. Br J Dermatol. 1988;
119:189-198.
|



![]()
