Introducción
Existen fuertes indicios de que los virus respiratorios tienen un papel importante como inductores y desencadenantes en enfermedades con sibilancias durante los primeros años de vida, así como en las exacerbaciones asmáticas que tienen lugar posteriormente. Sin embargo, su participación en el origen del asma es más controvertida. El tracto respiratorio y el sistema inmunitario maduran rápidamente durante los primeros años de vida y el desarrollo posnatal del pulmón se afecta y, a su vez, influye en las respuestas a las infecciones virales. Varios factores, entre ellos, edad, tipo de virus, gravedad, localización y momento de la infección, en combinación con la interacción de alergia y contaminación ambiental, han sido involucrados en la susceptibilidad de las vías aéreas inferiores a los efectos de virus respiratorios comunes. En esta revisión se analiza la información obtenida en estudios actuales sobre la interacción entre infecciones virales respiratorias, inicio y exacerbación de los síntomas asmáticos.
Infecciones respiratorias virales en el inicio del asma
Los estudios epidemiológicos avalan el concepto de que los síntomas asmáticos aparecen más frecuentemente durante los primeros años de vida, en particular antes de los 3 años. La infección por virus respiratorio sincitial (VRS) es responsable de alrededor del 70% de todos los casos de bronquiolitis infantil, mientras que rinovirus, metapneumovirus, virus influenza y parainfluenza son causas menos comunes aunque posiblemente con igual importancia.1-3 Los estudios sobre historia natural de las enfermedades obstructivas después de la bronquiolitis grave por VRS son frecuentes en la literatura.4-6 Durante el seguimiento de una cohorte en la cual la bronquiolitis grave por VRS en la infancia fue el factor más importante de riesgo de aparición de asma,7 hiperreactividad de la vía aérea (HVA) y sensibilización alergénica, Sigurs y col. recientemente mostraron que este efecto continúa también en los primeros años de la adolescencia.6En otro trabajo reciente, Korppi y col. evaluaron prospectivamente la evolución de las sibilancias infantiles en la edad adulta. El grupo de estudio estuvo integrado por 54 niños internados por bronquiolitis, 34 por neumonía sin sibilancias y 45 controles. Hallaron que los pacientes con bronquiolitis tenían mayor riesgo de presentar asma y mayor reactividad bronquial.8-9 Igualmente, Gómez y col. estudiaron 71 individuos de 17 a 24 años y observaron que el antecedente de bronquiolitis puede ser un factor que predispone a elevada prevalencia de síntomas respiratorios e HVA.10 Sin embargo, el hecho de que la influencia de la bronquiolitis por VRS sobre el riesgo de sibilancias recurrentes disminuya con el tiempo,4,11 sugiere la participación de cofactores adicionales. Por otra parte, en uno de los trabajos más importantes, el efecto reducido del VRS a los 13 años no ocurre con otros virus o casos en los cuales no se detectan virus, probablemente por representar infecciones por rinovirus (RV).4 Los RV podrían tener un papel trascendente en las bronquiolitis y se ha sugerido que pueden estar asociados con enfermedad más grave.2Un estudio reciente de Finlandia sugirió que los lactantes internados por bronquiolitis inducida por RV tenían 4 veces más riesgo de presentar asma durante los años escolares en comparación con niños en los que no se identificaban RV, aun después del control según otros factores de confusión.12 Estos resultados confirman que los RV son agentes desencadenantes importantes de sibilancias en niños de menos de 2 años y que la participación de otros virus –distintos del VRS– en la aparición de asma merece mayor evaluación.Los modelos animales generalmente avalan la posibilidad de que la infección viral temprana podría predisponer directamente a reactividad persistente de la vía aérea. Los estudios del efecto de la edad sobre la respuesta a la infección por VRS en un modelo murino indicaron que aunque la infección primaria por VRS en ratones recién nacidos seguía la misma cinética viral que en adultos, los efectos de la reinfección eran menos graves cuando la infección primaria se retrasaba, fenómeno que sugiere que la infección por VRS a edades muy jóvenes tendría el potencial de originar anormalidades en el sistema inmunitario a largo plazo.13Schwartze y col. mostraron que cuando ratones BALB/c eran infectados por vía intranasal con VRS humano, el ARN genómico y mensajero persistía en los homogeneizados de pulmón.14 La persistencia de patógenos en el pulmón podría perpetuar la inflamación, a su vez exacerbada por nuevas infecciones y probablemente ocasionando las características de reactividad aérea.15Sin duda, los estudios de intervención con agentes que evitan la infección por VRS ayudarán a distinguir entre causalidad y asociación en la aparición de enfermedades con sibilancias posbronquiolitis. Wenzel y col. mostraron que 13 niños que habían sido tratados profilácticamente 7 a 10 años antes con globulina inmune anti-VRS, en comparación con 26 controles, tenían mejor cociente entre volumen espiratorio forzado en un segundo/capacidad vital forzada, menos atopia y referían con menor frecuencia haber tenido alguna vez ataques de asma.16 Se esperan estudios prospectivos más amplios y aleatorizados con anticuerpos monoclonales humanizados anti-VRS.El debate acerca de si la bronquiolitis por VRS es un factor causal de asma o simplemente identifica niños que están predispuestos a presentar patologías bronquiales obstructivas aún continúa.17 En modelos teóricos y animales, las infecciones respiratorias graves que se producen durante los primeros años de vida pueden comprometer el proceso normal de maduración, la respuesta inmunológica e inflamatoria del huésped y los mecanismos de control neural. También es posible que los lactantes susceptibles con menor función pulmonar o con vulnerabilidad genética presenten una respuesta anormal a los agentes infecciosos y, así, tengan infecciones respiratorias graves que influyen en la evolución a largo plazo.18 La calidad del sistema inmunológico sistémico o de mucosas, con menor actividad antiviral o con compromiso de la regulación de la inflamación tisular, podría aumentar aún más el efecto de las infecciones virales sobre la funcionalidad pulmonar.19 También es posible que la infección viral grave y los trastornos inmunológicos preexistentes, entre ellos atopia, influyan adicionalmente en la aparición de asma.20
¿Las infecciones por virus respiratorios protegen contra la aparición de asma?
En familias grandes se detectaron indicios firmes de protección contra alergias y asma, un hecho que sugiere que las enfermedades infecciosas que se transmiten más probablemente en grandes familias podrían modular la maduración del sistema inmunitario y la aparición de alergia.21 También hay información que indica que la exposición repetida a infecciones virales durante la primera infancia en los centros de cuidados diurnos podría reducir el riesgo de sensibilización alergénica.22 Más aun, la exposición a niveles elevados de endotoxina, como se observa en granjas, se asocia con índices más bajos de alergia y con mayor número de células productoras de interferón-gamma (IFN-γ) en sangre periférica.23,24 En los casos mencionados previamente, la “poca” higiene reflejaría la exposición a una variedad de microorganismos de patogenicidad baja o sin patogenicidad en lugar de elementos microbianos no infecciosos o en combinación con éstos. Otros factores biológicos que podrían incluirse en el mismo contexto abarcan la exposición temprana a mascotas, los efectos de la flora intestinal y el mayor uso de antibióticos y probióticos.25,26Los datos específicamente relacionados con infecciones virales respiratorias y el inicio de los síntomas asmáticos, sin embargo, no son concluyentes. Unos pocos trabajos refirieron que las infecciones por patógenos específicos, como sarampión o micobacterias, se asociaban con índices menores de sensibilización a alérgenos y asma; empero, estos resultados no fueron posteriormente confirmados.27-30 La atopia, el asma y la fiebre del heno se relacionaron inversamente con infecciones orofecales, originadas en los alimentos, como infección por Toxoplasma gondii, Helicobacter pylori y virus A de hepatitis (VHA) pero no con virus que se transmiten por otras vías (por ejemplo, sarampión y rubéola).31 Llamativamente, la sensibilización cutánea al maní fue menos frecuente en los sujetos con anticuerpos contra el VHA, un hallazgo que indicaría que los niveles bajos de higiene podrían evitar la sensibilización atópica no sólo a inhalantes sino también a alérgenos alimentarios. Los resultados de un estudio de población en adultos daneses mostraron que aunque los anticuerpos contra Toxoplasma gondii, Helicobacter pylori y VHA se asociaban con menor prevalencia de atopia, las respuestas séricas de IgG a bacterias enteropatógenas como Clostridium difficile, Campylobacter jejuni y Yersinia enterocolitica se acompañaban de una elevada prevalencia de atopia.32 Estas observaciones motivan la posibilidad de que diferentes grupos de microorganismos ejerzan efectos distintos sobre el riesgo de atopia; otra alternativa es que el índice y no el tipo de infección sea más relevante, tal como lo propusieron Matricardi y Bonini.33En un estudio prospectivo de cohorte, Illi y col. sugirieron que las infecciones leves repetidas del tracto respiratorio alto y las infecciones virales de tipo herpes en los primeros años de vida se relacionaban negativamente con asma a los 7 años. Inversamente, cuando las infecciones ocurrían en las vías aéreas bajas, el riesgo de asma aumentaba significativamente en relación dependiente de la dosis.34 Otros estudios confirmaron el efecto deletéreo de las infecciones respiratorias bajas en los primeros años de vida en la incidencia de asma posterior; sin embargo, sin que se verificase en todos los casos el papel protector de las infecciones respiratorias altas.35 Es posible que el efecto de las infecciones sobre la incidencia de asma y atopia dependa de la gravedad o del número acumulado, del estadio de maduración inmunológica y de la susceptibilidad del huésped.Estudios recientes en modelos animales mostraron que ciertos virus, como el VRS y el virus de neumonía de ratones, pueden aumentar las respuestas alérgicas de citoquinas Th2 mientras que otros (influenza) no lo harían.36 Sin embargo, el pasaje a Th2 no sería el único elemento contribuyente en la aparición de enfermedades alérgicas. En un modelo murino, Dahl y col. encontraron que el IFN-γ que surge como parte de la respuesta inmunológica primaria de adaptación a la infección por influenza aumentaba la sensibilización alergénica y la inflamación alérgica. Este efecto estaba mediado, al menos en parte, por células dendríticas (CD) polarizadas a Th1, productoras de IFN-γ.37 Se requieren más estudios para confirmar la magnitud en la cual las CD pueden influir en las respuestas inmunitarias después de las infecciones virales respiratorias.En conjunto, en lo que concierne al papel protector de las infecciones virales sobre la aparición de atopia/asma, todo indica que son necesarios estudios prospectivos con confirmación de laboratorio de las infecciones para poder evaluar el efecto individual y acumulado de diferentes microorganismos y de sus productos sobre la respuesta inmunológica y potencialmente sobre la incidencia de alergia y asma.
Exacerbaciones asmáticas inducidas por virus
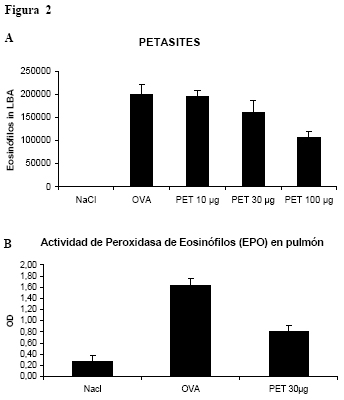
Si bien aún no se comprende con precisión el papel de los virus en la inducción o protección de alergia y asma, su participación en exacerbaciones asmáticas está bien establecida. El compromiso de virus respiratorios en las crisis de asma es una observación clínica frecuente; sin embargo, tal asociación sólo se estableció con certeza cuando se dispuso de métodos sensibles de detección viral, como reacción en cadena de polimerasa inversa (RT-PCR). Varios estudios recientes confirmaron la elevada proporción de casos de exacerbación asmática en asociación con infección viral, inicialmente propuesta por Johnston y col. en niños y Nicholson y col. en adultos.38-43Si bien muchos virus respiratorios pueden causar síntomas asmáticos, los RV son los que se detectan con mayor frecuencia, especialmente durante el otoño y, menos frecuentemente, en primavera.44Es probable que los individuos con asma no necesariamente tengan más resfríos; sin embargo es posible que presenten exageración de síntomas cuando están en contacto con virus respiratorios. Un estudio prospectivo de resfríos en parejas integradas por un sujeto atópico asmático y un individuo sano demostró que las infecciones causaban síntomas respiratorios bajos de mayor duración y más graves en los asmáticos; en cambio los parámetros sintomáticos en vías respiratorias altas no diferían entre los grupos.45Obviamente, la comprensión de los mecanismos de las exacerbaciones inducidas por virus podría brindar información importante sobre la patogenia del asma y sobre nuevos blancos terapéuticos. El epitelio bronquial ejerce un papel importante en el inicio de la respuesta a las infecciones virales respiratorias: por un lado es el sitio de replicación viral; por otra parte allí comienzan las respuestas antivirales. La capacidad de los RV de infectar el epitelio bronquial ha sido tema de discusión durante mucho tiempo. Sin embargo, actualmente está dilucidado; se vio que el virus es capaz de alcanzar, penetrar y replicarse en el epitelio bronquial luego de resfríos experimentales con RV.46 Desde entonces, la presencia de RV en los pulmones fue confirmada en varios estudios.47-49 Varias citoquinas y quimioquinas, entre ellas eotaxina específica de eosinófilos y eotaxina-2, se producen en el epitelio infectado por virus.50 La infección epitelial también es responsable de la producción de interleuquina (IL) 12, el principal inductor en la producción de IFN-γ e IL-11.51-52 Llamativamente, los estudios en un modelo murino de infección por paramixovirus mostraron que la infección por un único paramixovirus no sólo era causa de bronquiolitis aguda; también podía desencadenar una respuesta crónica con hiperreactividad aérea e hiperplasia de las células caliciformes aun en ausencia de inflamación mediada por ICAM-1. Estos hallazgos establecen la capacidad de las infecciones virales de cambiar el comportamiento del epitelio hacia un patrón similar al que se observa en el asma.53Varias investigaciones evaluaron la posibilidad de que la alergia y las infecciones respiratorias puedan actuar sinérgicamente en la expresión de los síntomas asmáticos. En un estudio de casos y controles se observó que el riesgo de internación aumentaba paralelamente con la presencia de infección viral, sensibilización alergénica y exposición a alérgenos respiratorios.54 Por el contrario, la exposición a alérgenos no necesariamente aumenta las respuestas mediadas por virus.55-57Un trastorno inmunológico esencial en asma es el desequilibrio entre las respuestas Th1-Th2 a favor de la producción de citoquinas Th2. El ciclo de reparación epitelial defectuoso, característico del asma y fuertemente correlacionado con HVA, se amplifica en presencia de citoquinas Th2.58 Wark y col. demostraron que las células epiteliales bronquiales primarias derivadas de individuos atópicos tienen una respuesta innata anormal a la infección por RV con niveles reducidos de IFN-β, efecto que se acompaña de mayor replicación viral y lisis celular en comparación con células de controles normales sanos.59Estudios recientes indican que las respuestas inmunológicas a los RV son defectuosas en individuos atópicos asmáticos, con una desviación a un fenotipo Th2 y menor producción de IFN-γ, fenómeno que podría estar asociado con depuración viral incompleta y aumento persistente de la inflamación que caracteriza el asma.60 Más aun, se vio que este desequilibrio de citoquinas se correlaciona con mediciones de gravedad en asma, como HVA a metacolina, un hecho que avala el concepto de que las respuestas antivirales anormales podrían estar asociadas con la gravedad del asma.61 La HVA es un hallazgo crucial en asma y las observaciones a partir de estudios clínicos y en animales con infecciones virales experimentalmente inducidas sugieren que los virus son capaces de inducir HVA en personas sanas y particularmente en individuos asmáticos.62 Figura 1. Diagrama de Kaplan-Meyer que muestra la vuelta a los valores normales de PC20 después de una o más infecciones respiratorias altas naturales durante un período de 9 meses en niños asmáticos atópicos y no atópicos. La diferencia es significativa (p = 0.0068, análisis de sobrevida). A partir de datos publicados en J Allergy Clin Immunol. Varias investigaciones mostraron que la infección viral induce cambios más importantes en la HVA inespecífica en pacientes con alergia respiratoria en comparación con controles normales.63 Recientemente observamos que la duración de la HVA inespecífica posviral es considerablemente más prolongada que lo estimado con anterioridad: oscila entre 5 y 11 semanas (7 semanas en promedio). La duración de la HVA después de un resfrío aislado fue la misma en niños atópicos y no atópicos; sin embargo, un número mayor de episodios sintomáticos acumulados se asocia, en pacientes con asma y atopia, con HVA de mayor duración (figura 1).64 Si se tiene en cuenta que la magnitud de la respuesta de la vía aérea es indicadora de la gravedad del asma y un marcador indirecto de inflamación aérea, la prolongación de la HVA inducida por virus bien puede reflejar inflamación persistente de la vía aérea después de múltiples infecciones. La perpetuación de inflamación aérea subclínica podría tener un efecto sustancial sobre el riesgo de asma persistente y brindaría una explicación posible para el papel bien establecido de atopia como principal factor de riesgo de persistencia de asma y de HVA desde la niñez hacia la edad adulta.
Conclusión
El papel de la infección viral respiratoria en la aparición de asma aún no se comprende con exactitud. Otros diversos factores, como tipo de agente, gravedad de la enfermedad, momento de la infección y, más aun, predisposición del huésped, tienen una participación crucial.Por otro lado, existen pocas dudas de que hay una fuerte asociación entre las infecciones virales y la inducción de enfermedad sibilante y exacerbaciones asmáticas. Los mecanismos subyacentes, aunque no se conocen con precisión, probablemente sean multifactoriales e involucren la inflamación de la mucosa bronquial, la cual interactúa bajo ciertas circunstancias con la inflamación alérgica. Además, las infecciones repetidas juegan un papel importante en la perpetuación de la inflamación y de la HVA, especialmente en presencia de atopia, fenómeno que ocasiona el pasaje de asma de la niñez hacia un fenotipo de asma más persistente.Los autores no manifiestan “conflictos de interés”.
BIBLIOGRAFÍA
- Xepapadaki P, Psarras S, Bossios A, et al. Human Metapneumovirus as a causative agent of acute bronchiolitis in infants. J Clin Virol 2004; 30(3):267-70.
- Papadopoulos NG, Moustaki M, Tsolia M, et al. Association of rhinovirus infection with increased disease severity in acute bronchiolitis. Am J Respir Crit Care Med 2002; 165(9):1285-9.
- Peebles RS, Jr. Viral infections, atopy, and asthma: is there a causal relationship J Allergy Clin Immunol 2004; 113(1 Suppl):S15-8.
- Stein RT, Sherrill D, Morgan WJ, et al. Respiratory syncytial virus in early life and risk of wheeze and allergy by age 13 years. Lancet 1999; 354(9178):541-5.
- Noble V, Murray M, Webb MS, et al. Respiratory status and allergy nine to 10 years after acute bronchiolitis. Arch Dis Child 1997; 76(4):315-9.
- Sigurs N, Gustafsson PM, Bjarnason R, et al. Severe respiratory syncytial virus bronchiolitis in infancy and asthma and allergy at age 13. Am J Respir Crit Care Med 2005; 171(2):137-41.
- Sigurs N, Bjarnason R, Sigurbergsson F, et al. Respiratory syncytial virus bronchiolitis in infancy is an important risk factor for asthma and allergy at age 7. Am J Respir Crit Care Med 2000; 161(5):1501-7.
- Korppi M, Piippo-Savolainen E, Korhonen K, et al.Respiratory morbidity 20 years after RSV infection in infancy. Pediatr Pulmonol 2004; 38(2):155-60.
- Piippo-Savolainen E, Remes S, Kannisto S, et al. Asthma and lung function 20 years after wheezing in infancy: results from a prospective follow-up study. Arch Pediatr Adolesc Med 2004; 158(11):1070-6.
- Gomez R, Colas C, Sebastian A, et al. Respiratory repercussions in adults with a history of infantile bronchiolitis. Ann Allergy Asthma Immunol 2004; 93(5):447-51.
- Kneyber MCJ, Steyerberg EW, de Groot R, et al. Long-term effects of respiratory syncytial virus (RSV) bronchiolitis in infants and young children: a quantitative review. Acta Paediatr 2000; 89(6):654-60.
- Kotaniemi-Syrjanen A VR, Reijonen TM, Waris M, et al. Rhinovirus-induced wheezing in infancy-the first sign of childhood asthma J Allergy Clin Immunol 2003; 111(1):66-71.
- Culley FJ, Pollott J, Openshaw PJ. Age at first viral infection determines the pattern of T cell-mediated disease during reinfection in adulthood. J Exp Med 2002; 196(10):1381-6.
- Schwarze J, O'Donnell DR, Rohwedder A, et al. Latency and persistence of respiratory syncytial virus despite T cell immunity. Am J Respir Crit Care Med 2004; 169(7):801-5.
- Openshaw PJ, Yamaguchi Y, Tregoning JS. Childhood infections, the developing immune system, and the origins of asthma. J Allergy Clin Immunol 2004; 114(6):1275-7.
- Wenzel SE, Gibbs RL, Lehr MV, et al. Respiratory outcomes in high-risk children 7 to 10 years after prophylaxis with respiratory syncytial virus immune globulin. Am J Med 2002; 112(8):627-33.
- Piedimonte G. The association between respiratory syncytial virus infection and reactive airway disease. Respir Med 2002; 96 Suppl B:S25-9.
- Busse WW, Banks-Schlegel SP, Larsen GL. Effects of growth and development on lung function. Models for study of childhood asthma. Am J Respir Crit Care Med 1997; 156(1):314-9.
- Gern JE, Rosenthal LA, Sorkness RL, et al. Effects of viral respiratory infections on lung development and childhood asthma. J Allergy Clin Immunol 2005; 115(4):668-74; quiz 675.
- Papadopoulos NG, Johnston SL. The role of viruses in the induction and progression of asthma. Curr Allergy Asthma Rep 2001; 1(2):144-52.
- Infante-Rivard C, Amre D, Gautrin D, et al. Family size, day-care attendance, and breastfeeding in relation to the incidence of childhood asthma. Am J Epidemiol 2001; 153(7):653-8.
- Ball TM, Castro-Rodriguez JA, Griffith KA, et al. Siblings, day-care attendance, and the risk of asthma and wheezing during childhood. N Engl J Med 2000; 343(8):538-43.
- Gereda JE, Leung DY, Thatayatikom A, et al. Relation between house-dust endotoxin exposure, type 1 T-cell development, and allergen sensitisation in infants at high risk of asthma. Lancet 2000; 355(9216):1680-3.
- Liu AH. Endotoxin exposure in allergy and asthma: reconciling a paradox. J Allergy Clin Immunol 2002; 109(3):379-92.
- Ownby DR, Johnson CC, Peterson EL. Exposure to dogs and cats in the first year of life and risk of allergic sensitization at 6 to 7 years of age. Jama 2002; 288(8):963-72.
- Von Mutius E. Environmental factors influencing the development and progression of pediatric asthma. J Allergy Clin Immunol 2002; 109(6S):S525-32.
- Shaheen SO, Aaby P, Hall AJ, et al. Measles and atopy in Guinea-Bissau. Lancet 1996; 347(9018):1792-6.
- Shirakawa T, Enomoto T, Shimazu S, et al. The inverse association between tuberculin responses and atopic disorder. Science 1997; 275(5296):77-9.
- Strannegard IL, Larsson LO, Wennergren G, et al. Prevalence of allergy in children in relation to prior BCG vaccination and infection with atypical mycobacteria. Allergy 1998; 53(3):249-54.
- Paunio M, Heinonen OP, Virtanen M, et al. Measles history and atopic diseases: a population-based cross-sectional study. JAMA 2000; 283(3):343-6.
- Matricardi PM, Rosmini F, Riondino S, et al. Exposure to foodborne and orofecal microbes versus airborne viruses in relation to atopy and allergic asthma: epidemiological study. BMJ 2000; 320(7232):412-7.
- Linneberg A, Ostergaard C, Tvede M, et al. IgG antibodies against microorganisms and atopic disease in Danish adults: the Copenhagen Allergy Study. J Allergy Clin Immunol 2003; 111(4):847-53.
- Matricardi PM, Bonini S. High microbial turnover rate preventing atopy: a solution to inconsistencies impinging on the Hygiene hypothesis Clin Exp Allergy 2000; 30(11):1506-10.
- Illi S, Von Mutius E, Lau S, et al. Early childhood infectious diseases and the development of asthma up to school age: a birth cohort study. BMJ 2001; 322(7283):390-5.
- Celedon JC, Litonjua AA, Ryan L, et al. Day care attendance, respiratory tract illnesses, wheezing, asthma, and total serum IgE level in early childhood. Arch Pediatr Adolesc Med 2002; 156(3):241-5.
- Barends M, de Rond LG, Dormans J, et al. Respiratory syncytial virus, pneumonia virus of mice, and influenza A virus differently affect respiratory allergy in mice. Clin Exp Allergy 2004; 34(3):488-96.
- Dahl ME, Dabbagh K, Liggitt D, et al.Viral-induced T helper type 1 responses enhance allergic disease by effects on lung dendritic cells. Nat Immunol 2004; 5(3):337-43.
- Johnston SL, Pattemore PK, Sanderson G, et al. Community study of role of viral infections in exacerbations of asthma in 9-11 year old children. BMJ 1995; 310(6989):1225-9.
- Nicholson KG, Kent J, Ireland DC. Respiratory viruses and exacerbations of asthma in adults. BMJ 1993; 307:982-986.
- Grissell TV, Powell H, Shafren DR, et al. IL-10 Gene Expression in Acute Virus-induced Asthma. Am J Respir Crit Care Med 2005.
- Platts-Mills TA, Rakes G, Heymann PW. The relevance of allergen exposure to the development of asthma in childhood. J Allergy Clin Immunol 2000; 105(2 Pt 2):S503-8.
- Brouard J, Freymuth F, Toutain F, et al. Role of viral infections and Chlamydia pneumoniae and Mycoplasma pneumoniae infections in asthma in infants and young children. Epidemiologic study of 118 children. Arch Pediatr 2002; 9 Suppl 3:365s-371s.
- Wark PA, Johnston SL, Moric I, et al. Neutrophil degranulation and cell lysis is associated with clinical severity in virus-induced asthma. Eur Respir J 2002; 19(1):68-75.
- Johnston NW, Johnston SL, Duncan JM, et al. The September epidemic of asthma exacerbations in children: a search for etiology. J Allergy Clin Immunol 2005; 115(1):132-8.
- Corne JM, Lau L, Scott SJ, et al. The relationship between atopic status and IL-10 nasal lavage levels in the acute and persistent inflammatory response to upper respiratory tract infection. Am J Respir Crit Care Med 2001; 163(5):1101-7.
- Papadopoulos NG, Bates PJ, Bardin PG, et al. Rhinoviruses infect the lower airways. J Infect Dis 2000; 181(6):1875-84.
- Mosser AG, Brockman-Schneider R, Amineva S, et al. Similar frequency of rhinovirus-infectible cells in upper and lower airway epithelium. J Infect Dis 2002; 185(6):734-43.
- Ghildyal R, Dagher H, Donninger H, et al. Rhinovirus infects primary human airway fibroblasts and induces a neutrophil chemokine and a permeability factor. J Med Virol 2005; 75(4):608-15.
- Mosser AG, Vrtis R, Burchell L, et al. Quantitative and qualitative analysis of rhinovirus infection in bronchial tissues. Am J Respir Crit Care Med 2005; 171(6):645-51.
- Papadopoulos NG, Papi A, Meyer J, et al. Rhinovirus infection up-regulates eotaxin and eotaxin-2 expression in bronchial epithelial cells. Clin Exp Allergy 2001; 31(7):1060-6.
- Walter MJ, Kajiwara N, Karanja P, et al. Interleukin 12 p40 production by barrier epithelial cells during airway inflammation. J Exp Med 2001; 193(3):339-51.
- Zheng T, Zhu Z, Wang J, et al. IL-11: insights in asthma from overexpression transgenic modeling. J Allergy Clin Immunol 2001; 108(4):489-96.
- Walter MJ, Morton JD, Kajiwara N, et al. Viral induction of a chronic asthma phenotype and genetic segregation from the acute response. J Clin Invest 2002; 110(2):165-75.
- Green RM, Custovic A, Sanderson G, et al. Synergism between allergens and viruses and risk of hospital admission with asthma: case-control study. BMJ 2002; 324(7340):763.
- Trigg CJ, Nicholson KG, Wang JH, et al. Bronchial inflammation and the common cold: a comparison of atopic and non-atopic individuals. Clin Exp Allergy 1996; 26(6):665-76.
- Avila PC. Interactions between allergic inflammation and respiratory viral infections. J Allergy Clin Immunol 2000; 106:829-831.
- de Kluijver J, Evertse CE, Sont JK, et al. Are rhinovirus-induced airway responses in asthma aggravated by chronic allergen exposure Am J Respir Crit Care Med 2003; 168(10):1174-80.
- Davies DE, Wicks J, Powell RM, et al. Airway remodeling in asthma: new insights. J Allergy Clin Immunol 2003; 111(2):215-25; quiz 226.
- Wark PA, Johnston SL, Bucchieri F, et al. Asthmatic bronchial epithelial cells have a deficient innate immune response to infection with rhinovirus. J Exp Med 2005; 201(6):937-47.
- Papadopoulos NG, Stanciu LA, Papi A, et al. A defective type 1 response to rhinovirus in atopic asthma. Thorax 2002; 57(4):328-32.
- Brooks GD, Buchta KA, Swenson CA, et al. Rhinovirus-induced interferon- and airway responsiveness in asthma. Am J Respir Crit Care Med 2003; 168:1091-1094.
- Folkerts G, Busse WW, Nijkamp FP, et al. Virus-induced airway hyperresponsiveness and asthma. Am J Respir Crit Care Med 1998; 157(6 Pt 1):1708-20.
- Gern JE, Calhoun W, Swenson C, et al. Rhinovirus infection preferentially increases lower airway responsiveness in allergic subjects. Am J Respir Crit Care Med 1997; 155(6):1872-6.
- Xepapadaki P, Papadopoulos NG, Bossios A, et al. Duration of post-viral airway hyperresponsiveness in children with asthma: effect of atopy. J Allergy Clin Immunol 2005; In press.
|



![]()