|

|
Autor:
Dra. Patricia Marina
Carrascosa
Columnista Experta de SIIC
Institución:
Diagnóstico
Maipú, San Isidro, Buenos Aires, Argentina
|
Introducción
Con la introducción en 1998 de los tomógrafos de última generación
denominados Multislice, que poseen múltiples filas de detectores,
y con la creación de un software denominado cardíaco retrospectivo,
que permite registrar las ondas electrocardiográficas del paciente
durante la adquisición y luego brindar imágenes sin movimiento
cardíaco (gating cardíaco), surge un nuevo método diagnóstico
no invasivo, útil en la evaluación de las arterias coronarias,
mostrando alta sensibilidad (S) y especificidad (E) en la cuantificación
de la estenosis coronaria en múltiples trabajos publicados (1-3).
Actualmente es posible realizar otras evaluaciones cardiológicas
con la misma adquisición, como la perfusión miocárdica, el análisis
de volúmenes ventriculares, la motilidad parietal y la anatomía
de ventrículo izquierdo. De esta manera, la TCMS permite una
evaluación cardiológica integral, brindando información anatómica
y funcional (4).
Angiografía coronaria no
invasiva
La angiografía digital (AD) es el método gold-standard
para la cuantificación de estenosis. Sin embargo es un método
invasivo y posee limitaciones diagnósticas ya que sólo proporciona
información de la luz (1, 5). La angiografía coronaria no invasiva
por TCMS permite evaluar no sólo la luz arterial sino también
la pared. Los estudios fueron realizados con un tomógrafo de
4 filas de detectores (Mx8000; Philips Medical Systems) con
cortes de 1.3 mm de espesor cada 0.6 mm corrida de mesa, pitch:
0.375; kV: 120; mA: 400; y rotación del gantry: 500 milisegundos.
Se administraron 130 ml de contraste e.v. aplicado con bomba
inyectora, con una doble fase; los primeros 70 ml a 4 ml/seg
y los ultimos 60 ml a 2.5 ml/seg. A pacientes con frecuencia
cardíaca (FC) mayor de 70 latidos por minuto se les administró
beta-bloqueantes por vía endovenosa, con el objetivo de reducir
la FC, permitiendo un adecuado funcionamiento del software.
Una vez obtenidas las fases del ciclo cardíaco (3 diastólicas;
1 sistólica), fueron reprocesadas de las siguiente manera:
Reconstrucciones multiplanares: permiten evaluar las
arterias coronarias, detectar la presencia de placas y caracterizarlas
determinando sus densidades y morfología.
Reconstrucciones tridimensionales con ventana de transparencias:
permiten evaluar las arterias coronarias en relación al corazón,
o bien dejando únicamente las arterias coronarias, que pueden
ser visualizadas en las mismas proyecciones que utiliza la AD.
Endoscopía virtual: permite visualizar la arteria endo-
luminalmente, detectando la presencia y ubicación de las placas
ateroscleróticas.
Dichas reconstrucciones también permiten ubicar más precisamente
las placas ubicadas en áreas de bifurcación o trifurcación vascular.
Actualmente es posible realizar una cuantificación automática
de las estenosis coronarias. Se utiliza un software denominado
Cardiac CTA , el cual permite trazar una línea central
en la arteria seleccionada sobre una reconstrucción tridimensional
y brinda los cortes seccionales perpendiculares en todo su trayecto.
La arteria se despliega bidimensionalmente y sobre la reconstrucción
tridimensional, se disponen 2 líneas para realizar la cuantificación.
Una de ellas es la línea de referencia, que debe ser situada
en un sector de la arteria con calibre normal y la otra es la
línea de obstrucción, la cual se situará en los lugares donde
se detecte reducción del calibre del vaso. Una vez posicionadas
ambas líneas el software realiza la cuantificación, por diámetros
y por área. Esta modalidad de cuantificación permite realizar
mediciones más exactas, evitando la variabilidad interobservador
que se presentaba en las cuantificaciones manuales, y una reducción
significativa en los tiempos de posprocesado.
Correlación con angiografía
digital
Entre marzo de 2001 y marzo de 2003, se estudió un total de
200 pacientes (edad media 50 años) con sospecha o conocimiento
de enfermedad coronaria. La cuantificación de la estenosis en
la AD se realizó por angiografía cuantitativa y se consideró
como hallazgo positivo a una estenosis de 50% o más. Los resultados
entre ambos métodos se compararon en forma ciega.
Se evaluaron 8 arterias coronarias: tronco de coronaria izquierda
(TCI), arteria descendente anterior (DA), arteria diagonal (Dg),
arteria cincunfleja (Cx), ramo lateroventricular de Cx, ramo
auriculoventricular de la Cx y arteria coronaria derecha (CD).
Análisis estadístico: se determinaron los intervalos
de confianza de las proporciones por el método exacto binomial,
y se calculó la correlación entre los métodos por el índice
de Spearman.
Resultados
No hubo complicaciones en los pacientes evaluados. En 15% se
detectaron artefactos por movimiento en al menos una arteria
coronaria y fueron excluidos del análisis. La arteria que presentó
mayor número de artefactos fue la CD, en 70% de los casos.
La S global fue de 80.6% (77.5-84.9), la E de 93.7% (91.4-95.4),
el valor predictivo positivo 85.6% (80.7-89.4) y el valor predictivo
negativo de 91.2% (88.7-93.2) (Figura 1).

Figura 1. A. Reconstrucción
axial con volume rendering mostrando el origen y porción media
de la arteria coronaria derecha (CD) y arteria descendente anterior
(DA). B. Vista coronal. C Endoscopia virtual
de el DA. D. Angiografía digital. E.
y F. Reconstrucción volume rendering de una CD normal.
G.
Reconstrucción multiplanar curva de la CD y DA. H. Angiografía
digital de la CD.
• Caracterización
de placa
Al poder evaluar la luz de la arteria y su pared, la TCMS permite
caracterizar la placa ateromatosa, determinando el tipo de placa
(blanda, fibrosa, calcificada) según su densitometría en unidades
Hounsfield, y su disposición en la luz vascular (concéntrica
o simétrica, excéntrica o asimétrica). En un subgrupo de 30
pacientes, estos hallazgos fueron correlacionados con la ecografía
intravascular (IVUS), método invasivo que permite evaluar la
pared vascular y caracterizar la placa (5, 6).
La densitometría de las placas fue: placa blanda, 75.73 UH (±
44.30); placa fibrosa 148.61 UH (± 36.54) y placa calcificada
449.07 UH (± 221.4) (Figura 2).
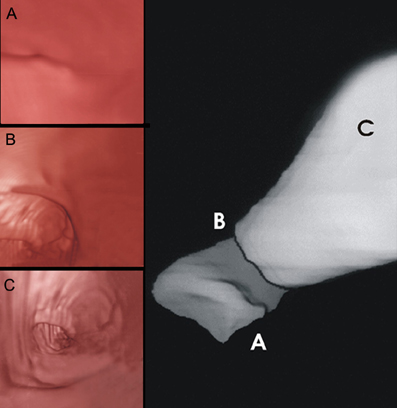
Figura 2. Múltiples
placas mixtas predominantemente blandas en la arteria circunfleja
(CX). A. Reconstrucción multiplanar curva de la CX. B.
Cuantificación de estenosis en el cuarto segmento por tomografía
computada. C. Cuantificación de estenosis en el cuarto
segmento por ecografía intravascular.
• Perfusión
miocárdica
Las imágenes obtenidas son evaluadas con un software denominado
cardiac review que nos brinda proyecciones en eje corto
y largo del corazón y (Figura 3). Se estudiaron 20 pacientes
con TCMS y medicina nuclear (MN). Se evaluaron 1200 seg (60
pacientes x 20 seg) . Hubo 804 verdaderos negativos, 324 verdaderos
positivos, 15 falsos positivos y 46 falsos negativos. La sensibilidad
fue del 87.6% (83.7-90.7), la especificidad fue del 98.2% (96.9-98.9),
el valor predictivo positivo fue del 95.6 % (92.6-97.4) y el
valor predictivo negativo fue del 94.6% (92.8-96.0).

Figura 3. A.
Imágenes de medicina nuclear en estrés y en reposo. Se observa
hipoperfusión en la región anterolateral correspondiente a una
necrosis miocárdica.
B y C. TC Multislice: reconstrucción multiplanar
reordenada en eje corto observándose reducción del espesor parietal
anterolateral y disminución de la densidad miocárdica (reducción
en UH en relación con los sectores normales).
• Análisis
volumétrico
Actualmente es posible calcular en forma automática los volúmenes
de fin de sístole (VFS), de fin de diástole (VFD) y la fracción
de eyección (FE) del ventrículo izquierdo (VI). Para ello es
necesario reprocesar la información de 8 o 9 fases del ciclo
cardíaco. De cada una de ellas se obtienen los ejes cortos del
VI que luego son introducidos en un software denominado LV-RV
analysis. Los contornos endocárdicos y epicárdicos del VI
son demarcados en forma automática en cada fase y posteriormente
se obtienen los resultados (Figura 4).
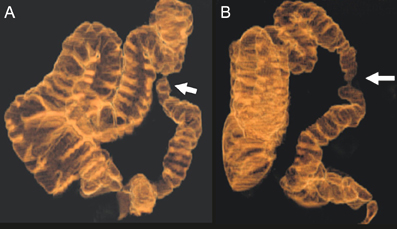
Figura 4. A y
B. Medicina nuclear: volúmenes sistólicos y diastólicos. C
y D. Tomografía computada: reconstrucciones 3D de
los volúmenes sistólicos y diastólicos.
Hemos estudiado 25 pacientes con TCMS y ecocardiografía. La
correlación entre ambos métodos se realizó con el índice de
Spearman (rS). En forma global, la correlación entre los métodos
mostró un rS = 0.862 (0.75-0.92), p > 0.0001. Para el VFS, rS
=0.874, , para el VFD, rS=0.828 y para la FE, rS=0.61 p<0.0001.
(Figura 3).
• Anatomía
del ventrículo izquierdo
La anatomía del VI puede ser evaluada también con TCMS. Como
en ecocardiografía, el espesor de la pared septal, de la pared
posterior y el diámetro del VI pueden ser calculados.
Nuestra evaluación incluyó 20 pacientes, determinando la correlación
de los métodos por el índice de Spearman (rS) con los siguientes
resultados: para el espesor septal, rS = 0.96; para la pared
posterior, rS = 0.81; para el diámetro del VI, rS = 0.69 y en
forma global, rS = 0.96 (0.92-0.98).
• Motilidad
parietal
La motilidad de la pared ventricular puede ser evaluada por
este método utilizando tanto reconstrucciones tridimensionales
como las imágenes axiales reorientadas en eje corto o largo.
De esta manera se determina si el miocardio se mueve correctamente
o si existen áreas de hipoquinesia o aquinesia. Esta información,
correlacionada con los resultados de perfusión, son de importancia
para determinar viabilidad miocárdica.
Hemos evaluado a un grupo de 20 pacientes por TC y MN gatillada.
La TCMS en la detección de alteraciones de la motilidad parietal
tuvo S de 92.3% (62.1-99.6), E de 100% (56.1-100.0), valor predicitvo
positivo de 100% (69.9-100.0) y valor predictivo negativo de
87.5% (46.7-99.3).
Conclusión
La aparición de la TCMS en 1998 abrió, al campo de la tomografía,
la posibilidad de evaluar las arterias coronarias, permitiendo
estudiar y cuantificar la enfermedad coronaria de una forma
no invasiva. Con el desarrollo de los equipos y de las estaciones
de trabajo, hoy en día es posible realizar una serie de aplicaciones
que permitirán en un solo estudio una evaluación cardiológica
global.
BIBLIOGRAFIA
Achenbach
S, Moshage W, Ropers D, et al. Curved multiplanar reconstructions
for the evaluation of contrast-enhanced electron beam CT of
the coronary arteries. Am J Roentgenol 1998;170:895-899.
Cline H,
Coulam C, Yavuz M, et al. Coronary artery angiography using
multislice computed tomography images. Circulation 2000;102:1589-1590.
Carrascosa
P, Padilla L, Capuñay C, et al. Angiografía coronaria no invasiva
por Tomografía Computada Multislice. Rev Arg Radiol 2001;65
(4): 281-286.
Carrascosa
P, Capuñay C, P. Johnson, et al. General Utilities of Multislice
CT in the Cardiac Field. Herz 2003;28:44-51.
Gotsman
M, Mosscri M, Rozenman Y, et al. Atherosclerotic studies by
intracoronary ultrasound. Adv Exp Med Biol 1997:430:197-212.
Schoroeder
S, Kopp A, Meischer C, et al. Non-invasive detection and evaluation
of the atherosclerotic coronary plaques with Multislice Computed
Tomography. J Am Coll 2001;37:1430-5.
 TRATAMIENTO
INTERVENCIONISTA DE LAS LESIONES AISLADAS DE LA ARTERIA CORONARIA
DESCENDENTE ANTERIOR PROXIMAL
TRATAMIENTO
INTERVENCIONISTA DE LAS LESIONES AISLADAS DE LA ARTERIA CORONARIA
DESCENDENTE ANTERIOR PROXIMAL
|  |
Autor:
Dr. José
Valencia Martín
Columnista Experto de SIIC
Facultativo especialista
en Cardiología, Sección de Hemodinámica
y Cardiología Intervencionista
Institución:
Hospital General Universitario de
Alicante, Alicante, España |
La estenosis de
la arteria coronaria descendente anterior en su segmento proximal
(Dap) representa un subgrupo de especial riesgo dentro de la
cardiopatía isquémica dado el perfil clínico que representan
estas lesiones tanto en su presentación aislada ( - ) como en
el seno de la enfermedad multivaso ( ). La cantidad y calidad
de miocardio en riesgo que depende de la permeabilidad de la
Dap hace necesario un abordaje terapéutico más agresivo dado
que se ha establecido una mortalidad hasta 19 veces mayor en
pacientes con ausencia de permeabilidad de esta arteria frente
a la población general en un seguimiento prolongado (4), asociado
dicho resultado a una fracción de eyección de ventrículo izquierda
reducida.
El estudio in vivo con ultrasonido de este tipo de lesiones
ha mostrado una afectación predominantemente excéntrica del
vaso (6). Ello explicaría los peores resultados obtenidos tras
angioplastia transluminal percutánea (ACTP) en este tipo de
lesión coronaria debido a un fenómeno predominante de retracción
elástica y en los casos de afectación ostial (7).
Diversos estudios han comparado las diferentes estrategias terapéuticas
existentes (cirugía de revascularización coronaria con arteria
mamaria interna [AMI] o revascularización percutánea frente
al tratamiento médico convencional) para el abordaje de la estenosis
de la Dap objetivándose, en general, mejores resultados tras
tratamiento intervencionista (8,9). Sin embargo, al comparar
las 2 principales técnicas de revascularización (ACTP y cirugía
con AMI) se ha encontrado una mayor incidencia de nuevas revascularizaciones
en el grupo tratado con ACTP, mayor necesidad de uso de fármacos
antianginosos y peor tolerancia al ejercicio, con similares
tasas de reinfarto o mortalidad entre los dos grupos (10-15).
Esta mayor incidencia de nuevas revascularizaciones tras la
ACTP es debida al fenómeno de la reestenosis que tiene lugar
mayoritariamente antes del primer año posACTP (7,16). La incidencia
de reestenosis después de la ACTP aislada varía según las series
entre el 40% y el 66%.
Entre los factores favorecedores de la reestenosis se han descrito
la presencia de lesiones proximales y la afectación de la Da
(17). La irrupción del stent ha modificado claramente
estos resultados en la medida en que ha conseguido reducir casi
a la mitad el riesgo de reestenosis (18,21) con incidencia de
complicaciones inmediatas muy bajas y evolución clínica a corto
y medio plazo muy favorable (superponible a la conseguida con
la cirugía de AMI). Los índices de reestenosis y necesidad de
nueva revascularización con el stent varían según las
series entre el 19% y el 31% (22,23).
En un trabajo presentado por nuestro grupo (24) estudiamos prospectivamente
los resultados inmediatos y la evolución clínica a largo plazo
(hasta 5 años) de 98 pacientes consecutivos con estenosis severa
de la Dap tratados con ACTP asociada a implante electivo de
stent en el periodo comprendido entre abril de 1995
y abril de 1998. Las características clínicas de los pacientes
en el momento de su inclusión en el estudio y las características
anatómicas encontradas en la coronariografía quedan reflejadas
en la tabla 1.
| Tabla
1. Características
basales clínicas y anatómicas del grupo en estudio.
|
 |
FE, fracción
de eyección.
Ex fumador, abandono del hábito tabáquico al menos
6 meses antes del procedimiento. |
La tasa de éxito del procedimiento
fue muy elevada (98.9%) con un único caso de fracaso del implante
del stent debido al desprendimiento inapropiado del
stent ( stent Palmaz-Schatz montado manualmente
sobre el balón de predilatación) dentro del tronco de la coronaria
izquierda siendo el paciente remitido a cirugía urgente de revascularización
coronaria aunque sin signos agudos de isquemia.
En otros 10 pacientes se produjeron complicaciones menores durante
el procedimiento que, o fueron solucionadas in situ,
o no implicaron repercusión clínica. Durante el seguimiento
(media ± DE: 38 ± 11 meses) no se produjo ninguna pérdida y
fue menor a los 2 años únicamente en 2 pacientes por causa de
su fallecimiento. La evolución del total de los pacientes a
lo largo del estudio queda representada gráficamente en la figura
1.
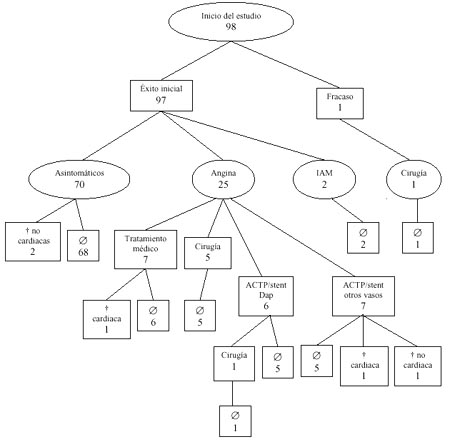
Figura
1. Diagrama de evolución clínica de
los pacientes durante el seguimiento (ø, asintomáticos
al final de l estudio. †, muerte).
A la finalización del estudio,
el 69.4% de los pacientes permanecían asintomáticos y no presentaron
ningún evento cardíaco adverso mayor (ECAM). 12 pacientes requirieron
durante el seguimiento una nueva revascularización del vaso
diana (12.2%), 6 pacientes con cirugía con AMI y los otros 6
con nueva ACTP de la Dap (uno de los pacientes a los que se
realizó nueva ACTP intrastent requirió cirugía de bypass
al presentar nueva reestenosis precoz). Las curvas actuariales
de supervivencia por el método de Kaplan-Meier mostraron que
la probabilidad de permanencia libre de ECAM era del 83.7% y
las probabilidades de ausencia de muerte cardíaca y global alcanzaron
el 98 y 94.8% respectivamente, como puede verse en las figuras
2 y 3.

Figura
2. Curva de Kaplan-Meier de supervivencia
libre de eventos cardiacos mayores.

Figura
3. Curvas de Kaplan-Meier de supervivencia libre de muerte
global y libre de muerte de origen cardiaco.
Las únicas variables que predijeron
una peor evolución clínica tras el análisis multivariado fueron
la utilización de 2 stents en el procedimiento (hazard
ratio [HR] = 3.8; intervalo de confianza del 95% [IC 95%],
1.2-12.1; p = 0.021) y la asociación hipertensión-diabetes-dislipemia
en un mismo paciente (HR = 3.7; IC 95%, 1.3-10.3; p = 0.011).
La localización ostial de la lesión mostró una tendencia clara
hacia una peor evolución, aunque sin alcanzar significación
estadística (HR = 3.7; IC 95%, 0.8-16.6; p = 0.09). Con nuestros
datos hemos comprobado que la necesidad de nueva revascularización
de la Dap llega hasta los 2 años y medio del procedimiento,
si bien la mayor parte de las reintervenciones se produjo en
los primeros 12 meses tras el implante del stent (66.6%
de los casos). Mostramos una incidencia de nuevas revascularizaciones
de la Dap de 12.2%, aunque la incidencia real de reestenosis
significativa y la precocidad en su aparición en nuestra serie
es desconocida al no haberse realizado de forma sistemática
evaluación angiográfica a todos los pacientes. Otra limitación
importante de nuestro trabajo es la de no tratarse de un estudio
aleatorizado por lo que hay que ser cauto a la hora de establecer
análisis comparativos con otras estrategias revascularizadoras.
Con los resultados que presentamos en este trabajo se confirma
la seguridad de la implantación del stent en las lesiones
que afectan a la Dap y la buena respuesta clínica a largo plazo,
llegando en algunos pacientes a 5 años de seguimiento.
Cabe esperar una mejoría de dichos resultados con los nuevos
materiales de ACTP y diseños de stents que continuamente
se están poniendo al alcance del cardiólogo intervencionista.
Las cifras de supervivencia y de permanencia libre de ECAM obtenidas
concuerdan con estudios previos sobre el uso de stent
en la Dap (25) y es comparable a la que aparece en otros estudios
donde se realizó cirugía de revascularización coronaria con
AMI (10,26).
Recientemente se ha producido el desarrollo de la técnica de
cirugía coronaria con injerto de AMI mínimamente invasiva y
sin asistencia circulatoria extracorpórea (o fuera de bomba).
Esta técnica quirúrgica ha permitido evitar las complicaciones
asociadas a la entrada en bomba de circulación extracorpórea
de la cirugía coronaria convencional (27). Además, dicho procedimiento
se realiza a través de pequeñas incisiones en el tórax que permiten
actuar sobre el corazón mientras late, lo que también evita
los problemas asociados con la esternotomía media. Estas circunstancias,
en principio resueltas por la cirugía mínimamente invasiva,
hacían generalmente proponer la estrategia percutánea como de
primera elección en casos con anatomía favorable para la ACTP.
Los resultados mostrados por 2 estudios recientemente publicados
(28,29) que comparaban la cirugía mínimamente invasiva con el
stent en el tratamiento de las estenosis aisladas de
la Dap mostraban reducción significativa de la necesidad de
nuevas revascularizaciones y menor necesidad de medicación antianginosa
en el grupo tratado con cirugía. No hubo, por el contrario,
diferencias en términos de mortalidad o infarto entre los 2
grupos. Dados estos resultados cabría suponer que dicha técnica
quirúrgica, al reducir considerablemente la invasividad y comorbilidad
asociadas con la técnica quirúrgica tradicional, se habría convertido
en el tratamiento de primera elección de las estenosis aisladas
de la Dap, si bien es necesaria formular una serie de puntualizaciones
muy importantes que pueden hacer cambiar este criterio (30).
Primero, la dificultad técnica de este tipo de cirugía hace
que la habilidad o capacitación del equipo quirúrgico influya
en gran medida en los resultados obtenidos (hecho de menor trascendencia
en el caso del stent por la menor complejidad técnica
y estandarización del procedimiento); segundo, en esos estudios
no se emplearon los antagonistas de los receptores plaquetarios
IIb/IIIa que han demostrado beneficios en términos de reducción
de reinfarto y mortalidad en pacientes con lesiones complejas
como las aquí tratadas (31); tercero, y último, se utilizaron
stents convencionales y no los stents recubiertos
de fármacos antiproliferativos de última generación que han
demostrado recientemente su clara superioridad sobre los primeros,
reduciendo drásticamente las tasas de reestenosis y nuevas revascularizaciones
(32), tratándose de ésta la única ventaja real mostrada hasta
ahora por la cirugía frente al stent.
Nuestro grupo está realizando actualmente un estudio sobre
el resultado a corto y medio plazo de los stents recubiertos
de rapamicina en el tratamiento de lesiones coronarias complejas,
entre ellas la afectación de la Dap, con un seguimiento angiográfico
y clínico a los 6 meses. Se ha incluido un total de 92 pacientes
con afectación de la Dap, de los cuales 68 han completado el
seguimiento clínico y 63 el angiográfico (5 pacientes, que no
presentaron ningún ECAM en el seguimiento, rechazaron la revisión
angiográfica). Los resultados provisionales muestran incidencia
de reestenosis binaria de 6.3% (4 casos) entre los pacientes
revaluados con coronariografía, tasa de nuevas revascularizaciones
de la lesión diana de 4.4% (3 pacientes) y supervivencia global
a los 6 meses de 100%, hechos que avalan nuestro criterio de
considerar el tratamiento intervencionista percutáneo con stents
recubiertos de fármacos antiproliferativos como la primera
elección terapéutica o patrón oro de esta entidad clínica.
En la práctica clínica (33) los cardiólogos disponemos de 2
estrategias terapéuticas sumamente eficaces para el tratamiento
de la enfermedad de la Dap: la cirugía coronaria con AMI (convencional
o mínimamente invasiva) y el stent. La decisión de optar
por una u otra debería realizarse de manera individual, teniendo
en cuenta la opinión del paciente tras habérsele informado correctamente
sobre ambas alternativas terapéuticas, sobre sus resultados
y sobre sus riesgos, y considerando la alternativa percutánea
como de primera elección en aquellos casos con anatomía favorable
y en pacientes en los que en el futuro sea previsible la realización
de nuevas revascularizaciones (por ejemplo, pacientes jóvenes).
BIBLIOGRAFIA
- Califf RM,
Tomabechi Y, Lee KL, Phillips H, Pryor DB, Harrell FE Jr,
et al. Outcome in one-vessel coronary artery disease. Circulation
1983; 67: 283-290.
- Klein LW,
Weintraub WS, Agarwal JB, Scheneider RM, Seelaus PA, Katz
RI, et al. Prognostic significance of severe narrowing of
the proximal portion of the left anterior descending coronary
artery. Am J Cardiol 1986; 58: 42-46.
- Califf RM,
Tomabechi Y, Lee KL, Phillips H, Prior DB, Harrell FE, et
al. Outcome in one-vessel coronary artery disease. Circulation
1983; 67(2): 283-290.
- Varnauskas
E, and the European Coronary Surgery Study Group. Twelve-year
follow-up of survival in the randomized European Coronary
Surgery Study. N Eng J Med 1988; 319: 332-337.
- Van Lierde
J, Piessens J, Glazier JJ, Vrolix M, De Gest H, Willems JL.
Long-term prognosis of male patients with an isolated chronic
occlusion of the left anterior descending coronary artery.
Am Heart J 1991; 122(6): 1542-1547.
- Kimura BJ,
Russo RJ, Bhargava V, McDaniel MB, Peterson KL, DeMaría AN.
Atheroma Morphology and distribution in proximal left anterior
descending coronary artery: in vivo observations. J Am Coll
Cardiol 1996; 27: 825-831.
- Ten Berg
JM, Gin MT, Ernst SM, Kelder JC, Suttorp MJ, Mast EG, et al.
Ten-year follow-up of percutaneous transluminal coronary angioplasty
for proximal left anterior descending coronary artery stenosis
in 351 patients. J Am Coll Cardiol 1996; 28(1): 82-88.
- Hueb WA,
Bellotti G, Almeida de Oliveira S, Arie S, Piva de Alburquerque
C, Jatene AD, et al. The Medicine, Angipoplasty or Surgery
Study (MASS): A Prospective, Randomized Trial of Medical Therapy,
Ballon Angioplasty or Bypass Surgery for Single Proximal Left
Anterior Descending Artery Stenoses. J Am Coll Cardiol 1995;
26: 1600-1605.
- Parisi AF,
Folland ED, Hartigan P. A comparison of angioplasty with medical
therapy in the treatment of single-vessel coronary artery
disease. N Eng J Med 1992; 326: 10-16.
- Goy JJ,
Eeckhout E, Burnand B, Vogt P, Stauffer JC, Hurni M, et al.
Coronary angioplasty versus left internal mammary artery grafting
for isolated proximal left anterior descending artery stenosis.
Lancet 1994; 343: 1449-53.
- Jones RH,
Kesler K, Phillips HR, Mark DB, Smith PK, Nelson CL et al.
Long-term survival benefits of coronary artery bypass grafting
and percutaneous transluminal angioplasty in patients with
coronary artery disease. J Thorac Cardiovasc Surg 1996; 11:
1013-25.
- Cequier
A, Esplugas E, Pomar JL, Saura E. Angioplastia frente a cirugía
en estenosis proximales de la arteria descendente anterior.
Rev Esp Cardiol 1998; 51[Supl 3]: 67-70.
- O´Keefe
JH, Kreamer TR, Jones PG, Vacek JLO, Gorton ME, Muehlebach
GF, et al. Isolated left anterior descending coronary artery
disease. Percutaneous transluminal coronary angioplasty versus
stenting versus left internal mammary artery bypass grafting.
Circulation 1999; 100[suppl II]: II-114-II-118.
- Goy JJ,
Eeckhout E, Moret C, Burnand B, Vogt P, Stauffer JC, et al.
Five-year outcome in patients with isolated proximal left
anterior descending coronary artery stenosis treated by angioplasty
or left internal mammary artery grafting. A prospective trial.
Circulation 1999; 99: 3255-3259.
- Greenbaum
AB, Califf RM, Jones RH, Gardner LH, Phillips HR, Sketch MH,
et al. Comparison of medicine alone, coronary angioplasty,
and left internal mammary artery-coronary artery bypass for
one-vessel proximal left anterior descending coronary artery
disease. Am J Cardiol 2000; 86: 1322-1326.
- King SB,
Kowsisnski AS, Guyton RA, Lembo NJ, Weintraub WS. Eight-year
mortality in the Emory angioplasty versus surgery trial. J
Am Coll Cardiol 2000; 35: 1116-21.
- Popma JJ,
Kuntz RE. Percutaneous coronary and valvular intervention.
In "Heart Disease: a textbook of Cardiovascular Medicine".
Edited by Braunwald E, Zypes DP, Libby P. 6th edition 2001;
chapter 38: 1365.
- De Cesare
NB, Bartorelli AL, Galli S, Loaldi A, Fabbiochi F, Sganzerla
P, et al. Treatment of ostial lesions of the left anterior
coronary artery with Palmaz-Schatz coronary stent. Am Heart
J 1996; 132: 716-20.
- Versaci
F, Gaspardone A, Tomai F, Crea F, Chiariello L, Gioffre PA.
A comparison of coronary stenting with angioplasty for isolated
stenosis of the proximal left anterior descending coronary
artery. N Eng J Med 1997; 336: 817-22.
- Philips
PS, Segovia J, Alfonso F, Goicolea J, Hernández R, Banuelos
C, et al. Advantage of stents in the most proximal left anterior
descending coronary artery. Am Heart J 1998; 135: 719-25.
- Marcos-Alberca
P, Iñiguez A, Navarro F, Serrano JM, Ibargollín R, García
R, et al. Evolución clínica y angiográfica de las lesiones
dilatadas en el segmento proximal de la arteria coronaria
descendente anterior: stent frente a balón. Rev Esp Cardiol
1999; 52: 181-188.
- Goy JJ,
Kauffmann U, Goy-Eggenberger D, Garachemani A, Hurni M, Carrel
T, et al. A prospective randomised trial comparing stenting
to internal mammary artery grafting for proximal , isolated
de novo left anterior coronary artery stenosis: the SIMA trial.
Stenting vs Internal Mammary Artery. Mayo Clin Proc 2000;
75: 1113-1115.
- Goy JJ,
Kauffmann U, Goy-Eggenberger D, Garachemani A, Hurni M, Carrel
T, et al. A prospective randomised trial comparing stenting
to internal mammary artery grafting for proximal , isolated
de novo left anterior coronary artery stenosis: the SIMA trial.
Stenting vs Internal Mammary Artery. Mayo Clin Proc 2000;
75: 1113-1115.
- Valencia
J, Bordes P, Berenguer A, Mainar V, Ruiz-Nodar JM, Arrarte
V. Seguimiento a largo plazo de pacientes con estenosis de
la arteria coronaria descendente anterior proximal tratadas
con stent. Rev Esp Cardiol 2002; 55(6): 607-615.
- Park SJ,
Lee CW, Hong MK, Kim JJ, Park SW. Stent placement for ostial
left anterior descending coronary artery stenosis: acute and
long-term (2 years) results. Catheter Cardiovasc Interv 2000;
49 (3): 272-273.
- Hueb WA,
Soares PR, Almeida de Oliveira S, Arie S, Cardoso RH, Wajsbrot
DB, et al. Five-year follow-up of the Medicine, Angioplasty,
or Surgery Study (MASS). A prospective, randomized trial of
medical therapy, ballon angioplasty, or bypass surgery for
single proximal left anterior descending coronary artery stenosis.
Circulation 1999; 100[suppl II]: II-107-II-113.
- Rose EA.
Off-pump coronary-artery bypass surgery. N Eng J Med 2002;
347: 551-552.
- Drenth D,
Veeger N, Winter JB, Grandjean JG, Mariani MA, van Boven AJN,
et al. A prospective randomized trial comparing stenting with
off-pump coronary surgery for high-grade stenosis in the proximal
left anterior descending coronary artery: three-year follow-up.
J Am Coll Cardiol 2002; 40: 1955-1960.
- Diegeler
A, Thiele H, Falk V, Hambrecht R, Spyrantis N, Sick P, et
al. Comparison of stenting with minimally invasive bypass
surgery for stenosis of the left anterior descending coronary
artery. N Eng J Med 2002; 347: 561-566.
- Valencia
J. Off-pump surgery may have some long-term benefits over
percutaneous coronary angiolasty with stenting in proximal
left anterior descending coronary artery disease. Evidence-based
Cardiovascular Medicine 2003; 7: 78-80.
- Topol EJ,
Mark DB, Lincoff AM, Cohen E, Burton J, Kleiman N, et al.
Outcomes at 1 year and economic implication of platelet glycoprotein
IIb/IIIa blockade in patients undergoing coronary stenting:
results from a multicentre randomised trial. Lancet 1999;
354: 2019-2024.
- Morice MC,
Serruys PW, Sousa JE, Fajadet J, Ban Hayashi E, Perin M, et
al. A randomized comparison of a sirolimus-eluting stent with
a standard stent for coronary revascularization. N Eng J Med
2002; 346: 1773-1780.
- Esplugas
E, Alfonso F, Alonso JJ, Asín E, Elizaga J, Íñiguez A, et
al. Guías de práctica clínica de la Sociedad Española de Cardiología
en cardiología intervensionista: angioplastia coronaria y
otras técnicas. Rev Esp Cardiol 2000; 53: 218-240.
|



