Angioplastia primaria: ¿por qué está subutilizada?
La angioplastia primaria (AP) es el tratamiento más eficaz del infarto agudo de
miocardio (IAM).1-4 Recientemente se publicó un metaanálisis de 23
estudios con 7 739 pacientes con IAM, aleatorizados a tratamiento con AP o
trombólisis, en el cual la mortalidad por AP fue significativamente inferior a la
debida a trombólisis (7% vs. 9%).5 Los beneficios de la AP
sobre la mortalidad en el IAM son debidos fundamentalmente a tres motivos:
- Recanalización coronaria más efectiva. La obtención de una recanalización de la
arteria responsable del infarto en una mayor proporción de pacientes reduce la
mortalidad por shock cardiogénico. Por otra parte, la recanalización del
vaso responsable en un mayor porcentaje de pacientes probablemente explica la
menor incidencia de complicaciones mecánicas en los pacientes tratados con
AP.6
- Disminución de la tasa de isquemia recurrente. La tasa de reinfarto y
angina posinfarto es significativamente inferior con AP que con el tratamiento
trombolítico.
- Reducción de la incidencia de hemorragia intracraneal.
Los dos beneficios anteriormente señalados se logran además con una reducción
drástica de la tasa de hemorragia intracraneal.
Sin embargo, a pesar de estos beneficios clínicos, la AP está subutilizada. Según los
datos de la Sección de Hemodinámica y Cardiología Intervencionista de la Sociedad
Española de Cardiología, durante 2001 se realizaron en España 3 845
procedimientos intervencionistas en el contexto de IAM, de los cuales 2 297 fueron
procedimientos como primera estrategia de reperfusión (AP).7
Aunque esta cifra puede parecer elevada, se estiman anualmente en nuestro país
unos 41 000 pacientes con diagnóstico de IAM. Aun si se considera que la mitad de
esos pacientes pudieran no ser candidatos a estrategias de
reperfusión,8,9 puede estimarse que menos del 10% de los
pacientes con IAM y candidatos a estrategias de perfusión son tratados mediante
AP en nuestro país. Además, pocos centros realizan un número elevado de
procedimientos intervencionistas en nuestro país, siendo sólo 10 los centros en
donde se realizaron más de 100 procedimientos en el contexto de IAM en
2001.7 La razón fundamental para la subutilización de la AP es la
necesidad de establecer una infraestructura adecuada, no sólo con laboratorio de
hemodinámica, sino sobre todo la disponibilidad de personal entrenado las 24 horas
del día.
Por tanto, en la mayoría de los centros, no existe la posibilidad de realizar AP como
tratamiento de reperfusión, dado que la mayor parte de los pacientes ingresan en
centros sin programa de AP. Por dicho motivo, son diversas las estrategias que se
barajan en la actualidad con el objeto de mejorar la eficacia de las estrategias de
reperfusión en el IAM en la mayor proporción posible de pacientes. Por una parte,
son muchos los estudios realizados en los últimos años que trataron de incrementar
la eficacia de la trombólisis con nuevos fármacos trombolíticos o en combinación
con inhibidores de las glucoproteínas IIb/IIIa, pero la tasa de flujo TIMI 3 y la tasa
de recanalización (flujo TIMI 2 o 3) de la arteria siguen siendo inferiores a las
logradas mediante AP; además, el riesgo de complicaciones hemorrágicas grasves
es superior.10-12 En segundo lugar, se propuso también
incrementar la utilización de trombólisis prehospitalaria. En ese sentido, el estudio
CAPTIM (Comparison of Angioplasty and Prehospital Thrombolysis in Acute
Myocardial Infarction) comparó la trombólisis prehospitalaria con la AP.
Aunque la incidencia de eventos fue inferior en el grupo asignado a AP (6.2%
vs. 8.2%), las diferencias no fueron significativas, por lo que la conclusión
de este estudio fue que la AP no es mejor que la trombólisis
prehospitalaria.13 Sin embargo, se debe tener en cuenta que en ese
estudio los pacientes fueron trasladados inmediatamente a centros que disponían
de los medios para realizar intervencionismo coronario percutáneo urgente y que,
de hecho, al 26% de los pacientes tratados con trombólisis se les realizó además
angioplastia de rescate. Por último, incrementar el número de centros con
capacidad para realizar AP, aunque en algunas zonas geográficas podría ser
necesario, no parece ser la solución a la subutilización de la AP, dado que existe
una relación directa entre los resultados del procedimiento y el volumen de
procedimientos realizados en el contexto del IAM. En un estudio retrospectivo que
incluyó 62 299 pacientes con IAM tratados con trombólisis o mediante AP en 446
centros, se observó que la AP mejora el pronóstico en comparación con la
trombólisis sólo en los centros con una cantidad intermedia o alta de AP, pero no en
centros con escasas AP.14 Probablemente, por tanto, más que
incrementar el número de centros con sala de hemodinámica, probablemente sea
mejor optimizar la utilización de los centros ya existentes.
¿Puede justificarse el traslado de los pacientes con infarto para la realización
de angioplastia primaria?
Si se tienen en cuenta las limitaciones de estas estrategias en el tratamiento
de los pacientes con IAM que ingresan en centros sin AP, surge la siguiente
pregunta: dado que la AP mejora el pronóstico de los pacientes con IAM en
comparación con el tratamiento trombolítico ¿vale la pena trasladar al paciente a un
centro que disponga de AP? Teóricamente, podrían existir dos inconvenientes:
trasladar al paciente a otro centro conlleva obviamente un retraso en el inicio del
tratamiento; durante el traslado pueden producirse complicaciones graves que
pongan en entredicho la seguridad del traslado. En cuanto al primer hecho, existe
una consideración importante: en los pacientes con IAM tratados con trombólisis
existe una relación directa entre el tiempo de evolución de los síntomas y la
mortalidad;15 sin embargo, en los pacientes tratados mediante AP
esta relación no está tan clara, al menos en aquellos que no se encuentran en
shock cardiogénico.16 En un metaanálisis que incluyó 10
estudios aleatorizados (2 635 pacientes) a AP y trombólisis, se mostró cómo las
ventajas de la AP se hacen más evidentes en los pacientes con más tiempo de
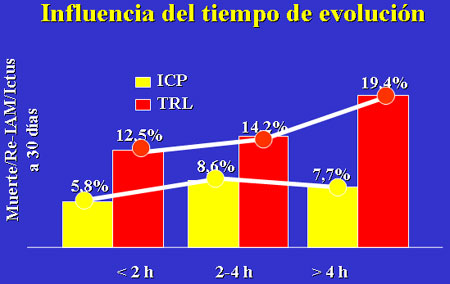
evolución de los síntomas.17 En los pacientes con menos de 2 horas
de evolución la mortalidad fue 5.8% con AP y 12.5% con trombólisis; con un
tiempo de evolución de los síntomas de 2 a 4 horas, la mortalidad fue 8.6% y
14.2%, respectivamente, y con más de 4 horas, 7.7% y 19.4%, respectivamente
(figura 1). Por tanto, el retraso que supondría trasladar un paciente a otro centro
para realizarle AP probablemente no parece conllevar un peor resultado de la AP ni
mayor mortalidad.18,19 En segundo lugar, algunas series mostraron
que el traslado a otro centro para tratamiento con AP es seguro, siempre que –
lógicamente– el medio de transporte esté dotado del personal y el material
necesarios para tratar las complicaciones que puedan surgir, fundamentalmente
arritmias graves. El traslado de pacientes con IAM a otro centro para la realización
de AP conlleva un riesgo muy bajo, con una mortalidad durante el traslado inferior
al 0.5%.20,21
Estas consideraciones sirvieron de base para la realización de varios estudios con
pacientes con IAM que ingresan en centros sin AP que han sido aleatorizados a
tratamiento trombolítico o a ser derivados a un centro que disponga de AP. En
estos estudios, como se describe a continuación, derivar los pacientes con IAM a
centros con AP se asocia con una mejoría en el pronóstico.
Estudios aleatorizados que comparan AP y trombólisis en centros sin
AP
Existen 5 estudios que compararon el tratamiento trombolítico con el traslado
a centros que dispongan de AP en pacientes que acuden inicialmente a centros sin
AP: el estudio de Limburg, el PRAGUE 1 (Primary angioplasty in patients
transferred from general community hospitals to specialized PTCA units with or
without emergency thrombolysis 1), el PRAGUE-2, el DANAMI 2 (Danish
Multicentre Randomized Trial on Thrombolytic Therapy versus Acute Coronary
Angioplasty in Acute Myocardial Infarction 2) y el Air-PAMI (Air Primary
Angioplasty in Myocardial Infarction).22-26
Limburg es una pequeña provincia situada al sur de Holanda, con una superficie de
2 422 km2 y 1 136 199 habitantes. Vermeer y col. asignaron de
forma aleatoria 224 pacientes con IAM que ingresaron en 5 centros sin AP a una de
las siguientes tres estrategias: tratamiento trombolítico en el centro de ingreso (n
= 75); traslado inmediato a un centro con AP pero administrando tratamiento
trombolítico durante el traslado (n = 74), y traslado inmediato a un centro con AP
(Maastrich) (n = 75).22 Los centros secundarios se encontraban a
una distancia entre 25 y 50 km de Maastrich, el tiempo medio de transporte fue de
20 minutos, y el tiempo medio desde la aleatorización hasta el cateterismo fue 85
minutos. El parámetro primario de valoración del estudio fue la seguridad del
traslado, durante el cual ningún paciente falleció; la incidencia de fibrilación
ventricular o taquicardia ventricular que requiriera cardioversión fue de 1.6% y
ningún paciente requirió intubación. Los parámetros secundarios fueron la
combinación de muerte o reinfarto (16%, 14% y 8% en los 3 grupos,
respectivamente), la mortalidad (5%, 6% y 5%, respectivamente), el riesgo de
infarto (7%, 4% y 1%, respectivamente) y la tasa de hemorragia intracraneal (1%,
2% y 0%) (diferencias no significativas).
El estudio PRAGUE 1 se realizó en Checoslovaquia. El diseño del estudio es similar
al del estudio de Limburg, con tres grupos de pacientes asignados aleatoriamente:
tratamiento trombolítico en el centro de ingreso (n = 99); traslado inmediato a un
centro con AP pero administrando tratamiento trombolítico durante el traslado (n =
100), y traslado inmediato a un centro con AP (n = 101).23 En este
estudio había 17 centros secundarios y 4 de referencia, la distancia máxima del
traslado fue 75 km. El tiempo medio de traslado fue 35 minutos, y el tiempo desde
la asignación hasta el cateterismo, 80 minutos. Es de señalar que en este estudio el
tiempo medio desde la aleatorización hasta el inicio del traslado fue tan sólo de 17
minutos. En este estudio, la incidencia de muerte, reinfarto o ictus a los 30 días
(parámetro de valoración principal) fue 23%, 15% y 8% (p < 0.02) en los
pacientes asignados a trombólisis, trombólisis y traslado, y traslado para AP,
respectivamente. La mortalidad fue 14%, 12% y 7% (p = NS); y la incicencia de
reinfarto 10%, 7% y 1% (p < 0.03), respectivamente.
El estudio PRAGUE 2 se diseñó con algunas diferencias con respecto al PRAGUE 1
(figura 2). Básicamente, además de incluir mayor número de pacientes (n = 860),
desaparece del diseño el grupo de trombólisis y traslado, y tanto el tiempo de
evolución del IAM como la distancia del traslado son superiores que en el PRAGUE
1.24 El tiempo medio de traslado fue 48 minutos y el tiempo desde
la aleatorización hasta el cateterismo, 94 minutos. Al igual que en el PRAGUE 1, el
tiempo desde la aleatorización hasta el inicio del traslado fue muy corto (20
minutos). El parámetro primario de valoración del estudio fue la mortalidad, que
fue inferior aunque no de forma significativa en el grupo de AP (6.8% vs.
10%). El parámetro combinado de muerte, reinfarto o ictus a los 30 días fue
significativamente menos frecuente en los pacientes tratados mediante AP (8.4%
vs. 15.2%, p = 0.003).

El estudio DANAMI 2 se realizó en Dinamarca.25 Se incluyeron
pacientes con IAM de menos de 12 horas de evolución: pacientes incluidos en
centros con AP (5 centros) que fueron aleatorizados a tratamiento trombolitico o a
AP, y pacientes incluidos en centros sin AP (24 centros) que fueron aleatorizados a
tratamiento con trombólisis o a ser trasladados a un centro con AP. En total se
incluyó el 62% de la población danesa (5.4 millones de habitantes), la distancia de
traslado no fue superior a 152 km y el tiempo de traslado no superó las 3 horas. En
los centros con AP, la incidencia de muerte, reinfarto o ictus incapacitante a los 30
días fue significativamente inferior en los pacientes asignados a AP (6.7% vs.
12.3%, p = 0.048; reducción del 45%), pero el dato importante es que esto
también ocurrió en los pacientes que acudieron a los centros sin AP, en los que el
traslado a un centro con AP se asoció con una incidencia significativamente inferior
del parámetro del estudio (8.5% vs. 14,2%, p = 0.002; reducción del
40%), a pesar del lógico retraso que conlleva el traslado del paciente.
Por último, el Air-PAMI tuvo dos diferencias con los estudios previos: la inclusión
específica de pacientes de alto riesgo (al menos un criterio de los siguientes: edad
> 70 años, Killip 2-3, frecuencia cardíaca > 100 latidos por minuto, presión arterial
sistólica < 100 mmHg, localización anterior y presencia de bloqueo de rama
izquierda) y la inclusión de helicópteros como medio de transporte, que se utilizó en
el 21% de los traslados. Sin embargo, este estudio fue interrumpido precozmente,
de tal forma que sólo se incluyerin 138 pacientes.26 El tiempo medio
desde la aleatorización hasta el inicio del traslado, el tiempo de transporte y el
tiempo desde la llegada al centro con AP hasta el inicio del cateterismo fueron 43,
26 y 27 minutos, respectivamente. Básicamente, la tasa de eventos cardíacos
importantes a 30 días fue inferior en los pacientes trasladados para realización de
AP (8.4% vs. 13.6%); esto representa una reducción en la tasa de
eventos del 38%. Sin embargo, estas diferencias no fueron significativas (p =
0.331), pues hubiera sido necesario incluir 430 pacientes para detectar una
reducción del 40% en la tasa de eventos, y el estudio fue interrumpido, como ya se
señaló. Los pacientes tratados con AP tuvieron menor estadía hospitalaria (6.1
± 4.3 vs. 7.5 ± 4.3 días, p = 0.015) y una menor tasa de
isquemia (12.7% vs. 31.8%, p = 0.007).
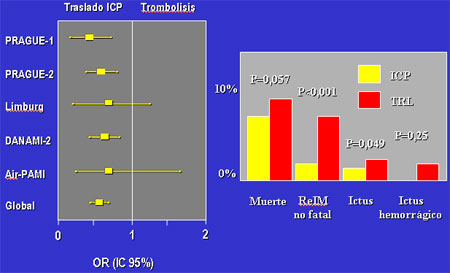
Teniendo en cuenta los resultados de estos estudios, y a falta de la publicación de
los resultados definitivos del DANAMI 2, se aleatorizaron 2 641 pacientes a AP en
otro centro o a tratamiento trombolítico en el centro al que acudieron inicialmente
(2 815 si se incluyen los del grupo trombólisis con traslado para AP de los estudios
PRAGUE 1 y Limburg). El resultado del análisis conjunto de todos estos pacientes
muestra que a pesar de que trasladar al paciente a otro centro produce un retraso
en el inicio del tratamiento, el traslado para ser tratado mediante AP se asocia con
mejoría en el pronóstico, con reducción de la incidencia de muerte, reinfarto o ictus
(figura 3).
Limitaciones y potenciales problemas con la angioplastia primaria y el
traslado
A pesar de que en los estudios aleatorizados el traslado del paciente con IAM
a un centro con programa de AP produce un beneficio clínico, pueden existir
algunas dudas o preguntas sobre esta estrategia.
¿Es seguro el traslado del paciente?
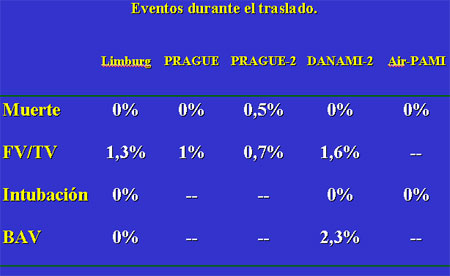
La primera pregunta que surge, sin duda, es qué riesgo tiene el traslado del
paciente. En este sentido, la mortalidad durante el traslado fue inferior al 0.5% en
los estudios aleatorizados (0.5% en el PRAGUE 1 y 0 en los otros).22-
26 Estos datos deben interpretarse, sin embargo, teniendo en cuenta varios
hechos. En primer lugar, la mayor parte de los pacientes en shock
cardiogénico fueron excluidos del estudio. En segundo lugar, algunos pacientes
no fueron trasladados luego de la aleatorización debido a deterioro hemodinámico
antes de que se iniciara el transporte (1% de los pacientes del PRAGUE 2, por
ejemplo). En cualquier caso, fuera de los estudios aleatorizados el traslado de
pacientes con IAM a otro centro para la realización de AP se asocia con mortalidad
inferior al 0.5% durante el traslado.20,21
Las complicaciones que pueden surgir con cierta frecuencia durante el traslado son:
fibrilación ventricular o taquicardia ventricular que requiera cardioversión eléctrica
(0.7% a 1.6%), bloqueo auriculoventricular de segundo o tercer grado y necesidad
de intubación orotraqueal (figura 4). Por lo tanto es imprescindible que el traslado
se realice contando con los medios materiales (desfibrilador, etc.) y humanos
(personal médico y paramédico entrenado) necesarios para tratar correctamente
las complicaciones, fundamentalmente de tipo arrítmico, que puedan surgir durante
el transporte.
Problemas logísticos
Para establecer un sistema que permita el traslado de pacientes con IAM (o al
menos algunos subgrupos) a centros que realizan AP, deben solucionarse algunos
problemas logísticos que permitan organizar la infraestructura necesaria. Por una
parte, probablemente el aspecto más importante y también el más difícil sea la
disponibilidad de un sistema de ambulancia con la coordinación suficiente con el
centro que remite al paciente como para que el transporte se inicie idealmente en
menos de 30 minutos desde que se toma la decisión de trasladarlo. Se considera
que para trasladar un enfermo con IAM a otro centro para realizarle una AP como
alternativa al tratamiento trombolítico debe cumplirse la regla de los 30 minutos,
según la cual se recomienda que sean inferiores los siguientes tiempos a 30
minutos: desde que se toma la decisión de trasladar al paciente hasta que se inicia
el traslado; la duración del traslado; desde que el paciente llega al centro con AP
hasta que se inicia el procedimiento, y desde que se contacta con el equipo de
hemodinámica de alerta hasta que dicho personal llega al hospital.
Un ejemplo de la importancia que tiene la coordinación entre los dos centros, el
equipo de hemodinámica de alerta y el sistema de transporte son algunos datos del
estudio DANAMI 2. En este estudio, como ya se comentó, los pacientes que
ingresaron ya inicialmente en los centros con AP también fueron aleatorizados a
tratamiento con AP o con trombólisis. Pues bien, el tiempo desde la aleatorización
hasta el inicio del procedimiento fue sólo unos minutos superior en los pacientes
que tuvieron que ser trasladados que en aquellos en los que la AP se realizó en el
centro en el que ingresaron inicialmente y por tanto no tuvieron que ser
trasladados. Probablemente, mientras se iniciaba el traslado ya se ponía en marcha
hacia el hospital el equipo de hemodinámica, solapándose por tanto estos tiempos.
Un aspecto práctico importante es que una vez que el paciente trasladado llega al
centro con AP sea transportado directamente hacia la sala de hemodinámica por el
equipo que lo transportó, sin que se pierda tiempo en el servicio de urgencias o la
unidad de cuidados intensivos cardiológicos.
Otro problema logístico es dónde ingresar al paciente una vez realizada la AP. Una
posibilidad es ingresar el paciente durante 24 horas en el centro que realiza la AP si
existen camas disponibles en la unidad de cuidados intensivos cardiológicos, y
devolver al paciente al centro de origen una vez finalizado el procedimiento si no
hay disponibilidad de cama donde se realiza la AP. En cualquier caso, la solución a
este problema debe particularizarse para cada centro en concreto y deberá ser
flexible para adecuarse a cada circunstancia.
¿Influye el tiempo de evolución de los síntomas en el beneficio de trasladar al
paciente?
Como ya se comentó, la mortalidad de pacientes con IAM tratados con trombolíticos
se encuentra directamente relacionada con el tiempo de evolución de los síntomas,
de tal forma que el mayor beneficio de este tratamiento se obtiene en las primeras
horas de evolución del IAM.15 En cambio, cuando los pacientes son
tratados mediante AP esta relación entre mortalidad y tiempo de evolución no es
tan clara, al menos si se excluyen los pacientes que se encuentran en shock
cardiogénico.16 Por ello parece lógico que sean los pacientes
con mayor tiempo de evolución de sus síntomas los que reciban mayor beneficio de
ser trasladados a otro centro para someterse a AP; sin embargo, existen
discrepancias en este sentido entre los datos del PRAGUE 2 y del DANAMI 2.
Un objetivo secundario del PRAGUE 2 fue evaluar la influencia del tiempo de
evolución de los síntomas sobre el beneficio de trasladar al paciente a otro centro
para realizarle AP. Si bien las diferencias en la mortalidad no fueron
estadísticamente significativas en el conjunto de la población de estudio (10%
vs. 6.8% en el grupo de trombólisis y AP, respectivamente, p = 0.12), en
los pacientes con más de 3 horas de evolución de los síntomas sí se obtuvo
reducción significativa en la mortalidad (15.3% vs. 6.0%, p < 0.02). Por el
contrario, en los pacientes con tiempo de evolución de 3 horas o inferior, la
mortalidad con ambos tratamientos fue similar (7.4% vs. 7.3%,
respectivamente).27
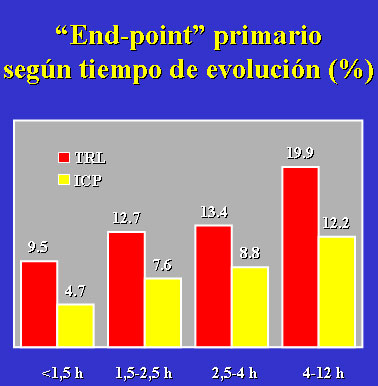
Por el contrario, según los datos del DANAMI 2, el beneficio de trasladar al paciente
a otro centro para la realización de AP parece ser independiente del tiempo de
evolución, obteniéndose una reducción del parámetro primario de valoración
(muerte, reinfarto o ictus) incluso en los pacientes con un tiempo inferior a 1.5
horas (figura 5). En cualquier caso, a la espera de la publicación de los datos
definitivos del DANAMI 2 parece razonable considerar trasladar al paciente a un
centro con AP si tiene un tiempo de evolución de los síntomas superior a 3 horas, y
en el resto de los pacientes, sólo si existen contraindicaciones para tratamiento
trombolítico. Es posible que parte del beneficio de la AP en el DANAMI 2 que se
observó en los pacientes con poco tiempo de evolución del IAM sea deba a una
subutilización de procedimientos invasivos en los pacientes asignados a
trombólisis.
Cómo influye el tiempo de traslado
Realmente, el tiempo de traslado constituye sólo un período de los 3 que
contribuyen al tiempo total desde que se decide trasladar el paciente hasta que se
inicia el cateterismo (figura 6). Estos tiempos son:

Tiempo desde que se decide realizar el traslado hasta que éste se inicia.
Este lapso idealmente también debe ser inferior a 30 minutos, aunque en
algunos estudios (DANAMI 2 y Air-PAMI) fue superior.22-26 El hecho
que sin duda condiciona más este tiempo es la coordinación con el medio de
transporte (habitualmente ambulancia) y su disponibilidad.
Tiempo de traslado. Idealmente, la duración del transporte debe ser
inferior a 30 minutos. En los estudios comentados, varió desde 20 minutos en el
Limburg hasta 48 en el PRAGUE 2, tiempos que fueron proporcionales a la distancia
entre un centro y otro (< 50 km en el Limburg y < 120 km en el PRAGUE 2; la
distancia fue <160 km en el DANAMI 2)22-26 (figura 3). Un hecho
importante es que estas diferencias de distancia y de tiempo de traslado entre unos
estudios y otros no se tradujeron en diferencias sobre el beneficio de la AP. Esto
probablemente se debe a que una diferencia en el tiempo de traslado de 15 a 20
minutos entre unos estudios y otros no tiene una repercusión importante en la
evolución de los pacientes con IAM tratados con AP. Sin embargo, sí parece lógico
que exista una relación entre la duración del traslado y el pronóstico. Con los datos
del PRAGUE 1, por ejemplo, se realizó un análisis para conocer la relación entre el
tiempo de traslado y la mortalidad, y se vio que los pacientes para los que el
traslado duró más de 30 minutos (n = 113) tuvieron mayor mortalidad que aquellos
en los que este tiempo fue inferior a 30 minutos (n = 88) (13% vs. 4%).
Aunque puede haber un sesgo en estos datos, en el sentido de que es posible que
entre los pacientes más inestables (y por tanto con mayor mortalidad) se produjera
algún retraso durante el traslado para instaurar algún tratamiento (cardioversión,
etc.), parece sensato considerar que el tiempo del traslado debe ser inferior a 30
minutos.
Tiempo desde que el paciente llega al centro de referencia hasta que se inicia el
cateterismo. En este período de tiempo son importantes tanto la coordinación
con el personal de alerta de hemodinámica y la optimización del traslado dentro del
centro una vez que el paciente llega al hospital. Con respecto a esto último, lo ideal
es que el paciente sea trasladado directamente a la sala de hemodinámica por el
personal que realiza el transporte, sin que por tanto se produzcan retrasos
innecesarios en el servicio de urgencias o en la unidad de cuidados intensivos
coronarios.
Sobre el segundo período de tiempo (duración del transporte), probablemente la
reducción que se pueda lograr sea escasa, dado que el factor más importante es la
distancia entre un centro y otro. Sin embargo, sobre los otros dos se puede obtener
una reducción, fundamentalmente si se consigue una buena coordinación y
disponibilidad con el sistema de ambulancias y con el sistema de alerta de
hemodinámica. Un dato relevante en este sentido es que, en el estudio DANAMI 2,
el tiempo desde la aleatorización hasta la realización del cateterismo fue sólo muy
ligeramente superior en los pacientes que fueron trasladados a otro centro para la
realización del procedimiento que en los pacientes en los que la AP se hizo en el
propio centro. Esto quiere decir que el retraso que supone el traslado entre un
centro y otro probablemente se compensó en gran parte por el hecho de que
mientras el paciente era trasladado al centro de referencia, el equipo de
hemodinámica de alerta se trasladaba al hospital.
Qué sucede con los pacientes en shock cardiogénico
Los pacientes que se encuentran en shock cardiogénico tienen una
mortalidad muy elevada aunque se lleve a cabo revascularización temprana
mediante AP.28 A pesar de ello, el tratamiento invasivo mediante
coronariografía precoz y revascularización coronaria es la mejor opción terapéutica
en estos pacientes. En el estudio SHOCK (Should we emergently
revascularize occluded coronaries for cardiogenic shock), el
tratamiento mediante revascularización coronaria urgente se asoció con incremento
de la supervivencia a los 6 meses.29
Por tanto, lo lógico es que estos pacientes se beneficien de ser trasladados a un
centro con AP. Sin embargo, dos argumentos podrían poner en entredicho este
potencial beneficio de trasladar al paciente con IAM y shock cardiogénico a
otro centro para realizarle AP. Por una parte, aunque existe escasa relación entre el
tiempo de evolución de los síntomas y la mortalidad en los pacientes con IAM que
son tratados con AP cuando se excluyen los pacientes en shock
cardiogénico, esta relación sí es evidente en los pacientes que se encuentran
en shock, por lo cual un retraso en el inicio del tratamiento sí podría tener
repercusión en el pronóstico en este subgrupo de pacientes.16,29 En
segundo lugar, probablemente el riesgo de complicaciones graves e incluso de
mortalidad durante el traslado es superior en los pacientes en shock.
En estos estudios, la proporción de pacientes en shock cardiogénico era
muy baja (2% en el PRAGUE 2, por ejemplo), de tal forma que los datos que
podemos conocer sobre el beneficio de trasladar pacientes con IAM en shock
a centros con AP son escasos a la luz de estos estudios.22-26
En los PRAGUE 1 y 2 hubo 56 pacientes en Killip III-IV o con presión arterial
sistólica inferior a 100 mmHg al ingreso. Aunque no hubo diferencias significativas
en mortalidad entre las diferentes estrategias terapéuticas a las que fueron
asignados, la mortalidad de estos pacientes fue 70%, 63% y 41% en los pacientes
tratados con trombólisis (n = 23), trombólisis y traslado para intervencionismo
percutáneo urgente (n = 16) y traslado para AP (n = 17).
A pesar de la escasez de datos sobre pacientes en shock cardiogénico
incluidos en estos estudios, el ensayo SHOCK apoya el manejo invasivo precoz con
revascularización coronaria urgente en los pacientes con IAM en shock
cardiogénico, aunque para ello sea necesario trasladar al paciente a otro
centro.
¿Se debe "facilitar" la angioplastia durante el traslado?
Entre los pacientes remitidos para realización de AP, aquellos en los que la
arteria responsable del infarto se encuentra permeable en la angiografía inicial
tienen mejor pronóstico, especialmente en los que el flujo inicial es de grado TIMI
3.31 Este hecho, entre otros, estimuló la investigación sobre la
posibilidad de incrementar la proporción de casos con flujo TIMI 3 en la angiografía
inicial entre los pacientes con IAM que son remitidos para AP. Para ello se está
evaluando el efecto de la administración de diferentes agentes farmacológicos
(especialmente bloqueantes de las glucoproteínas IIb/IIIa o dosis bajas de agentes
trombolíticos o ambas) previamente a la AP. Esta estrategia, es decir la realización
de AP pero con la administración previa de estos agentes farmacológicos sin que
ello suponga retraso en la AP, se denomina "angioplastia facilitada".
Los resultados del estudio ADMIRAL (Abciximab before direct angioplasty and
stenting in myocardial infarction regarding acute and long term
follow-up) parecen apoyar la administración temprana de abciximab en
pacientes con IAM remitidos para la realización de AP. En el estudio SPEED
(Strategies for patency enhancement in the emergency department;
GUSTO-4 piloto), la combinación de abciximab y una dosis reducida de
reteplase permitió obtener una tasa de reperfusión superior que con la dosis
estándar de reteplase sin abciximab.12 En los estudios IMPACT-AMI
(Integrilin to minimise platelet aggregation and coronary
trombosis),32 e INTRO-AMI (Integrilin and low-dose
thrombolysis in acute myocardial infarction),10 la combinación
de eptifibatide con dosis baja de trombolítico también logró una tasa de
recanalización del vaso superior a la de la dosis estándar de trombolítico.
Algunos estudios como el CARESS in AMI (Combined abciximab re-teplase stent
study in acute myocardial infarction) y el FINESSE (Facilitated intervention
with enhanced reperfusion speed to stop events), están evaluando la eficacia
de la administración de abciximab o dosis bajas de trombolítico de forma temprana
en pacientes con IAM remitidos para AP. Los resultados aportarán más datos sobre
si debemos administrar estos fármacos antes del traslado o durante el traslado a
los pacientes con IAM derivados a otros centros para la realización de AP.
Conclusiones
La AP es la mejor estrategia de reperfusión en el IAM, siempre que se realice
en centros con personal entrenado e infraestructura adecuada. Sus beneficios, no
obstante, no tienen por qué limitarse a los pacientes que ingresan en centros con
AP, pues los pacientes que acuden inicialmente a centros sin AP pueden
beneficiarse del traslado urgente a centros con programa de AP. Para ello es
fundamental que exista una organización con los sistemas de transporte sanitario,
según la cual se garantice que la AP puede iniciarse en los siguientes 90 minutos
desde que se toma la decisión de trasladar al paciente. Los pacientes que
probablemente se beneficien más de esta actitud son, además de los que tienen
contraindicaciones para tratamiento trombolítico y aquellos con trombólisis fallida,
los que tienen un tiempo de evolución de los síntomas superior a 3 horas.
Los autores no manifiestan conflictos.
BIBLIOGRAFÍA
-
Zijlstra F, De Boer MJ, Hoorntje JCA, Reiffers S, Reiber JHC, Suryapranata H. A
comparison of inmediate coronary angioplasty with intravenous streptokinase in
acute myocardial infarction. N Engl J Med 1993;328:680-4.
-
The global use of strategies to open occluded coronary arteries in acute
coronary syndromes (Gusto IIb) Angioplasty Substudy investigators. A clinical trial
comparing primary coronary angioplasty with tissue plasminogen activator for acute
myocardial infarction. N Engl J Med 1997;336:1621-8.
-
Grines CL, Browne KF, Marco J, et al. A comparison of inmediate coronary
angioplasty with thrombolytic therapy for acute myocardial infarction. N Engl J Med
1993;328:673-9.
-
García E, Elízaga J, Perez N, et al. Primary angioplasty versus systemic
thrombolysis in anterior myocardial infarction. J Am Coll Cardiol 1999;33:598-604.
-
Keeley EC, Boura JA, Grines CL. Primary angioplasty versus intravenous
thrombolytic therapy for acute myocardial infarction: a quantitative review of 23
randomised trials. Lancet 2003;361:13-20.
-
Moreno R, Lopez-Sendon JL, Garcia E, et al. Primary angioplasty reduces the
risk of left ventricular free wall rupture compared with thrombolysis in patients with
acute myocardial infarction. J Am Coll Cardiol. 2002;39:598-603.
-
Hernandez JM, Goicolea J, Duran JM, Auge JM. Registro Español de
Hemodinámica y Cardiología Intervencionista. XI Informe Oficial de la Sección de
Hemodinámica y Cardiología Intervencionista de la Sociedad Española de
Cardiología (años 1990-2001). Rev Esp Cardiol 2002;55:1173-84.
-
Fiol M, Cabadés A, Sala J, et al.. Variabilidad en el manejo hospitalario del
infarto agudo de miocardio en España. Estudio IBERICA (Investigación, Búsqueda
Específica y Registro de Isquemia Coronaria Aguda). Rev Esp Cardiol 2001; 54:
443-452.
-
Moreno R. Manejo del infarto agudo de miocardio en España. Diferencias
interregionales en la actualidad según el registro IBERICA. Rev Esp Cardiol
2001;54:419–421.
-
Brener J, Zeymer U, Adgey AA, et al. Eptifibatide and low-dose tissue
plasminogen activator in acute myocardial infarction: teh integrilin and low-dose
thrombolysis in acute myocardial infarction (INTRO-AMI) trial. J Am Coll Cardiol
2002;39:377-386.
-
Antman EM, Gibson CM, de Lemos JA, et al. Combination reperfusion therapy
with abciximab and reduced dose reteplase results from TIMI 14. The Thrombolysis
In Myocardial Infarction (TIMI) 14 Investigators. Eur Heart J 2000;21:1944-1953.
-
Trial of abciximab with and without low-dose reteplase for acute myocardial
infarction. Strategies for Patency Enhancement in the Emergency Department
(SPEED) Group. Circulation 2000;101:2788-2794.Bonnefoy E, Lapostolle F,
Leizorovicz A, et al. Primary angioplasty versus prehospital fibrinolysis in acute
myocardial infarction: a randomised study. Lancet 2002;360:825-9.
-
Magid DJ, Calonge BN, Rumsfeld JS, et al. Relation between hospital primary
angioplasty volume and mortality for patients with acute MI treated with primary
angioplasty vs thrombolytic therapy. JAMA 2000;284:3131-8.
-
Chareonthaitawee P, Gibbons RJ, Roberts RS, et al, for the CORE investigators.
The impact of time to thrombolytic treatment on outcome in patients with acute
myocardial infarction. Heart 2000;84:142-148.
-
Brodie BR, Stuckey TD, Muncy DB, Hansen CJ, Wall TC, Pulsipher M, Gupta N.
Importance of time-to-reperfusion in patients with acute myocardial infarction with
and without cardiogenic shock treated with primary percutaneous coronary
intervention. Am Heart J 2003;145:708-15.
-
Zijlstra F, Patel A, Jones M, et al, for the PCAT collaboration. Clinical
characteristics and outcome of patients with early (< 2 h), intermediate (2-4 h) and
late (>4 h) presentation treated by primary coronary angioplasty or thrombolytis
therapy for acute myocardial infarction. Eur Heart J 2002;23:550-557.
-
Liem AL, van 't Hof AW, Hoorntje JC, de Boer MJ, Suryapranata H, Zijlstra F.
Influence of treatment delay on infarct size and clinical outcome in patients with
acute myocardial infarction treated with primary angioplasty. J Am Coll Cardiol.
1998;32:629-33.
-
Brodie BR, Stuckey TD, Hansen CJ, VerSteeg D, Muncy D, Pulsipher M, Gupta
N. Effect of treatment delay on outcomes in patients with acute myocardial
infarction transferred from community hospitals for primary percutaneous coronary
intervention. Am J Cardiol. 2002;89:1243-7
-
Straumann E, Yoon S, Naegeli B, Frielingsdorf J, Gerber A, Schuiki E, Bertel O.
Hospital transfer for primary coronary angioplasty in high risk patients with acute
myocardial infarction. Heart 1999;82:415-9.
-
Oude Ophuis TJ, Bar FW, et al. Early referral for intentional rescue PTCA after
initiation of thrombolytic therapy in patients admitted to a community hospital
because of a large acute myocardial infarction. Am Heart J 1999;137:846-53.
-
Vermeer F, Oude Ophuis AJ, vd Berg EJ, et al. Prospective randomised
comparison between thrombolysis, rescue PTCA, and primary PTCA in patients with
extensive myocardial infarction admitted to a hospital without PTCA facilities: a
safety and feasibility study. Heart 1999;82:426-31.
-
Widimsky P, Groch L, Zelizko M, Aschermann M, Bednar F, Suryapranata H.
Multicentre randomized trial comparing transport to primary angioplasty vs
immediate thrombolysis vs combined strategy for patients with acute myocardial
infarction presenting to a community hospital without a catheterization laboratory.
The PRAGUE study. Eur Heart J 2000;21:823-31.
-
Widimsky P, Budesinsky T, Vorac D, et al; 'PRAGUE' Study Group Investigators.
Long distance transport for primary angioplasty vs immediate thrombolysis in acute
myocardial infarction. Final results of the randomized national multicentre trial--
PRAGUE-2. Eur Heart J 2003;24:94-104.
-
Andersen HR, Nielsen TT, Rasmussen K, et al. A comparison of coronary
angioplasty with fibrinolytic therapy in acute myocardial infarction. N Engl J Med
2003;349:733-42.
-
Grines CL, Westerhausen DR Jr, Grines LL, et al. A randomized trial of transfer
for primary angioplasty versus on-site thrombolysis in patients with high-risk
myocardial infarction: the Air Primary Angioplasty in Myocardial Infarction study. J
Am Coll Cardiol. 2002;39:1713-9.
-
Widimsky P, Budesinsky T, Vorac D, et al; 'PRAGUE' Study Group Investigators.
Long distance transport for primary angioplasty vs immediate thrombolysis in acute
myocardial infarction. Final results of the randomized national multicentre trial--
PRAGUE-2. Eur Heart J 2003;24:94-104.
-
Moreno R, García E, Soriano J, Abeytua M, Rubio R, López de Sá E, López-
Sendón JL. Results of Primary Angioplasty for Acute Myocardial Infarction
Complicated by Cardiogenic Shock. Have novel therapies led to better results? J
Invasive Cardiol 2000;12:597-604.
-
Hochman JS, Sleeper LA, Webb JG, et al. Early revascularization in acute
myocardial infarction complicated by cardiogenic shock. N Engl J Med
1999;341:625-632.
-
Garcia E, Moreno R, Soriano J, et al. Influence of time to reperfusion on in-
hospital outcome after primary angioplasty for acute myocardial infarction. Eur
Heart J 1999;20(Abstr.Suppl):401.
-
Stone GW, Cox D, Garcia E, et al. Normal flow (TIMI-3) before mechanical
reperfusion therapy is an independent determinant of survival in acute myocardial
infarction: analysis from the primary angioplasty in myocardial infarction trials.
Circulation 2001;104:636-41.
-
Ohman EM, Kleiman NS, Gacioch G, et al. Combined accelerated tissue-
plasminogen activator and platelet glycoprotein IIb/IIIa integrin receptor blockade
with Integrilin in acute myocardial infarction. Results of a randomized, placebo-
controlled, dose-ranging trial. IMPACT-AMI Investigators. Circulation 1997;95:846-
54.
|


![]()

