


Asociación Argentina
de Cirugía

|

|
 Asociación Argentina de Cirugía |
| Volumen 1, Número 6, Septiembre 2003 |
|
Expertos Invitados |
|
|
| |
|
|
|
Introdução Malformações congênitas da válvula mitral são lesões complexas, em conseqüência das variadas anormalidades morfológicas que envolvem geralmente mais de um componente valvular1-3 e por incidirem em uma população com alta prevalência de anomalias cardíacas associadas.4-6 As lesões congênitas isoladas como estenose ou insuficiência mitral, são raras, 1,7,8 representam 1% da população de pacientes com cardiopatia congênitas.5 A insuficiência mitral congênita isolada é extremamente incomum,8 sendo na infância encontrada em associações com outros defeitos cardíacos, desordens do tecido conjuntivo e em condições inflamatórias adquiridas tais como miocardites, endocardites, febre reumática, doença de Kawasaki e outras colagenoses com comprometimento vascular.8 Na estenose mitral congênita a obstrução ao fluxo resulta por anomalias morfológicas em diferentes níveis,1,2,5 sendo mais freqüente que a insuficiência.2 O objetivo do presente trabalho é a análise de evolução clínica tardia após o tratamento cirúrgico das anomalias mitrais congênitas, com ou sem malformações associadas em crianças até 12 anos de idade tratadas com técnicas reparadoras e reconstrutivas sem suporte anular e fazer uma revisão da literatura. Pacientes e métodos No período de 1975 a 1998 no Instituto de Cardiologia do RS/FUC foram operados 21 crianças com lesão congênita da valva mitral, com idade média foi de 4.67 ± 3.44 anos, sendo 47.6% do sexo feminino e 52.4% do sexo masculino. A insuficiência valvar mitral esteve presente em 57.1% (12 casos), estenose em 28.6% (6 casos) e a dupla lesão em 14.3% (3 casos) (figura 1). 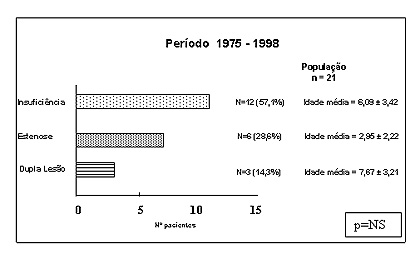
Figura 1. Distribuição por grupos dos pacientes com malformações congênitas da válvula mitral. Nesta amostra foram excluídos os pacientes com defeitos do septo atrioventricular em sua forma completa. As lesões morfológicas mais freqüentes encontradas no grupo de
insuficiência foram: a dilatação anular em 75%, fenda no folheto
posterior em 33.3%, fenda no folheto anterior em 16.6%; no grupo de
estenose: válvula em paraquedas em 50% e fusão comissural em 33.3%; no
grupo de dupla lesão: diminuição da mobilidade dos folhetos em 100%
(tabela1). Figura 2. Curva da probabilidade de sobrevida atuarial no grupo de insuficiência mitral congênita. 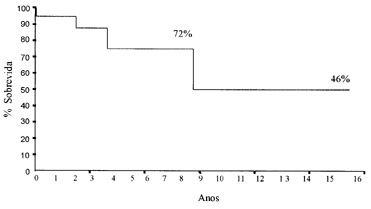
Figura 3. Curva de probabilidade de sobrevida atuarial livre de reoperação de toda a população estudada. 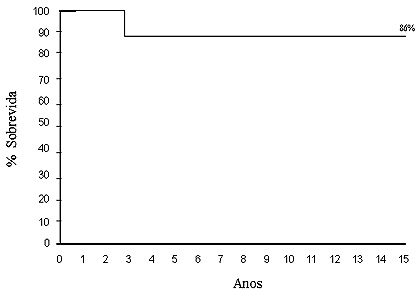
Figura 4. Probabilidade de sobrevida atuarial livre de reoperação no grupo de insuficiência mitral congênita. Discussão A apresentação clínica, assim como a indicação cirúrgica da estenose ou insuficiência depende da severidade da lesão mitral e da associação de defeitos intracardícos.10 A indicação para cirurgia em nossa série foi insuficiência cardíaca intratável ou hipertensão pulmonar severa ou ambas. A cirurgia, de preferência, não deveria ser feita antes dos 6 meses de vida, segundo Carpentier.3 Na infância, antes dos 3 meses, com o colágeno não amadurecido adequadamente, o tecido valvular é particularmente friável, dificultando a manipulação.3 Em nossa série, a idade média dos pacientes foi de 5.7 ± 3.3 anos na insuficiência mitral congênita (IMC) e na estenose mitral congênita (EMC) de 4.0 ± 5.9 anos, não sendo estatisticamente significativo (Fig. 1). Na série de Carpentier,3 foi para a IMC de 6.1 ± 3.2 anos e para EMC de 5.1 ± 3.2 anos. No relato de Souza-Uva, do grupo do Hospital Marie- Lannelongue,11 a IMC foi de 7.4 ± 2.7 meses e a EMC de 5.8 ± 3.9 meses. Os fatores que explicam a menor idade no momento da cirurgia dos pacientes com EMC são: em primeiro lugar, a lesão estenótica é menos tolerada que a insuficiência, em segundo lugar, associa-se com uma incidência maior e mais grave de anomalias intracardíacas, e em 3º lugar as anormalidades do aparelho subvalvar são mais freqüentes nestes tipos de pacientes. A estenose mitral congênita ocorre em 0.6% das autópsias e em 0.2% a 0.42% das séries clínicas.1,12 Na série de Ruckmann e Van Praagh13 de 49 autópsias com EMC, achou-se típica estenose mitral em 49%, tendo como lesão associada mais comum a coarctação da aorta. O tamanho do VE foi normal em 96% destes pacientes. Hipoplasia mitral congênita foi a segunda causa de EMC (41%), todas as vezes associada com hipoplasia de VE. Anel supravalvar foi encontrado em 12% dos casos e válvula mitral em pára-quedas em 8%. Tradicionalmente as lesões que mais dificultam o reparo efetivo e duradouro são as que apresentam alteração do aparelho subvalvar com músculos papilares anormais - incluindo válvula em paraquedas, a válvula em rede (Hammock) e agenesia de músculos papilares. Estas lesões determinam com mais freqüência estenoses10 e estão associadas com alta freqüência a malformações complexas. Barbero-Marcial apresenta bons resultados a curto e longo prazo com 7 pacientes com válvula mitral em paraquedas com estenose.14 Conforme revisão apresentada na tabela 2, as diferentes publicações encontradas na última década mostram importantes avanços quanto aos resultados em que foi possível realizar plastia em 91.4% dos casos de estenose mitral com válvula em paraquedas e da válvula em rede (Hammock) em 50%. 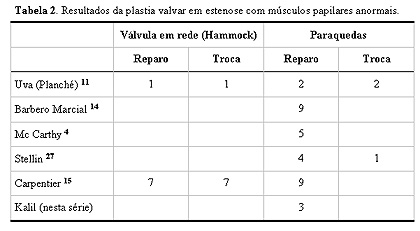 Na série de Moore,12 a hipoplasia mitral típica com músculos papilares simétricos foi a primeira causa de EMC (52% dos casos), seguido de anel supravalvar (em 20%), duplo orifício (em 11%), hipoplasia mitral com assimetria de músculos papilares (em 8%) e válvula mitral em paraquedas (em 8% dos casos). Em contraposição a esta série, Embrey afirma que raramente o anel é tão pequeno que resulte em estenose a menos que esteja presente hipoplasia de VE. Segundo este autor, malformação das cordoalhas é a causa mais comum de estenose.5 Carpentier15 em sua série de 50 pacientes, apresentou como causa mais comum de EMC com músculos papilares normais, a fusão comissural (em 17 pacientes). Com músculos papilares anormais, a mais comum foi a válvula mitral em rede (Hammock) em 11 pacientes. Em nossa série, 50% das EMC apresentou músculos papilares anormais, sendo a mais comum a válvula mitral em paraquedas em 3 pacientes, 2 delas associadas com síndrome de Shone’s, sendo possível sua recuperação (tabela 1), 38% estenose mitral típica e 12,5% válvula mitral hipoplásica (tabela 1); a hipoplasia ventricular esquerda esteve presente em 50% das EMC associada em 50% com fibroelastose ventricular esquerda. Segundo McGiffin2 a IMC ocorre menos freqüentemente que a EMC. Em nossa série tivemos 12 casos de insuficiência e 6 de estenose. A causa mais freqüente na IMC é a dilatação anelar,2,16 sendo confirmado este achado em nossa série, 75% dos pacientes do grupo de IMC apresentaram esta malformação, sendo que em 25% foi encontrado como única malformação. Tratamento cirúrgico Anormalidades congênitas ou adquiridas da válvula mitral em crianças podem ser manejadas cirúrgicamente com prótese mecânica, biológica ou plastia.4,17 A troca valvular acompanha-se de alta mortalidade e de problemas com anticoagulação e impossibilidade de crescimento anelar que fazem inevitável a reoperação.2,4,17- 22 O uso do anel rígido ou flexível com pré-requisito para eficácia e durabilidade do remodelamento anelar23 atualmente está sendo questionado em adulto24,25 e a tendência é a diminuição de seu emprego.26,27. Em crianças e adolescentes, os anéis protéticos devem ser evitados por não permitirem o crescimento anelar normal5 além de serem fator de risco para a distorção de cavidade cardíaca e contribuírem na obstrução da via de saída do VE.18,28 Sem acrescentarmos o conhecimento de que o segmento anelar de continuidade mitro aórtica tem capacidade de contração e relaxamento durante o ciclo cardíaco na via de saída do VE25,26,28 sendo a única porção anelar que não se dilata, pode-se concluir que a dito nível não deve existir estrutura protética. A estabilidade a longo prazo do reparo de válvula mitral dentro do conceito de anuloplastia remodeladora não significa o uso de anel rígido ou flexível para diminuir o diâmetro ântero- posterior do anel; desde 1975 acreditamos que a estabilidade na anuloplastia sem suporte com técnica de Wooler9 está contida na ancoragem nos trígonos fibrosos direito e esquerdo (figura 5), mantendo-se as relações anatômicas variáveis normais com a válvula aórtica e a via de saída do VE, podendo ficar o segmento anelar de continuidade mitro-aórtica com a capacidade de contração e relaxamento durante o ciclo cardíaco.28 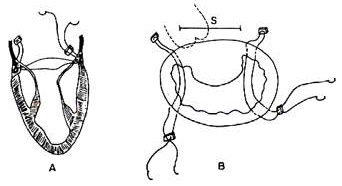
Figura 5. Esquema representando a forma de colocação dos pontos na anuloplastia tipo Wooler. No momento de realizar a técnica de Wooler é de essencial importância para a estabilidade a longo prazo do reparo e evitar falha do reparo que os pontos passem pelos trígonos fibrosos, lembrando as relações destes com a cúspide anterior.29 Esta técnica mostrou resultado tardio comparável com técnicas de suporte mais complexas, 30-34 porém com menor incidência de falha técnica do reparo. A incidência relatada de falha de reparo por problemas técnicos com o anel protético em adulto varia (Aharon10 - 2.9% Cosgrove35 - 3.2% Deloche36 - 4.3% Cosgrove25 - 3.3%). Referente aos óbitos intraoperatórios, encontravam-se em classe funcional IV da NYHA, em nossa série representou 100% de mortalidade, na série de Kirklin os pacientes com EMC em classe funcional IV apresentaram 50% de mortalidade,37,38 ambos os pacientes apresentavam fibroelastose endocárdica. O paciente de 12 dias apresentava hipoplasia ventricular esquerda e o de 7 meses a síndrome de Shone’s. Recentes estudos por NI, Bowles e cols,39 sugerem a infecção viral como etilogia na fibroelastose endocárdica, sustentando a hipótese de que esta enfermidade é uma seqüela da miocardite viral, particularmente, devido ao vírus da mumps (caxumba). As correções mitrais foram feitas por atriotomia longitudinal da parede direita do átrio esquerdo, não sendo usadas outras abordagens.14,40-43 Os resultados comparativos entre os trabalhos encontrados na literatura na IMC mostrados no quadro 1, comprova os bons resultados a longo prazo da anuloplastia sem suporte anelar nesta população de pacientes, sendo portanto nossos resultados generalisáveis. No entanto, na população de pacientes com EMC mostra extrema variedade das malformações valvulares mitrais, elevada associação de malformações cardíacas, e a idade variável dos pacientes, tornam dificil obter-se conclusões generalisáveis, conforme mostra-se no quadro 2. 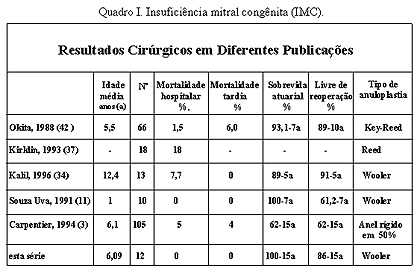 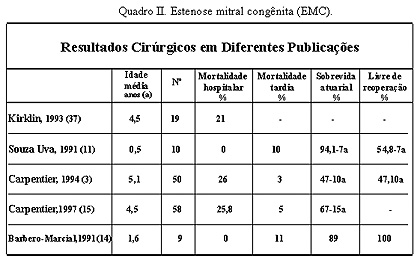 Conclusões A valvuloplastia mitral nas lesões congênitas, isoladas ou em associação com outras malformações cardíacas, mostra bons resultados a longo prazo. A maioria dos pacientes encontram-se assintomáticos ou classe I (NYHA) e livres de reoperações. A falha do reparo na estenose e dupla lesão, associa-se com a complexidade das malformações encontradas. Na insuficiência mitral congênita a valvuloplastia mitral sem suporte com técnica de Wooler, mostrou ter baixo risco cirúrgico e bons resultados a longo prazo. Considera-se desnecessário o uso de anéis protéticos neste grupo de pacientes BIBLIOGRAFIA
|
||
|
|
Introducción Discusión BIBLIOGRAFIA
|
|
|
| |
 |
|
||
Basildon, Essex, Reino Unido (especial para SIIC) Es posible realizar más del 90% de las histerectomías por patologías benignas a través de la vía vaginal, lo cual produce beneficios sanitarios y económicos. RESUMEN El propósito del trabajo consistió en investigar si la decisión de incrementar la tasa de histerectomías vaginales es efectiva para elevar la proporción de histerectomías vaginales realizadas por patologías benignas, en ausencia de prolapso. Se llevaron a cabo 272 histerectomías en un período de 5 años entre 553 pacientes elegibles para el estudio; fueron excluidas las mujeres con prolapso, enfermedad anexial, miomas (úteros mayores que un embarazo de dieciséis semanas) o neoplasias. La proporción de histerectomías vaginales aumentó desde 32% en el primer año hasta 95% en el último del año del estudio. Hacia el quinto año del estudio, la mayoría de las ooforectomías asociadas fueron también realizadas por vía vaginal. No aumentó la morbilidad de las pacientes, y la conversión a histerectomía abdominal fue necesaria en sólo dos casos. La decisión acerca de la vía de la histerectomía debería efectuarse intraoperatoriamente. El deseo y la decisión de cambiar la práctica habitual es todo lo que se necesita para aumentar la proporción de histerectomías llevadas a cabo por vía vaginal. No hay necesidad de entrenamiento extra, de habilidades especiales o de equipamiento complicado. Así, el mayor determinante de la vía de la histerectomía no es la situación clínica sino la actitud del cirujano. Esta simple estrategia puede conducir a significativa reducción del costo de las histerectomías sin aumentar la morbilidad de las pacientes. ABSTRACT Este estudio investiga un enfoque para cambiar la práctica diaria, y detalla los resultados logrados cuando un ginecólogo promedio sin entrenamiento extra tomó la decisión deliberada de realizar todas las histerectomías por vía vaginal, siempre que ello fuera posible. METODOS Se llevó registro de la edad, paridad, peso, antecedentes quirúrgicos de cada paciente, así como de las indicaciones de histerectomía, necesidad de ooforectomía y disminución de los niveles de hemoglobina. Cada operación fue calificada como difícil (cuando obligó intraoperatoriamente a cambiar la vía) o de complejidad normal. Las complicaciones fueron clasificadas como: (1) intraoperatorias, (2) inmediatas posoperatorias (ocurridas dentro de las seis semanas), y (3) posoperatorias tardías (acaecidas luego de seis semanas). Se definió como hipertermia posoperatoria a la temperatura superior a 38 °C en dos o más ocasiones, excluyendo las primeras 24 horas posteriores a la operación. RESULTADOS
La figura 1 muestra la distribución
de las histerectomías abdominales y vaginales realizadas por año
desde 1994 hasta 1998. La proporción de histerectomías vaginales
aumentó gradualmente desde 32% en 1994 hasta 95% en 1998.
DISCUSION Hasta el momento, la vía de la histerectomía es generalmente asumida como abdominal o determinada mediante examen pelviano bimanual en la consulta ambulatoria. Tal examen conlleva gran variación interobservador e intraobservador, y parece un elemento débil para definir la viabilidad de la histerectomía vaginal. Sin embargo, cuando esta evaluación es efectuada en la sala de operaciones, el panorama es habitualmente más favorable de lo que la mayoría de los ginecólogos podrían anticipar. Este cambio en la práctica y en las actitudes promovido por Seth7 condujo a la experiencia aquí señalada. Motivos comúnmente invocados para
desestimar la realización de histerectomía vaginal Utero grande. La intención de este estudio no fue aspirar a la remoción de grandes úteros, aunque ello fue ocurriendo a medida que aumentó nuestra experiencia y nuestra confianza. Nosotros recomendamos la utilización de análogos LHRH para reducir el tamaño uterino y el de los miomas antes de la operación. Este recurso nos permitió remover por vía vaginal úteros aún mayores que el tamaño de un embarazo de dieciocho semanas, tras lograr la reducción uterina3 Con respecto a la extracción de grandes úteros, preferimos la técnica de enucleación y miomectomía a la de bisección uterina. Cuando se encuentran dificultades, ello no obedece usualmente al tamaño uterino sino a la posición de los miomas. Los miomas bajos posteriores y los bajos anteriores subserosos de más de 6-7 cm son los más problemáticos en comparación con los intramurales, superiores o fúndicos, los cuales son habitualmente muy fáciles de remover. Cesáreas o cirugías pelvianas anteriores. Las cesáreas y las cirugías pelvianas anteriores no constituyeron problema alguno, excepto en un caso que presentaba densas adherencias entre el fondo uterino y la pared abdominal anterior. No consideramos esta situación como contraindicación, y efectuamos histerectomías vaginales en forma rutinaria a pacientes con 2-4 cesáreas previas. En nuestra experiencia, la disección de la vejiga es mucho más fácil por vía vaginal luego de una cesárea previa que en el caso de la histerectomía abdominal. Otras cirugías pelvianas raramente influenciaron la remoción vaginal del útero. Necesidad de ooforectomía. En EE.UU., al 50% de todas las mujeres sometidas a histerectomía se les efectúa conjuntamente ooforectomía bilateral.20 El aumento del número de ooforectomías vaginales fue un hecho tardío en el estudio; a medida que nuestra experiencia y confianza aumentaban, este cambio ocurrió en forma automática. Ello no constituye un prerrequisito para el cambio en la práctica médica descripto aquí. La frecuencia de ooforectomía vaginal aumentó rápidamente desde cero hasta un 82% hacia el final del período de cinco años. En nuestra experiencia, la remoción ovárica por vía vaginal es usualmente simple de efectuar en mujeres premenopáusicas y no requiere de instrumento especial alguno. Pero en el caso de mujeres que hayan transitado algunos años de la posmenopausia, el ligamento infundíbulo-pélvico se halla muchas veces significativamente acortado, siendo por ello difícil de alcanzar. En estas pacientes, la utilización de un laparoscopio para seccionar los ligamentos infundíbulo-pélvicos puede ser de utilidad. Este estudio demuestra claramente que la práctica adicional de ooforectomías no necesita la vía abdominal o de asistencia laparoscópica en la mayoría de las pacientes. Nuliparidad. En nuestra experiencia, ha sido sorprendentemente fácil remover los úteros nulíparos; esto podría obedecer a la existencia en estos casos de úteros y cérvices pequeños. En estas pacientes se observa a menudo descenso cervical, con cérvices que descienden hasta 1-3 cm del introito al aplicárseles tracción. Papel de la laparoscopia Cuándo esperar dificultades Aún cuando es lógico evitar la realización de procedimientos abdominales en pacientes muy obesas que presentan riesgo de complicaciones posoperatorias, estas mismas mujeres constituyen el grupo en las cuales la histerectomía vaginal podría ser extremadamente dificultosa. La obesidad, en nuestra opinión, reduce claramente la accesibilidad al útero; además, recomendaríamos la ayuda de asistentes experimentados cuando se intenta efectuar una histerectomía vaginal en este grupo de pacientes, ya que la necesidad de retracción es mucho mayor que en los casos de índice de masa corporal normal. Nuestro enfoque ¿Cómo podría cambiarse desde una vía vaginal planeada hasta un abordaje abdominal, de un modo seguro y expeditivo? La seguridad de la paciente demanda que, cuando la situación que favorece el cambio está presente durante la operación, debería ser prontamente reconocida sin experimentar sensación de fracaso. Nuestra recomendación es que, ante una dificultad aparente para el abordaje vaginal que obstaculiza el progreso (esto es usualmente evidente para todos en el quirófano), el cirujano solicite a la enfermera circulante que tome nota del tiempo. Así, se podría dejar transcurrir un máximo de 10-15 minutos más antes de abrir el abdomen. Nosotros hemos utilizado a menudo esta técnica en la práctica diaria, y aun luego de finalizar el estudio; sin embargo, la necesidad de cambiar a una vía abdominal surgió sólo en una ocasión en los últimos cinco años. Cómo lograr este cambio en la práctica
Hay muchos datos acerca de la superioridad de la vía vaginal para la histerectomía.5-7,9,11,12-20 Los costos hospitalarios son menores al hacerse más breve la estadía de la paciente en el hospital.6,10,16,18 Dado que la histerectomía es la operación ginecológica más común, cualquier ahorro en su práctica con la vía vaginal ejercerá efectos importantes sobre el costo de las cirugías ginecológicas a nivel mundial. Una estadía hospitalaria más breve es también un resultado deseable desde la perspectiva de la paciente. No se realizó un análisis de costo-beneficio para medir la influencia de la duración de la internación y del retorno laboral; sin embargo, las pacientes sometidas a histerectomía vaginal refieren que retornan a sus actividades normales mucho más rápidamente, y presentan calidad de vida más favorable en comparación con las pacientes sometidas a histerectomía abdominal o asistida laparoscópicamente.17 No hay un estudio de la literatura que haya indagado acerca del cambio de la práctica de la histerectomía en un período de tiempo. La estrategia propuesta es simple, y puede ser aplicada muy fácilmente por cualquier ginecólogo en ejercicio en cualquier parte del mundo; el cambio puede ser muy rápido, tal como lo observamos nosotros para nuestra sorpresa. El récord de seguridad que hemos demostrado y el éxito práctico de este enfoque debe alentar a todos los departamentos de ginecología a prepararse para investigar este cambio de política. Además, los que no optan por el cambio deberían dar sus razones a pacientes y profesionales de la salud. Más importante aún, deberían analizar sus prácticas para determinar los resultados y el impacto, tanto sobre la calidad de vida de la paciente como sobre los costos hospitalarios, de las histerectomías en sus propias instituciones. TECNICA La mayoría de los procedimientos son efectuados bajo anestesia general; la analgesia espinal es utilizada cuando se considera inadecuada la anestesia general. La paciente es colocada en posición de litotomía y luego examinada para evaluar la movilidad y tamaño uterinos, así como la presencia de masas tuboováricas. No se efectúa la cateterización rutinaria para vaciar la vejiga. Se infiltra utilizando 10 ml de marcaína con adrenalina (1 en 200 000). Se efectúa una incisión alrededor del cérvix que involucra el espesor total del epitelio vaginal, excepto lateralmente, donde es superficial. Posteriormente, la incisión es efectuada 1-2 cm más alta. Esto contribuye a ingresar más fácilmente al fondo de saco de Douglas; el epitelio vaginal es luego empujado utilizando una gasa montada sobre el dedo. El peritoneo del fondo de saco de Douglas es generalmente visible en este punto, y es incidido utilizando tijeras de McIndoe. La entrada exitosa en el fondo de saco de Douglas se acompaña habitualmente de la salida de una pequeña cantidad de líquido peritoneal. El epitelio vaginal anterior es sostenido con una pinza de disección con dientecillos, y se efectúa la separación de la vejiga utilizando tijeras inicialmente, y luego en forma roma. La vejiga debe ser rebatida utilizando un retractor de pared vaginal anterior de Wertheim; en este punto, el peritoneo es visible, pero no incidido. Se coloca una pinza angulada durante todo el procedimiento; la primera pinza es colocada generalmente en el complejo de ligamentos cardinales uterosacros izquierdo, y se intenta incluir la totalidad. Este es posteriormente ligado utilizando una sutura de Vicryl® 2’0 montado en una aguja curva de 5/8 (este tipo de sutura es utilizada a lo largo de todo el procedimiento). Se cortan todas las suturas con un cabo de 2-3 cm de longitud, y se dejan libres; los pedículos son pinzados y cortados uno a continuación del otro, para evitar el uso simultáneo excesivo de pinzas. Luego de atar el complejo de ligamentos cardinales uterosacros, los vasos uterinos son pinzados y ligados (se intenta incluir la totalidad del pedículo vascular en una pinza). Las suturas son cortadas a longitudes similares a las del primer pedículo; en este punto, la punta de la pinza ingresa usualmente en el peritoneo anterior. Si el peritoneo no es fácilmente visible en este punto, se procede a su apertura. Los pedículos de los ligamentos anchos son pinzados, cortados y ligados. Como estos pedículos son a veces largos, acostumbramos efectuarles diatermia luego de atados. Se tiene cuidado a lo largo de todo procedimiento de evitar dejar vasos entre los pedículos. En este punto, si se observa algún sangrado, habitualmente es debido a los vasos de las paredes vaginales; todo los pedículos son inspeccionados cuidadosamente antes de cerrar la cúpula vaginal. Esta última es cerrada utilizando sutura continua, comenzando desde atrás y progresando hacia adelante. No se efectúa cierre peritoneal, y las suturas de la cúpula son colocadas cuidadosamente, incluyendo el peritoneo posterior, con el fin de cerrar cualquier espacio existente entre la pared vaginal y el peritoneo. Se incluye el espesor total del epitelio vaginal en las suturas, y se deja un drenaje redivac en la pelvis a través de la cúpula (los puntos de sutura son colocadas cuidadosamente a su alrededor para procurar no incluirlo en un punto). Se coloca rutinariamente una sonda de
Foley en la vejiga durante 24 horas, y tanto el catéter como el
drenaje son removidos a la mañana siguiente. La cantidad promedio de
líquido drenado es de alrededor de 70 ml (rango,10-300 ml). El
seguimiento se efectúa mediante un control posoperatorio,
generalmente cuatro semanas después del alta. Nosotros dictamos
cursos para enseñar nuestra técnica a otros cirujanos, y hemos
editado un vídeo que la ejemplifica.
BIBLIOGRAFIA
|
[Bienvenidos
a siicsalud]
[Acerca de SIIC] [Estructura de SIIC] [Círculo SIIC de Lectores]
[Salud(i)Ciencia]
[Trabajos Distinguidos]
Sociedad
Iberoamericana de Información Científica (SIIC)
Av. Belgrano 430, (C1092AAR), Buenos Aires, Argentina
Correo electrónico (e-mail): atencionallector@siicsalud.com;
Tels: +54 11 4342-4901; Fax: +54 11 4331-3305.
Correo SIIC: Casilla de Correo 2568, (C1000WAZ) Correo Central, Buenos Aires.
Copyright siicsalud© 1997-2003,
Sociedad Iberoamericana de Información Científica (SIIC)