Introducción
Los tratamientos habituales disponibles para el carcinoma hepatocelular (CHC) son
la resección local y la ablación, pero la cirrosis y la presentación multicéntrica excluyen
en algunos pacientes la posibilidad de resección.1,2 El trasplante es la
alternativa lógica en tales casos, ya que puede potencialmente curar tanto la cirrosis
como el cáncer.8 Sin embargo, la escasez de órganos cadavéricos
aumenta la mortalidad de los que se encuentran en lista de espera como consecuencia
de la progresión del tumor.7,8
El trasplante de órgano de donante vivo (TODV) ofrece una fuente alternativa de
órganos que pueden eventualmente reducir el tiempo de espera y de ese modo
disminuir el número de pacientes excluidos de esta alternativa terapéutica debido al
avance de la neoplasia.7,9
Muchos centros, motivados por los resultados de nuestro estudio inicial en 27 enfermos
con CHC que recibieron TODV, comenzaron a incluirlo como parte del enfoque
terapéutico de los pacientes con el mismo diagnóstico.8,10 Desde
entonces hemos extendido nuestra muestra a 36 personas y analizamos nuevamente
los resultados con un promedio de seguimientos de 450 días.11
Métodos
Desde agosto de 1998 hasta febrero de 2002, 96 pacientes adultos recibieron
TODV en nuestro programa; 36 (37.5%) tenían CHC como indicación primaria. La
selección del donante y el receptor, así como su evaluación y seguimiento, se realizaron
de acuerdo con el protocolo publicado previamente.2,12
Se consignaron la edad y el sexo del paciente, enfermedad hepática subyacente,
localización y tamaño del tumor, tratamientos previos al trasplante, puntaje de Child-
Pugh, status de UNOS al momento del trasplante y tiempo de espera (medido
como el número de días entre el momento en que se completó la evaluación del
paciente y la fecha del trasplante).
Las contraindicaciones fueron presencia de enfermedad extrahepática e invasión de la
vena porta principal. La invasión intrahepática vascular no se consideró contraindicación
para el tratamiento. Se efectuó laparotomía exploradora a los individuos con tumores
mayores de 5 cm para descartar enfermedades extrahepáticas en el día del trasplante,
antes de que se efectuase la anestesia del donante. Estos pacientes recibieron una
dosis única de 10 mg/m2 de doxorrubicina endovenosa durante la
operación, seguida por 6 ciclos de la misma droga, que se iniciaron un mes después de
la intervención y por intervalos de 3 semanas, como describimos
anteriormente.4,7 Evaluamos la importancia del tamaño y número de los
tumores, la ubicación, la invasión vascular (ninguna, microscópica o macroscópica) y el
grado histológico, así como la recurrencia del tumor, en la sobrevida del paciente y del
injerto. Los pacientes que murieron por complicaciones relacionadas con el trasplante
durante los primeros 40 días fueron excluidos del análisis de recurrencia. Para analizar
varibles pequeñas se recurrió al método de χ cuadrado. Para evaluar sobrevida se
utilizó el método de Kaplan-Meir y la prueba del log rank. Se empleó el análisis
de regresión del riesgo proporcional de Cox para el análisis multivariado utilizando
aquellas condiciones que habían resultado significativas en el análisis univariado. Se
consideró significativo el valor de p < 0.05.
Tabla 1
Resultados
Se llevó a cabo el seguimiento de todos los pacientes del estudio hasta el 30 de
agosto de 2003 o hasta la fecha del fallecimiento. La media y la mediana fueron 779 ?
509 y 863 días, respectivamente. Cuatro pacientes recibieron injertos de lóbulo
izquierdo y 32 de lóbulo derecho. El tiempo promedio entre el fin de la evaluación
completa del paciente y el TODV fue de 62 días, en comparación con los 459 necesarios
en los casos de individuos con CHC que recibieron órganos cadavéricos, en el mismo
período de tiempo (p = 0.0001). En 19 de los 36 trasplantados (53%), los tumores
reunían sobradamente los criterios de Milán, sobre los cuales se basa la prioridad para
el trasplante cadavérico.
En la tabla 2 se detallan las complicaciones sufridas por los trasplantados. Quince
pacientes (41.6%) murieron: 8 (22%), por complicaciones relacionadas con el
trasplante durante el posoperatorio (4 como consecuencia de sepsis provocada por
filtración biliar; 1 por sepsis secundaria a ruptura de aneurisma micótico; 1 por sepsis
posterior a trombosis de la vena porta; 1 por sepsis posterior a retrasplante que
obedeció a la complicación con necrosis masiva del injerto por enfermedad
venooclusiva; 1 por sepsis generada por neumonía aspirativa). Un paciente falleció 192
días después del trasplante debido a rechazo crónico; otro, 470 días después de
retrasplante por recurrencia del CHC; ambos pacientes se hallaban libres de tumores al
momento de su muerte. Un sujeto murió 555 días después del trasplante a causa de
cáncer de pulmón pero sin rastros de CHC.

Siete individuos (19.4%) desarrollaron recurrencia de la neoplasia. El tiempo promedio
de la recurrencia fue 312 ? 150 días. Cuatro fallecieron por este motivo a los 159, 533,
551 y 751 días, respectivamente. Tres personas con CHC recurrente están vivos en la
actualidad, dos con recurrencia extrahepática (masa mediastínica y metástasis
pulmonar) y uno con recurrencia intrahepática.
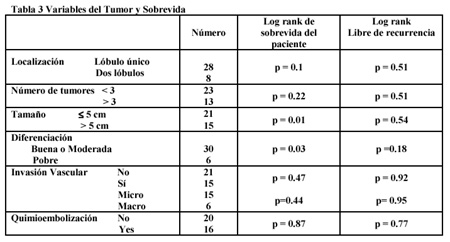
En el análisis univariado, el tamaño del tumor > 5 cm (p = 0.01) y la pobre
diferenciación tumoral (p = 0.036) correlacionaron con la recurrencia observada. En el
análisis multivariado (tabla 2) únicamente el diámetro del tumor > 5 cm predijo
significativamente recurrencia y sobrevida del paciente (log rank = 0.005)
(figura 1). El tratamiento pretrasplante no se asoció con menor grado de recurrencia
(4/20 de recurrencia en pacientes sin tratamiento pretrasplante contra 3/16 que lo
recibieron [p = 0.74)].

Sobrevida global de los pacientes.
La tasa de sobrevida global de los pacientes al primero y segundo año fue de 75% y
58%, respectivamente (figura 1), la del injerto en el mismo período de tiempo fue de
68% y 58% respectivamente (figura 2). La tasa de pacientes libres de recurrencia en el
mismo lapso fue de 82% y 75%, respectivamente (figura 3).

Sobrevida del injerto.

Pacientes libres de recurrencia.
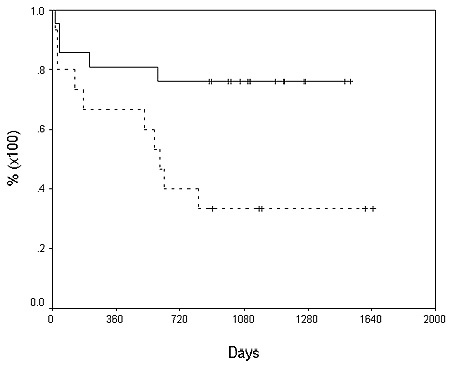
Sobrevida global de los pacientes por tamaño del tumor (< a 5 cm or > 5 cm).
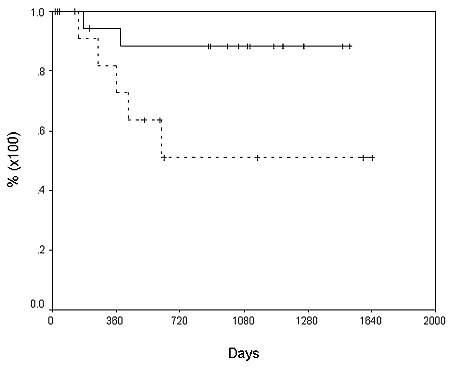
Pacientes libres de recurrencia por tamaño del tumor (< a 5 cm or > 5 cm).
Discusión
En más del 90% de los casos el CHC se desarrolla cuando existe enfermedad
previa en el hígado. Está bien documentado que en individuos con cirrosis y CHC no
tratados la posibilidad de sobrevivir a los cinco años es cercana a 0.1.5
Actualmente, el trasplante es la única alternativa terapéutica en casos de cirrosis y CHC
irresecable, ya que combate potencialmente ambas enfermedades. En una serie de
estudios de trasplantes en CHC, la elevada tasa de recurrencia arrojó resultados
decepcionantes.3,6,13-14 En 1996 Mazzaferro publicó los criterios para
el trasplante de los pacientes con CHC que fueron aceptados mundialmente como base
para establecer la prioridad en la lista de espera y que resultaron en una sobrevida
comparable a la de pacientes no oncológicos.
El trasplante en pacientes con neoplasias que reúnen los criterios de Milán produce
excelentes resultados; sin embargo, la prolongada espera de órganos cadavéricos
genera que muchos enfermos, que en principio eran candidatos aptos, finalmente sean
excluidos debido a la progresión del tumor. El TODV proporciona una fuente alternativa
de órganos que, para aquellos que encuentran donante compatible, permite eliminar el
riesgo asociado a la larga espera.
En nuestro programa se realizó el 29% de procedimientos utilizando donante vivo en
pacientes con CHC comparados con el 20% de trasplantes cadavéricos. El estudio inicial
documentó excelentes resultados en 27 casos aunque con un período de seguimiento
breve. El presente extiende aquella serie. En la actualidad, con seguimiento promedio
mayor de 800 días, observamos un total de 7 casos de recurrencia tumoral, que es
similar al obtenido en pacientes que recibieron trasplantes cadavéricos. El análisis
multivariado demostró que el aumento del diámetro del tumor en más de 5 cm se
vincula con aumento de recurrencia, de acuerdo con los criterios de Milán. No obstante,
en 19 personas de nuestro ensayo, cuyos tumores excedían esos parámetros, la
ausencia de recurrencia ascendió al 75% a los dos años del trasplante. Algunos
informes recientes indican subconjuntos de pacientes cuyos tumores exceden los
criterios de Milán pero que todavía tienen pronóstico favorable, como pacientes con
tumores > 7 cm, sin invasión vascular ni bajo grado de
diferenciación.4,16 El TODV debería ser particularmente aplicable en
dichos casos. Para el grado de que el TODV sea realizado en pacientes que de otro
modo tendrían indicación de injertos cadavéricos, el acceso a la posibilidad del
trasplante se verá favorecido en quienes no posean donante vivo disponible.
Conclusión
Ofrecer TODV a pacientes con CHC aumenta la complejidad para el candidato al
trasplante, el donante y el equipo médico. Los presentes resultados confirman que se
trata de una opción válida para enfermos con tumores que reúnen los criterios de Milán,
lo que permite el trasplante oportuno y ahorrar los escasos órganos cadavéricos para
aquellos pacientes que carecen de donante vivo disponible. Es necesaria una serie más
extensa para obtener datos definitivos sobre esta oportunidad para los pacientes con
neoplasias más avanzadas.
BIBLIOGRAFÍA
-
Okuda K. Hepatocellular carcinoma: recent progress. Hepatology 1992; 15:
948- 63
-
Calvet X, Bruix J, Bru C, Gines P, Vilana R, Sole M, Ayuso MC, Bruguera M, Rodes J.
Natural history of hepatocellular carcinoma in Spain. Five year's experience in 249
cases. J Hepatol 1990;16:6-72.
-
Mazzaferro V, Regalia E, Doci R, Andreola S, Pulvirenti A, Bozzetti F, Montalto F,
Ammatuna M, Morabito A, Gennari L. Liver trasplantation for treatment of small
hepatocellular carcinomas in patients with cirrhosis. N Engl J Med 1996; 14:728-729.
-
Roayaie S, Frischer J, Emre S, Fishbein T, Sheiner P, Sung M, Miller C, Schwartz M.
Long-term results with multimodal adjuvant therapy and liver trasplantation for the
treatment of hepatocellular carcinomas larger than 5 cm. Ann Surg 2002, 235:533-539.
-
Barbara L, Benzi G, Gaiani S, Fusconi F, Zironi G, Siringo S, Rigamonti A, Barbara C,
Grigioni W, Mazziotti A, et al. Natural history of small untreated hepatocellular
carcinoma: a multivariate analysis of prognostic factors of tumor growth rate and
patient survival. Hepatology 1992; 16: 132- 137
-
Okuda K, Ohtsuki T, Obata H, Tomimatsu M, Okazaki N, Hasegawa H, Nakajima Y,
Ohnishi K. Natural history of hepatocellular carcinoma and prognosis in relation to
treatment. Study of 850 patients. Cancer 1985; 56: 918-928.
-
Gondolesi G, Muñoz L, Matsumoto C, Fishbein T, Sheiner P, Emre S, Miller C,
Schwartz M. Hepatocellular Carcinoma: A prime indication for living donor liver
trasplantation. J Gastrointestinal Surg 2002, 6:102-107.
-
Llovet JM, Bustamante J, Castells A, Vilana R, Ayuso Md, Sala M, Bru C, Rodes J,
Bruix J. Liver trasplantation for hepatocellular carcinoma. Results of a restrictive policy.
Hepatology 1996; 24: 350A
-
Miller C, Gondolesi G, Florman S, Muñoz L, Matsumoto C, Yoshizumi T, Artis T,
Fishbein P, Sheiner P, Kim-Shluger L, Schiano T, Emre S, Schwartz M. One hundred and
nine living donor liver trasplants in Adults and Children. A single center experience.
Annals of Surgery 2001; 234:301-312.
-
Kaihara S, Kiuchi T, Ueda M, et al. Living-donor liver trasplantation for
hepatocellular carcinoma. Transplantation 2003; 75 ( suppl 3): S37.
-
Schiano T, Kim-Schluger, Gondolesi G, Miller C. Adult living donor liver
trasplantation: The hepatologist's perspective. Hepatology 2000; 33:3-10.
-
Ebara M, Ohto M, Shinagawa T, Sugiura N, Kimura K, Matsutani S, Morita M, Saisho
H, Tsuchiya Y, Okuda K. Natural history of minute hepatocellular carcinoma smaller
than three centimeters complicating cirrhosis: a study in 22 patients. Gastroenterology,
1986, 90: 289- 298.
-
Bismuth H, Chiche L, Adam R, Castaing D, Diamond T, Dennison A. Liver resection
versus trasplantation for hepatocellular carcinoma in cirrhotic patients. Ann Surg 1993;
218:145-151.
-
Tan K, Rela M, Ryder S, Rizzi P, Karani J, Portmann B, Heaton N, et al. Experience
of orthotopic liver trasplantation and hepatic resection for hepatocellular carcinoma less
than 8 cm in patients with cirrhosis. Br J Surg 1995; 82:253-256.
-
Yao F, Ferrel L, Bass N, Watson J, Bachetti P, Venook A, Ascher N, Roberts J. Liver
Transplantation for hepatocellular carcinoma : expansion of tumor size limits does not
adversely impact survival. Hepatology 2001; 33:1394-1403.
-
MorimotoT, Yamoaka Y, Tanaka K, Ozawa K. Quality of life among donors of liver
trasplants to relatives. N Engl J Med 1993;329:363-364.
-
Kim-Schluger L, Florman SS, Schiano T, Scheiner PA, Emre S, Fishbein T, et al.
Donor quality of life after adult liver trasplant donation. Transplantation, in press.
|



![]()

