El neumotórax espontáneo primario (NEP) es una entidad benigna, si bien con tendencia a la recidiva, que afecta con más frecuencia a un grupo de población en la tercera década de la vida, circunstancia que le confiere una particular repercusión económica y social.1 En España se comunicó una incidencia que oscila entre 7.4 y 28 varones por 100 000 habitantes/año y 1.2 a 10 mujeres por 100 000 habitantes/año.2 Por este motivo la evolución más reciente de las estrategias terapéuticas se ha dirigido, en gran medida, a la reducción no sólo del gasto sanitario derivado sino también del tiempo de convalecencia. Las principales sociedades científicas aconsejan3-5 el seguimiento ambulatorio de los pacientes asintomáticos con neumotórax de pequeña cuantía y la aspiración simple como tratamiento de primera línea para todos los NEP que requieran intervención, con la finalidad de evitar o reducir su estadía hospitalaria. Sin embargo, ninguna de estas medidas modifica el carácter recidivante del NEP al no actuar sobre su sustrato histopatológico: la bulla y el bleb subpleural.3 La incorporación, a principios de los ’90, de la cirugía videotoracoscópica (CVT) al arsenal terapéutico revolucionó el tratamiento quirúrgico del NEP, limitado hasta entonces por la elevada morbilidad asociada con el abordaje por toracotomía.6
La toracoscopia es una técnica surgida hace más de un siglo con un objetivo opuesto al que nos ocupa: producir un neumotórax con intención terapéutica. En 1882, al tiempo que Robert Koch descubría el bacilo causante de la tuberculosis, Forlanini7 publicó su descripción del neumotórax artificial, una forma de colapsoterapia de las cavernas tuberculosas, rápidamente difundida. Sin embargo, no tardó en constatarse el fracaso de la técnica en los numerosos casos en que la existencia de adherencias pleuropulmonares impedía el colapso pulmonar. Jacobaeus, empleando el galvanocauterio y un cistoscopio modificado, realizó la primera toracoscopia operadora para lisar estas adherencias. Jacobaeus no era cirujano, sino profesor de medicina interna, y publicó la descripción de su técnica por vez primera en 1910,8 si bien ésta alcanzó su máxima popularidad a partir de su presentación en los procedimientos de la Royal Society of Medicine de Londres en 1922 y 1923.9 Ya en 1937, Sattler10 describió el hallazgo endoscópico de bullas en un paciente con neumotórax espontáneo. La toracoscopia fue ampliamente difundida y aplicada al tratamiento de la tuberculosis por médicos de todo el mundo hasta que, en 1945, la introducción de la estreptomicina la relegó a un discreto uso diagnóstico.11
Las posibilidades de la toracoscopia “clásica” en el NEP se limitaban a la observación, la pleurodesis con talco y la electrocoagulación de los blebs. Sin embargo, la combinación de la técnica descrita por Jacobaeus en 1910 con las microcámaras de video que evolucionaron a lo largo de los ’80 dio origen, a comienzos de la década de los ’90, a la actual CVT,12 para la que pronto se encontraron múltiples aplicaciones,13 entre ellas, el tratamiento del neumotórax espontáneo.14 Simultáneamente, la comercialización de las primeras máquinas endocortadoras-grapadoras simplificó considerablemente la tarea.
Desde un principio la técnica se reveló como superior a la toracotomía posterolateral en cuanto a dolor posoperatorio, disfunción articular del hombro y disfunción ventilatoria temprana,15,16 e incluso en lo referente a la estadía hospitalaria.17 Sin embargo, estas ventajas no pudieron probarse frente a la toracotomía axilar descrita por Becker y Munro18 en los ’70, hasta entonces el abordaje de elección para muchos cirujanos. En la actualidad ambas técnicas proporcionan resultados similares, como puede comprobarse en el estudio publicado en 2004 por Freixinet y col.,19 con resultados cosméticos equiparables y un menor costo para la toracotomía axilar.20 Es precisamente en lo relativo a su costo-efectividad donde la CVT fracasó en demostrar una clara superioridad. En gran medida debido a la disparidad de criterios y resultados con que la técnica es empleada, a la ausencia de estudios controlados al respecto y, fundamentalmente, a la dificultad para analizar los costos indirectos, especialmente los extrahospitalarios, generados por los pacientes, sus familiares o la propia sociedad.21 La CVT presenta además un mayor índice de recidivas posoperatorias que la toracotomía.22
Sin embargo, y a pesar de lo anteriormente expuesto, la CVT es la técnica de elección para el tratamiento quirúrgico del NEP en nuestro Centro. De hecho, cerca de la mitad de las videotoracoscopias practicadas en España antes de 1998 lo fueron para el tratamiento del NEP.23 En contraste con la ausencia de evidencia científica definitiva a su favor3,5 existe un alto nivel de consenso entre los expertos a la hora de recomendar la CVT como técnica de primera línea para el tratamiento del NEP.4,5,17,24,25 Según la Normativa sobre diagnóstico y tratamiento del neumotórax26 de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR), la CVT es el tratamiento de elección en el NEP. En nuestra opinión, frente a la toracotomía axilar, la CVT permite una mejor exploración de toda la cavidad torácica, facilitando la identificación y resección de lesiones cuya localización es diferente de la apical.5,25 Estas lesiones, inadvertidas, podrían conducir al fracaso de la cirugía.27 Además, resulta más segura porque es más fácilmente reconvertible a una toracotomía posterolateral estándar si se produce alguna complicación grave. El procedimiento que nosotros empleamos consiste en la resección de blebs mediante endocortadoras28 (figura 1) y la abrasión pelural con torundas betadinadas29 (figura 2).
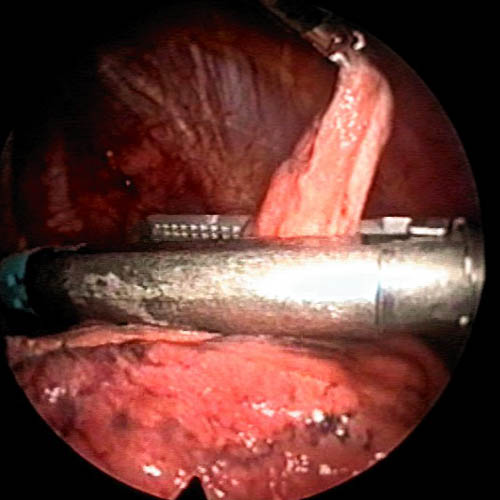
Figura 1. Imagen intraoperatoria endoscópica: resección de complejo distrófico-bulloso apical mediante endocortadora.
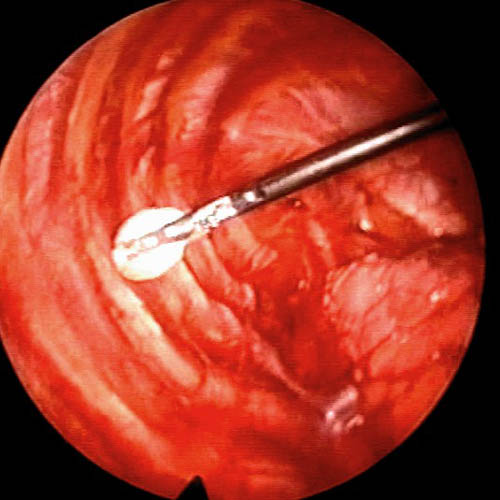
Figura 2. Imagen intraoperatoria endoscópica: abrasión pleural con torunda.
Pero si resulta discutida la elección de la técnica, mucho mayor es la polémica en torno del momento óptimo para su aplicación. Diversas guías clínicas3,26 indican la cirugía en el segundo NEP basándose en el riesgo estadístico de recidiva después de cada episodio. En otras palabras: después de un primer episodio de neumotórax lo más problable es que el paciente no presente una recidiva y por eso será suficiente el tratamiento conservador o el drenaje. Sin embargo, si ésta se produce (en la mayoría de los casos ocurrirá entre los 6 meses y los dos años siguientes),22 lo más probable es que el paciente presente un tercer neumotórax con posterioridad y por eso es preferible un procedimiento más definitivo que evite la recurrencia. Un planteamiento tan simple soporta la actitud de un buen número de cirujanos frente al NEP, posiblemente de una mayoría, pero no resulta en absoluto unánime: mientras algunos autores proponen la toracoscopia ya en el primer episodio,6,22,28,30 otros prefieren retrasarla hasta el tercero.31 En nuestra opinión, la indicación de la CVT exclusivamente basada en el riesgo de recidiva pasa por alto importantes consideraciones relativas a su costo-efectividad.
En 20041 dimos a conocer una revisión de 57 procedimientos practicados sobre 47 pacientes entre enero de 2001 y diciembre de 2002 en nuestro centro para el tratamiento quirúrgico del NEP. Los 57 casos fueron clasificados en dos grupos en función del momento de la cirugía. En un grupo –grupo sin retraso en la indicación de cirugía (no RIC)– se incluyeron todos los pacientes intervenidos en el primero (neumotórax contralateral) o segundo episodio sobre ese hemitórax, frente a los operados en el tercero o siguientes episodios, incluidos en el grupo con retraso en la indicación de cirugía (RIC) (figura 3). El 27.3% de los pacientes del grupo RIC fueron sometidos a una toracotomía frente a sólo un 2.2% de los casos en el grupo no RIC [p = 0.02 (prueba exacta de Fisher); odds ratio: 16.87; intervalo de confianza del 95%: (1.55-183.22)]. La toracotomía se practicó por indicación primaria en 1 de 57 (1.75%) casos y por reconversión de una toracoscopia en 3 (5.26%) casos (tabla 1). En los cuatro casos en que se empleó un abordaje por toracotomía éste fue motivado por la presencia de densas adherencias pleuropulmonares que no permitían el abordaje endoscópico, bien identificadas en el estudio radiológico preoperatorio (indicación primaria) o en la exploración endoscópica del tórax (reconversión de la técnica). En el primer caso se trataba de extensas adherencias a la pleura parietal que imposibilitaban una ubicación segura de los puertos, mientras que en los casos de reconversión se trataba de intensas adherencias a la pleura mediastínica, difícilmente accesibles al abordaje endoscópico sin producir una tracción excesiva sobre las estructuras mediastínicas subyacentes. El porcentaje de reconversión a toracotomía es un parámetro que evalúa la calidad de la técnica en la CVT y oscila en la literatura entre el 1% y el 10% para el tratamiento del NEP.22,25,28,32,33 En nuestra experiencia particular el porcentaje global de reconversiones se encuentra dentro de estos márgenes (5.4%) pero, mientras que en el grupo sin RIC resultó de 2.2%, en el grupo RIC ascendía hasta un 20% (p = 0.079). Todo lo anteriormente descrito nos llevó a concluir acerca de la necesidad de intervenir a los pacientes diagnosticados de NEP durante el primero (neumotórax contralateral) o segundo episodios sobre ese hemitórax, dado que el retraso de la cirugía condiciona un aumento en el número de toracotomías practicadas, impidiendo que estos pacientes se beneficien del abordaje mínimamente invasivo.
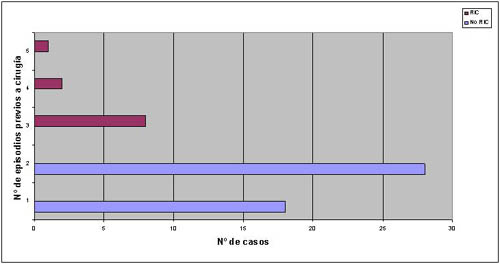
Figura 3. Distribución de los procedimientos quirúrgicos según el número de episodios sobre ese hemitórax. RIC: retraso en la indicación de cirugía.
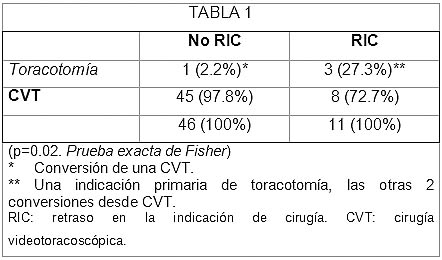
Tabla 1. Abordaje empleado en función del retraso en la indicación quirúrgica.
Ya en 1998 Waller y col.30 identificaron el RIC –en términos de intubación pleural prolongada o repetida en un mismo episodio– como un factor asociado al incremento en el porcentaje de toracotomías practicadas. Los 10 (24%) pacientes sometidos a toracotomía en su serie de 42 casos consecutivos presentaban un retraso significativamente mayor en la indicación de cirugía frente a los operados mediante CVT (22 días frente a 10 días; p < 0.05). Estos autores consideraron la sepsis pleural y el empiema como causa fundamental de fracaso del procedimiento endoscópico. Sin embargo, este grupo de pacientes fue excluido de nuestro estudio y por lo tanto nuestros hallazgos difícilmente podrían explicarse por mecanismos de infección pleural clínicamente identificables.
De Smedt y col.34 dieron a conocer en 2004 un interesante estudio en el que compararon el contenido celular y molecular del líquido de lavado pleural, biopsias pleurales y sangre periférica de pacientes intervenidos por NEP con controles sanos (pacientes intervenidos por hiperhidrosis esencial). El lavado pleural de los pacientes con NEP presentaba un incremento en todas las series leucocitarias pero, fundamentalmente, de eosinófilos y neutrófilos que, junto con los monocitos, también se encontraron incrementados en sangre periférica de estos pacientes. El tiempo durante el cual el aire permaneció en el espacio pleural se correlacionó positivamente con las cifras de eosinófilos en los tres tipos de muestra analizados. Asimismo, este grupo de pacientes presentaba una concentración elevada de proteína catiónica eosinofílica, interleuquina (IL) 5, IL-6, IL-8, IL-12p40, factor de necrosis tumoral alfa, proteína ligadora de lipopolisacárido y de la quimioquina RANTES en el lavado pleural. Estos hallazgos ponen de manifiesto la existencia de una reacción inflamatoria no sólo a nivel local, sino también sistémica que, en ausencia de un proceso infeccioso con trascendencia clínica, pondría en marcha mecanismos de activación fibroblástica que explicarían los hallazgos patológicos descritos en nuestro estudio. Los factores presentes en el NEP que inician esta respuesta son, por el momento, una incógnita, pero consideramos de gran importancia su identificación, pues permitiría la modulación de la respuesta inflamatoria pleural facilitándonos la obtención de pleurodesis más efectivas o, por el contrario, evitando la formación de adherencias pleuropulmonares posoperatorias en pacientes subsidiarios de múltiples reintervenciones, como es el caso de las metastasectomías pulmonares.
En un futuro próximo la aplicación de nuevos modelos matemáticos a los sistemas de gestión clínica nos proporcionará datos reveladores respecto del momento más adecuado para intervenir a los pacientes diagnosticados de NEP. Ya en 2003, empleando un modelo de análisis de decisiones,35 Falcoz y col.21 concluyeron que la CVT ofrece ventajas económicas sustanciales en el tratamiento del segundo episodio de NEP, frente a una ligera disminución en la efectividad, cuando se compara con el tratamiento conservador. Más allá de los resultados concretos, este tipo de estudios proporciona análisis de sensibilidad que permiten aplicar las conclusiones obtenidas en función de los resultados de cada centro. En una práctica clínica fundamentada en la toma de decisiones complejas el uso de estos métodos de análisis podría adquirir una utilidad creciente pues permiten integrar la evidencia médica disponible y las experiencias individuales al ponderar las distintas opciones terapéuticas.
En definitiva, la evidencia acumulada parece justificar la indicación de la CVT, al menos en el segundo episodio de NEP, y es de esperar que nuevos estudios confirmen estas conclusiones. Recientemente asistimos a la publicación de trabajos que analizan el costo-efectividad de la CVT en el primer episodio de NEP con resultados contradictorios,36,37 pero no nos debería sorprender una próxima ampliación de las indicaciones al primer episodio, como propugnan ya algunos autores.6,22,28,30 En la actualidad se acepta la CVT en el primer episodio en varios supuestos (tabla 2) entre los que se encuentran las profesiones de riesgo, como pilotos y buceadores,3,26 o, en nuestro entorno, marinos mercantes, pescadores de altura o empleados de plataformas petrolíferas que desempeñan su trabajo durante largas temporadas de aislamiento en altamar, e incluso gaiteros que no están en condiciones de afrontar los repetidos períodos de inactividad forzados por una convalecencia que supondría retrasos en su carrera. La presencia de blebs en la radiografía simple de tórax, tomografía computarizada o toracoscopia es también una indicación de CVT en el primer episodio para algunos autores,6,22,26 constituyendo éste un viejo debate38 que todavía sigue activo.

Tabla 2. Indicaciones de cirugía en el neumotórax espontáneo primario.
No nos cabe ninguna duda de que el tratamiento del NEP continuará evolucionando en los próximos años. El abordaje por una única incisión39 o la incorporación de la cirugía robotizada40-42 son solamente algunos ejemplos de los frentes abiertos que no debemos perder de vista, pues de ellos han de surgir las ideas que impulsen la evolución.
Para finalizar, tenemos que retomar el primer párrafo de este artículo y recordar que el NEP afecta a una población joven que, en nuestro medio, está en la mayor parte de los casos capacitada para comprender conceptos relativos al riesgo o la probabilidad y extraer sus propias conclusiones, por lo que constituye un sustrato óptimo para el ejercicio del consentimiento informado.43 Es nuestra obligación llevar adelante los estudios que nos permitan obtener la máxima información posible para optimizar los recursos sanitarios, pero también es nuestro deber ofrecer esta información a nuestros pacientes. En último caso son ellos los que deben valorar cada opción y elegir la que mejor se ajuste a su situación personal, familiar y sociolaboral.
BIBLIOGRAFÍA
1. Rivo JE, Cañizares MA, García-Fontán E, Albort J, Peñalver R. Cirugía del neumotórax espontáneo de repetición: ¿cuándo indicarla? Arch Bronconeumol 2004; 40:275-8.
2. Rivas J, Torres J, De la Torre M, Toubes ME. Neumotórax. En: Caminero JA, Fernández L, editores. Manual de neumología y cirugía torácica. Madrid: Editores Médicos 1998; p. 1721-37.
3. Henry M, Arnold T, Harvey J; Pleural Diseases Group, Standards of Care Committee, British Thoracic Society. BTS guidelines for the management of spontaneous pneumothorax. Thorax 2003; 58 Suppl 2:ii39-52.
4. Baumann MH, Strange C, Heffner JE y col. AACP Pneumothorax Consensus Group. Management of spontaneous pneumothorax: an American College of Chest Physicians Delphi consensus statement. Chest 2001; 119:590-602.
5. De Leyn P, Lismonde M, Ninane V y col. Guidelines Belgian Society of Pneumology. Guidelines on the management of spontaneous pneumothorax. Acta Chir Belg 2005; 105:265-7.
6. Sawada S, Watanabe Y, Moriyama S. Video-assisted thoracoscopic surgery for primary spontaneous pneumothorax. Evaluation of indications and long-term outcome compared with conservative treatment and open thoracotomy. Chest 2005; 127:2226-30.
7. Forlanini C. A contribuzioni della terapia chirurgica della tisi-Ablazione del polmone? Pneumotorace artificiale? Gazz Osp 1882; 3:537-9, 585-7, 601-2, 609-10, 617-9, 625-7, 641-3, 657-60, 665-7, 689-91, 705-7.
8. Jacobaeus HC. Ueber die Möglichkeit die Zystoskopie bei untersuchung seröser höhlungen anzuwenden. München Med Wochenschr 1910; 57:2090-2.
9. Jacobaeus HC. The cauterization of adhesions in artificial pneumothorax treatment of pulmonary tuberculosis under thoracoscopic control. Proc Roy Soc Med 1922-3; 16 (Part 1 & 2, Section of Electrotherapeutics):45-60.
10. Sattler A. Zur Behandlung der Spontanpneumothorax mit besonderer Berücksichtigung der Thorakoskopie. Beitr Klin Tuberk 1937; 89:394-408.
11. Braimbridge MV. The history of thoracoscopic surgery. Ann Thorac Surg. 1993; 56:610-4.
12. Levi JF, Kleinmann P, Riquet M, Debesse B. Percutaneous parietal pleurectomy for recurrent spontaneous pneumothorax. Lancet 1990; 336:1577-1578.
13. Landreneau RJ, Mack MJ, Hazelrigg SR y col. Video-assisted thoracic surgery: basic technical concepts and intercostal approach strategies. Ann Thorac Surg 1992; 54:800-7.
14. Waller DA, Forty J, Yoruk Y, Dark JH, Morrit GN. Videothoracoscopy in the tratment of spontaneous pneumothorax: an initial experience. Ann R Coll Surg Eng 1993; 75:237-40.
15. Landreneau RJ, Hazelrigg SR, Mack MJ y col. Postoperative pain-related morbidity: video-assisted thoracic surgery versus thoracotomy. Ann Thorac Surg 1993; 56:1285-9.
16. Landreneau RJ, Mack MJ, Hazelrigg SR y col. Prevalence of chronic pain after pulmonary resection by thoracotomy or video-assisted thoracic surgery. J Thorac Cardiovasc Surg 1994; 107:1079-85; discussion 1085-6.
17. Waller DA, Forty J, Morritt GN. Video-assisted thoracoscopic surgery versus thoracotomy for spontaneous pneumothorax. Ann Thorac Surg 1994; 58:372-7.
18. Becker RM, Munro DD. Transaxillary minithoracotomy: the optimal approach for certain pulmonary and mediastinal lesions. Ann Thorac Surg 1976; 22:254-9.
19. Freixinet JL, Canalis E, Julia G, Rodríguez P, Santana N, Rodríguez de Castro F. Axillary thoracotomy versus videothoracoscopy for the treatment of primary spontaneous pneumothorax. Ann Thorac Surg 2004; 78:417-20.
20. Kim KH, Kim HK, Han JY, Kim JT, Won YS, Choi SS. Transaxillary minithoracotomy versus video-assisted thoracic surgery for spontaneous pneumothorax. Ann Thorac Surg 1996; 61:1510-2.
21. Falcoz PE, Binquet C, Clement F y col. Management of the second episode of spontaneous pneumothorax: a decision analysis. Ann Thorac Sug 2003; 76:1843-8.
22. Sahn SA, Heffner JE. Spontaneous pneumothorax. N Engl J Med 2000; 342:868-74.
23. Rivas De Andres JJ, Freixinet Gilart J, Rodriguez De Castro F. Estudio multicéntrico español de cirugía videotoracoscópica. Arch Bronconeumol 2002; 38:60-3.
24. Dumon P, Diemont F, Massard G, Toumieux B, Wihlm JM, Morand G. Does a Thoracoscopic approach for surgical treatment of spontaneous pneumothorax represent progress? Eur J Cardiothorac Surg 1997; 11:27-31.
25. Galbis JM, Mafé JJ, Benlloch S, Baschwitz B, Rodríguez JM. Cirugía videotoracoscópica en el tratamiento de los neumotórax: consideraciones sobre 107 procedimientos consecutivos. Arch Bronconeumol 2003; 39:310-3.
26. Grupo de Trabajo SEPAR. Normativa sobre diagnóstico y tratamiento del neumotórax. Arch Bronconeumol 2002; 38:589-95.
27. Yim APC, Ng CS. Thoracoscopic management of spontaneous pneumothorax. Curr Opin Pulm Med 2001; 7:210-214.
28. Luh SP, Tsai TP, Chou MC, Yang PC, Lee CJ. Video-assisted thoracic surgery for spontaneous pneumothorax: outcome of 189 cases. Int Surg 2004; 89:185-9.
29. Estrada G, Farina C, Fibla JJ, Gómez G, Unzueta MC, León C. Neumotórax espontáneo: sínfisis pleural con solución hidroalcohólica de povidona yodada. Arch Bronconeumol 2003; 39:171-4.
30. Waller DA, McConnell SA, Rajesh PB. Delayed referral reduces the success of video-assisted thoracoscopic surgery for spontaneous pneumothorax. Respir Med 1998; 92:246-9.
31. Weissberg D, Refaely Y. Pneumothorax: experience with 1,199 patients. Chest 2000; 117:1279-85.
32. Freixinet J, Canalis E, Rivas JJ y col. Surgical tratment of primary spontaneous pneumothorax with video-assisted thoracic surgery. Eur Respir J 1997; 10:409-11.
33. Elfeldt RJ, Thies J, Schroeder DW. Thoracoscopic resection of parenchymal blebs in spontaneous pneumothorax. Indications, operative management and results. Scand J Thorac Cardiovasc Surg 1995; 29:75-8.
34. De Smedt A, Vanderlinden E, Demanet C, De Waele M, Goossens A, Noppen M. Characterisation of pleural inflammation occurring after primary spontaneous pneumothorax. Eur Respir J 2004; 23:896-900.
35. Weinstein M, Fineberg H. Clinical Decision analysis. Philadelphia: WB saunders, 1980.
36. Morimoto T, Shimbo T, Noguchi Y y col. Effects of timing of thoracoscopic surgery for primary spontaneous pneumothorax on prognosis and costs. Am J Surg 2004; 187:767-74.
37. Qureshi FG, Sandulache VC, Richardson W, Ergun O, Ford HR, Hackam DJ. Primary vs delayed surgery for spontaneous pneumothorax in children: which is better? J Pediatr Surg 2005; 40: 166-169.
38. Rivas JJ, Torres J. Thoracoscopy and spontaneous pneumothorax. Ann Thorac Surg 1993; 55:811.
39. Jutley RS, Khalil MW, Rocco G. Uniportal vs standard three-port VATS technique for spontaneous pneumothorax: comparison of post-operative pain and residual paraesthesia. Eur J Cardiothorac Surg 2005; 28:43-6.
40. Morgan JA, Ginsburg ME, Sonett JR y col. Advanced thoracoscopic procedures are facilitated by computer-aided robotic technology. Eur J Cordiothorac Surg 2003; 23:883-7.
41. Bodner J, Wykypiel H, Wetscher G, Schmid T. First experiences with the da Vinci operating robot in thoracic surgery. Eur J Cardiothorac Surg 2004; 25:844-51.
42. Kernstine KH. Robotics in thoracic surgery. Am J Surg 2004; 188:89S-97S.
43. Ruhnke GW, Wilson SR, Akamatsu T, Kinoue T, Takashima Y, Goldstain MK. Ethical decision making and patient autonomy. Chest 2000; 118:1172-1182.
|



![]()

