Introducción
La enfermedad pulmonar obstructiva crónica (EPOC) es una de las causas más
frecuentes de mortalidad y morbilidad en todo el mundo y supone una importante
carga económica para la sociedad. En España se estima una prevalencia de 9.1%
en la población de 40 a 70 años, con una relación hombre/mujer de 4:1.
Representa la cuarta causa de mortalidad, con una tasa global de 33 por 100 000
habitantes, que se eleva a 176 por 100 000 habitantes en los sujetos mayores de
75 años. Es causante del 35% de las consultas externas en neumología y supone
unas 39 000 hospitalizaciones al año.1,2
Según las previsiones de la Organización Mundial de la Salud la prevalencia de la
EPOC y la mortalidad debida a ella seguirán en aumento en los próximos años. Se
calcula que para 2020 la EPOC pasará a ser la quinta enfermedad más frecuente del
mundo y la tercera causa más frecuente de muerte. Las razones por las que se
calcula este incremento son la reducción de la mortalidad por otras causas junto
con un aumento del consumo de tabaco y de la contaminación medioambiental en
países industrializados.3
Aunque no hay una definición universalmente aceptada de EPOC, la mayoría de las
definiciones actuales contienen los mismos elementos clave. La definición de la
Global Initiative for Chronic Obstructive Lung Disease
(GOLD) ha ganado aceptación: "La EPOC es un estado de enfermedad
caracterizado por una limitación al flujo aéreo que no es totalmente reversible. Esta
obstrucción es habitualmente progresiva y asociada a una respuesta inflamatoria
anómala de los pulmones a partículas nocivas o gases".4
El curso progresivo y crónico de la enfermedad a menudo se ve agravado por
períodos de aumento de los síntomas, particularmente de la tos, la disnea y la
cantidad y purulencia del esputo. Estos episodios de incremento de la
sintomatología son lo que se conoce como agudizaciones o exacerbaciones, las
cuales constituyen un acontecimiento frecuente en la historia natural de los
pacientes con EPOC y son el motivo más frecuente de consultas médicas, ingresos
hospitalarios y muerte. Recientemente se propuso la siguiente definición de
agudización de la EPOC: un empeoramiento mantenido de las condiciones basales
del paciente más allá de las variaciones diarias, de comienzo agudo y que necesita
un cambio en la medicación habitual en un paciente con EPOC.5 Los
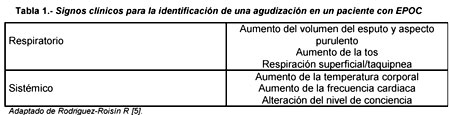
aspectos clínicos que deberían ser evaluados ante la sospecha de agudización se
muestran en la tabla 1.
Entre 50% y 75% de las exacerbaciones de la EPOC son de causa infecciosa. En
algo más de la mitad de éstas el agente etiológico es bacteriano, principalmente
Haemophilus influenzae, Streptococcus pneumoniae y Moraxella
catarrhalis. El resto de las agudizaciones infecciosas son causadas por virus,
Chlamydia pneumoniae o, excepcionalmente, por otros microorganismos.
En el paciente con EPOC grave con exacerbación que requiere ventilación mecánica
la infección puede ser causada por un bacilo gramnegativo (Pseudomonas).
En 25% a 50% de los episodios de exacerbación no se demuestra etiología
infecciosa.2
Para estratificar la gravedad de la agudización se diseñaron escalas. En la escala
desarrollada por Anthonisen y col.6 y adoptada por el American
College of Chest Physicians, el American College of Physicians y la
American Society of Internal Medicine,7 se establece una
estratificación de la gravedad de la agudización en función de parámetros clínicos
(tabla 2), mientras que en la desarrollada por el International Consensus
Group5 se valora el nivel de los servicios de salud utilizados
(tabla 3).


Tratamiento
El tratamiento de la EPOC agudizada está dirigido a revertir el episodio de
insuficiencia respiratoria aguda, tratar la causa responsable de la exacerbación y
evitar las complicaciones. El tratamiento de la insuficiencia respiratoria aguda se
centrará en dos aspectos fundamentales: mejorar la oxigenación arterial (y
presumiblemente tisular) y evitar la acidosis arterial (y presumiblemente
celular).2
Oxígeno
El tratamiento inicial incluye suplementos de oxígeno para intentar conseguir
una saturación arterial de oxígeno (SaO2) de 90% a 92% y una
PaO2 de 60 a 65 mm Hg.8 La administración de
oxígeno puede realizarse mediante sistemas de flujo bajo y de flujo alto. Con los
sistemas de flujo bajo se administra oxígeno al 100% a flujos de 1 a 6 l/min a la
nasofaringe, la cual actúa como reservorio. Cada incremento en el flujo de
O2 de 1 l/min incrementa en un 4% la fracción inspirada de oxígeno
(FiO2), pero es importante tener en cuenta que en un sistema de
flujo bajo la FiO2 varía con los cambios en el volumen corriente
(VT), la frecuencia respiratoria y el volumen minuto
(VE). Cuando se incrementa el flujo por encima de 6 l/min se reduce
la tolerancia, sin conseguir un incremento de la FiO2 por encima del
44%. Los sistemas habitualmente utilizados son mascarillas simples, mascarillas
con reservorio y cánulas nasales.
En los sistemas de flujo alto la FiO2 es independiente del patrón
ventilatorio, por lo que tienen la ventaja de suministrar valores constantes y
predecibles. La mayor parte de estos sistemas utilizan un método de atrapamiento
de gases para ofrecer una FiO2 conocida, tradicionalmente llamados
dispositivos Venturi, regidos por el principio de Bernouilli, que establece que una
velocidad rápida del gas que sale por un orificio limitado creará presiones laterales
subatmosféricas que harán que el aire atmosférico sea atrapado en la corriente
principal. En la mascarilla Venturi, el chorro de gas que entra en el sistema es
oxígeno y la cantidad de aire ambiente que penetra determina la
FiO2.
Una minoría de pacientes con agudización presentan incrementos en la
PaCO2 con la administración de oxígeno; por tanto se debe vigilar la
posible acidosis respiratoria como complicación de la oxigenoterapia inapropiada. El
sistema Venturi es el método preferido de administración de oxígeno en los
pacientes con EPOC agudizada puesto que permite regular la FiO2
administrada con vistas a evitar hipercapnia y acidosis respiratoria.
La pulsioximetría –técnica basada en los principios físicos de absorción de la luz– es
un sistema de monitorización de gran ayuda para la medición continua, incruenta y
en tiempo real de la SaO2. A pesar de la ayuda que ofrece, deben
conocerse sus limitaciones; no es un reemplazo de las medidas de gases
sanguíneos, puesto que no nos ofrece la medida del estado del equilibrio ácido-base
y ventilatorio; cualquier hecho que reduzca significativamente la perfusión
(situaciones de bajo gasto cardíaco, hipotermia o vasoconstricción) reducirá la
capacidad para calcular la SaO2 y la presencia de
carboxihemoglobina sobreestimará el valor de la SaO2. La anemia y
la hiperbilirrubinemia, sin embargo, no afectan la exactitud de la
medida.9
Tratamiento farmacológico
Las actuales evidencias muestran que los agonistas β2-
adrenérgicos inhalados (albuterol, fenoterol, metaproterenol, terbutalina) y los
anticolinérgicos (bromuro de ipratropio) pueden mejorar el flujo aéreo durante la
agudización. La administración de un broncodilatador puede aumentar el volumen
espiratorio forzado en el primer segundo (FEV1) y la capacidad vital
forzada en 15% a 29% en un período de 60 a 120 minutos.8
Estudios aleatorizados muestran que los agonistas β2-
adrenérgicos y los anticolinérgicos inhalados tienen eficacia similar para el
tratamiento de las agudizaciones y ambos son más efectivos que los
broncodilatadores administrados por vía parenteral.7 Factores como
el tiempo en conseguir el efecto pico (ligeramente más rápido con los agonistas
β2-adrenérgicos) y la frecuencia de efectos adversos
(generalmente más ligeros con anticolinérgicos) pueden influir la elección de un
agente para un paciente determinado.8 Aunque a menudo se
combinan agonistas β2-adrenérgicos con bromuro de
ipratropio, los datos disponibles hasta el momento muestran sólo beneficios
mínimos con esta asociación.10
El beneficio de la administración de metilxantinas como terapia broncodilatadora
adicional permanece sin aclarar. En tres estudios aleatorizados11-13
la administración de aminofilina intravenosa no se tradujo en una mejoría en las
pruebas de función respiratoria, no produjo beneficio clínico aparente ni redujo la
probabilidad de volver a consultar al servicio de urgencias. Sin embargo, la
administración de aminofilina se asoció con aumento de efectos adversos,
especialmente náuseas y vómitos. En uno de ellos11 los pacientes
tratados con aminofilina en el servicio de urgencias tuvieron una tasa de
hospitalización 70% inferior a la del grupo control. La elevada frecuencia de efectos
secundarios en pacientes tratados con aminofilina, combinada con su cuestionable
beneficio, disminuyeron significativamente el uso de este fármaco.
Seis estudios aleatorizados con control placebo demostraron que una pauta corta
de corticoides sistémicos administrados a pacientes con EPOC agudizado mejoran la
espirometría y disminuyen la tasa de recaídas.7 En el estudio
aleatorizado, a doble ciego controlado con placebo más amplio llevado a cabo hasta
la fecha, el Systemic corticosteroids in COPD exacerbations
(SCOPE),14 271 pacientes ingresados por EPOC agudizada
fueron asignados a recibir placebo o metilprednisolona i.v. durante 3 días, seguidos
de prednisona oral. Para el grupo de corticoides combinados, el riesgo de fracaso de
tratamiento se redujo un 10% (33% vs. 23%) y el FEV1
mostró una mejoría en aproximadamente 0.1 litro como media en los primeros 3
días de tratamiento. No se demostró superioridad de una pauta de 8 semanas
frente a una pauta de 2 semanas (125 mg de metilprednisolona i.v. cada 6 horas
[días 1 a 3]; prednisona oral, 60 mg/día [días 4 a 7]; prednisona oral, 40 mg/día
[días 8 a 11], y prednisona oral, 20 mg/día [días 12 a 15]). El efecto adverso más
frecuentemente asociado con la pauta de corticoides sistémicos fue la
hiperglucemia. No se describió si ésta fue más frecuente en la pauta de 8 semanas
o en la de 2 semanas.
La implicación de las infecciones bacterianas como causa de la agudización en la
EPOC apoya el uso de antibióticos, aunque no existen estudios en pacientes
críticos.7 Se observó, sin embargo, que el beneficio parece ser
mayor en los pacientes con agudizaciones más graves.6 Dos
recientes metaanálisis15,16 apoyan el uso de antibióticos en la EPOC
agudizada cuando existe esputo purulento. La elección de uno u otro antibiótico
deberá realizarse en función de la sensibilidad local y dirigida a los gérmenes más
frecuentemente responsables de las exacerbaciones (S. pneumoniae, H.
influenzae y M. catharralis). En pacientes críticos y con factores de
mal pronóstico (FEV1 basal < 50% del valor teórico, comorbilidad o
tres o más agudizaciones en los últimos 12 meses) debe considerarse el uso de
antibióticos contra gramnegativos (Pseudomonas).10
Ventilación mecánica en la EPOC agudizada
a) Ventilación mecánica no invasiva (VMNI)
La VMNI ha tenido una gran aceptación para el tratamiento de la EPOC agudizada
en los últimos años. Distintos trabajos17-22 pusieron de manifiesto
que la VMNI reducía la necesidad de intubación endotraqueal, mejoraba la
supervivencia y disminuía las complicaciones en estos pacientes. Aunque algunos
de estos estudios fueron cuestionados por defectos metodológicos, otros apoyaron
estas conclusiones. Plant y col.23 llevaron a cabo un amplio ensayo
multicéntrico utilizando estrictos criterios de inclusión en el que 236 enfermos con
EPOC e insuficiencia respiratoria aguda (con pH > 7.25) fueron aleatorizados para
recibir VMNI en sala general o terapia estándar; arribaron a la conclusión de que la
mortalidad en el grupo de estudio fue significativamente menor que en el grupo
control. Dos recientes metaanálisis24,25 pusieron de manifiesto los
beneficios de la VMNI en la agudización de la EPOC. Lightowler y
col.24 concluyeron que los pacientes que recibieron VMNI tuvieron
menor riesgo de fracaso del tratamiento que quienes fueron tratados con terapia
convencional y que la VMNI disminuía significativamente el riesgo de mortalidad.
Fernández y col.,25 en un metaanálisis dirigido a valorar la eficacia
de la VMNI en la EPOC y evaluar las posibles diferencias de sus resultados en
función del lugar de aplicación, concluyeron que la VMNI es una técnica eficaz en el
tratamiento de la insuficiencia respiratoria aguda hipercápnica en pacientes con
EPOC en términos de reducción de mortalidad y necesidad de intubación, tanto en
estudios realizados en UCI como en sala general. Aunque la técnica parece más
eficaz aplicada en la UCI, este aspecto puede estar relacionado con la mayor
gravedad de estos pacientes o con el mayor rigor de los cuidados médicos y de
enfermería aplicados en las UCI. La VMNI reduce la estancia media cuando se aplica
en la UCI, sin que se tengan datos definitivos sobre este resultado en sala
general.
En los pacientes con EPOC agudizada y un rápido y progresivo deterioro clínico se
debe considerar la VMNI para prevenir el agotamiento de la musculatura
respiratoria, el mayor deterioro de intercambio gaseoso y la intubación
endotraqueal. Las contraindicaciones para la aplicación de VMNI son: inestabilidad
hemodinámica, paro respiratorio, mal control de la vía aérea e imposibilidad de
aclarar secreciones, agitación o encefalopatía, falta de colaboración, sangrado
digestivo, alto riesgo de aspiración y alteraciones faciales que interfieran con el
adecuado ajuste de la mascarilla.26
b) Ventilación mecánica invasiva (VMI)
Los pacientes con EPOC agudizada grave que no son candidatos o no responden a
la VMNI requerirán intubación endotraqueal y VMI. Los objetivos del soporte
ventilatorio invasivo son mantener en reposo la musculatura respiratoria mientras
se espera la resolución del problema de base y la evolución del tratamiento
farmacológico y a la vez prevenir la hiperinsuflación dinámica y la alcalosis
poshipercápnica.
Debido a que estos pacientes presentan obstrucción al flujo aéreo, existe un
enlentecimiento del flujo espiratorio y un retraso del vaciamiento alveolar. La
aplicación de VMI con un elevado VT y una elevada frecuencia
respiratoria producirá hiperinsuflación pulmonar dinámica y aumento de la presión
alveolar al final de la espiración, concepto conocido como presión positiva intrínseca
al final de la espiración (PEEPi), auto-PEEP o PEEP oculta, que constituye un
importante efecto deletéreo de la VMI en los enfermos con EPOC. Los efectos
derivados de ella incluyen: aumento del trabajo respiratorio, barotrauma y
deterioro hemodinámico.
Los determinantes de la auto-PEEP son volumen minuto (VE),
VT, tiempo espiratorio (TE) y gravedad de la
obstrucción de las vías aéreas. Los parámetros ventilatorios iniciales se centrarán
en reducir la hiperinsuflación pulmonar dinámica mediante la limitación del
VE utilizando valores apropiados de VT
y frecuencia respiratoria y prolongando el TE. Parámetros
iniciales compuestos por FiO2 = 100%, VT = 5 a 8
ml/kg, frecuencia respiratoria = 8 a 10 respiraciones/minuto y flujo inspiratorio de
70 a 80 litros/minuto pueden considerarse adecuados. Los ajustes posteriores se
efectuarán en función de los niveles de auto-PEEP detectados y en función de la
gasometría de control. La utilización de un nivel de PEEP extrínseca a un nivel
menor del 85% de la auto-PEEP medida puede disminuir el umbral de esfuerzo
inspiratorio y favorecer el impulso ventilatorio y la comodidad en un paciente
despierto sin aumentar la hiperinsuflación pulmonar
dinámica.9,27
Recomendaciones
Las recomendaciones para el tratamiento de la EPOC agudizada están basadas
fundamentalmente en consensos de grupos de expertos debido a la escasez de
estudios prospectivos aleatorizados. Las recomendaciones de las sociedades y
grupos de mayor difusión2,4,7,28-30 se muestran en la tabla
4.
Tabla 4
Pronóstico de la EPOC agudizada
La EPOC es una enfermedad caracterizada por una larga evolución y un
deterioro gradual en la función respiratoria durante un periodo de años tras el
comienzo de la sintomatología. Más del 50% de los pacientes que ingresan por
agudización necesitan rehospitalización durante los siguientes 6 meses y el
pronóstico parece estar determinado más por la gravedad de la enfermedad de
base que por los factores asociados con el período agudo de hospitalización. La
mortalidad de los pacientes ingresados por agudización en el hospital es de 3% a
4% pero ésta se incrementa en aquellos ingresados en la UCI y que requieren VMI.
El pronóstico en esos casos es un aspecto poco conocido entre los clínicos, como lo
muestra el trabajo de Pearlman y col.,31 quienes evaluaron el
pronóstico emitido por médicos en relación con pacientes con EPOC y los factores
que a su juicio tendrían influencia sobre el resultado tras un episodio de VMI. Se
observó una amplia heterogeneidad en las estimaciones de los médicos y éstas
estuvieron más influidas por los datos sociales que por factores fisiológicos.
La VMI es requerida como tratamiento de soporte entre 43% y 74% de los
pacientes con EPOC e insuficiencia respiratoria aguda.32 Los
trabajos que evaluaron el resultado en los pacientes con EPOC agudizada que
requieren VMI muestran importantes diferencias en la mortalidad, atribuible a la
heterogeneidad entre los grupos estudiados, como diferencias en la gravedad de la
enfermedad, ausencia de indicaciones estandarizadas para la aplicación de VMI y la
inclusión de pacientes con causas de insuficiencia respiratoria aguda diferentes de
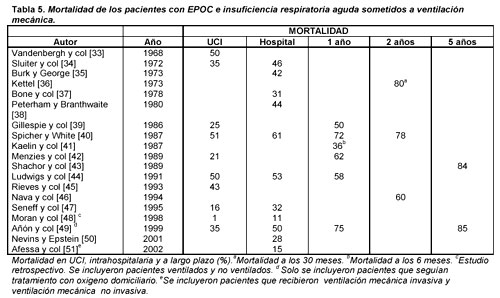
la agudización de la EPOC. Si se asumen estas limitaciones, la mortalidad en la UCI
se cifra entre 1% y 51%.33-51 La mortalidad valorada a largo plazo
es igualmente variable y se sitúa hasta en 85% a los 5 años en grupos
seleccionados de mayor gravedad (tabla 5).
Variables asociadas al pronóstico
Más importante que los valores absolutos de mortalidad es la identificación de
los factores asociados al pronóstico. No son muchos los trabajos dirigidos a
identificar elementos de predicción del resultado en pacientes con EPOC agudizada,
pero la heterogeneidad de los grupos estudiados, así como la heterogeneidad entre
las variables evaluadas y los diferentes resultados obtenidos hacen que el análisis
sea complejo.
Aunque clásicamente se identificó la VMI como factor relacionado con peor
resultado,40 estudios posteriores concluyeron que la ventilación
mecánica no es por sí misma un factor asociado independientemente con menor
supervivencia hospitalaria o durante un período de varios meses tras el
alta.51 Más bien, su necesidad selecciona enfermos que sufren
insuficiencia respiratoria más grave y, por tanto, presentan mayor
mortalidad.34,52
También clásicamente se identificó el valor del pH como una variable importante
asociada a la mortalidad.53,54 Este valor pronóstico, no confirmado
en estudios posteriores, fue subrayado en un reciente estudio en el que se vio que
los pacientes con EPOC e insuficiencia respiratoria aguda que presentaban pH de
7.21 tenían una mortalidad significativamente mayor que aquellos con pH de
7.25.51
En trabajos en los que se evaluó la asociación de sistemas de puntuación general
como SAPS (Simplified acute physiology score), APACHE (Acute
physiology and chronic health evaluation), entre otros, en grupos específicos
de enfermedades, no se les encontró valor pronóstico. Los índices de gravedad
generales suelen ser muy específicos pero no muy sensibles y clásicamente no se
recomiendan para establecer predicciones en grupos específicos de enfermedades.
Sin embargo, recientemente se encontró asociación entre la mayor puntuación de
APACHE II, el número de órganos disfuncionales y la incidencia de sepsis con la
mortalidad.51
Otras variables relacionadas con el pronóstico son: la edad,47,55,56
los valores bajos de FEV1,42,49,56 la
hipoalbuminemia,42,49,55,57 la hiponatremia,49,57
el valor del cociente PaO2/FiO2, índice de masa
corporal, cor pulmonale,55 estado funcional,33-
35,42,55 infiltrados pulmonares en la radiografía de tórax en el momento
de la intubación45 y comorbilidad.56
En resumen, en la actualidad no es posible predecir el curso clínico de pacientes
con EPOC debido a la variabilidad de la enfermedad y a las limitaciones de los
trabajos que estudiaron las posibles variables de predicción: ausencia de estrictos
criterios de selección, falta de una definición uniforme de insuficiencia respiratoria
aguda, falta de uniformidad de criterios para la aplicación de ventilación mecánica,
falta de uniformidad de criterios en cuanto a las variables estudiadas,
heterogeneidad de las muestras estudiadas y, finalmente, diferencias importantes
en el tiempo entre los estudios, que hacen que las comparaciones entre ellos sean
limitadas, por razones obvias (por ej.: avances en el tratamiento intensivo y en las
modalidades ventilatorias producidos en los últimos años). Aun teniendo en cuenta
la importancia de ciertas variables (por ej.: el valor de FEV1 como
indicador de la gravedad de la obstrucción al flujo aéreo), ninguna parece adecuada
para identificar las posibilidades de supervivencia de un paciente con EPOC e
insuficiencia respiratoria aguda. Se necesitan estudios con poblaciones homogéneas
y criterios de inclusión estrictos para identificar factores con capacidad de
predicción del resultado en los enfermos con EPOC agudizado grave y que puedan
ser de ayuda en la identificación de grupos de pacientes con diferente
pronóstico.
Hasta el momento sólo podemos afirmar que no existe evidencia científica que
avale la restricción del ingreso en los servicios de cuidados intensivos a los
pacientes con EPOC agudizado que necesiten ventilación mecánica. El deseo del
propio paciente es el único factor que puede influir negativamente en su ingreso y
esta decisión debe estar basada en una correcta información proporcionada por su
médico responsable. Otros aspectos que puedan influir negativamente en el ingreso
(por ej.: irreversibilidad de enfermedades asociadas) deberán seguir los mismos
criterios de actuación que los utilizados con otro tipo de pacientes ingresados en la
UCI.
Los autores no manifiestan conflictos.
BIBLIOGRAFÍA
-
Sobradillo V, Miravitlles M, Gabriel R, y col. Geographical variations in
prevalence and underdiagnosis of COPD. Results of the IBERPOC multicentre
epidemiological study. Chest 2000;118:981-989.
-
Barberá JA, Peces-Barba G, Agustí AGN, y col. Guía clínica para el diagnóstico y
el tratamiento de la enfermedad pulmonar obstructiva crónica. Arch Bronconeumol
2001;37:297-316.
-
Barnes PJ. Chronic Obstructive Pulmonary Disease. N Engl J Med 2000;343:
269-280.
-
Pauwels RA, Buist AS, Calverley PM, Jenkins CR, Hurd SS. Global strategy for
the diagnosis, management, and prevention of chronic obstructive pulmonary
disease: NHLBI/WHO Global Initiative for Chronic Obstructive Lung Disease (GOLD)
Workshop summary. Am J Respir Crit Care Med 2001;163:1256-1276
-
Rodríguez Roisin R. Toward a consensus definition for COPD exacerbation.
Chest 2000;117:398S-401S.
-
Anthonisen NR, Manfreda J, Warren CPW, y col. Antibiotic therapy in
exacerbations of chronic obstructive pulmonary disease. Ann Intern Med 1987;
106:196–204.
-
Snow V, Lascher S, Mottur-Pilson C. Joint Expert Panel on COPD of the
American College of Chest Physicians and the American College of Physicians-
Amercian Society of Internal Medicine. The evidence base for management of acute
exacerbations of COPD: clinical practice guideline, part 1. Chest 2001;119:1185-
1189.
-
Stoller JK. Acute exacerbations of Chronic Obstructive Pulmonary Disease. N
Engl J Med 2002;346:988-994.
-
Añón JM, García de Lorenzo A, Alvarez-Sala R, Escuela MP. Tratamiento y
pronóstico de la reagudización grave en la enfermedad pulmonar obstructiva
crónica. Rev Clin Esp 2001;201:658-666.
-
Heffner JE, Highland KB. Chronic Obstructive Pulmonary Disease in geriatric
critical care. Crit Care Clin 2003;19:713-727.
-
Wrenn K, Slovis CM, Murphy F, Greenberg RS. Aminophylline therapy for acute
bronchospastic disease in the emergency room. Ann Intern Med 1991;115:241-
247.
-
Rice KL, Leatherman JW, Duane PG, y col. Aminophylline for acute
exacerbations of chronic obstructive pulmonary disease: a controlled trial. Ann
Intern Med 1987;107:305-309.
-
Seidenfeld JJ, Jones WN, Moss RE, Tremper J. Intravenous aminophylline in the
treatment of acute bronchospastic exacerbations of chronic obstructive pulmonary
disease. Ann Emerg Med 1984;13:248-252.
-
Niewoehner DE, Erbland ML, Deupree RH, y col. Effect of systemic
glucocorticoids on exacerbations of chronic obstructive pulmonary disease. N Engl J
Med 1999;340:1941-1947.
-
Saint S, Bent S, Vittinghoff E, Grady D. Antibiotics in chronic obstructive
pulmonary disease exacerbations: a meta-analysis. JAMA 1995;273:957-960.
-
McCrory DC, Brown C, Gelfand SE, Bach PB. Management of exacerbations of
COPD: a summary and appraisal of the published evidence. Chest 2001;119:1190-
1209.
-
Bott J, Carroll MP, Conway JH, y col. Randomised controlled trial of nasal
ventilation in acute ventilatory failure due to chronic obstructive airways
disease.Lancet 1993;341:1555-1557.
-
Brochard L, Mancebo J, Wysocki M, y col. Noninvasive ventilation for acute
exacerbations of chronic obstructive pulmonary disease. N Engl J Med 1995;
333:817-822.
-
Kramer N, Meyer TJ, Meharg J, y col. Randomized, prospective trial of
noninvasive positive pressure ventilation in acute respiratory failure. Am J Respir
Crit Care Med 1995;151:1799–1806
-
Keenan SP, Kenerman PD, Cook DJ, Martin CM, McCormack D, Sibbald WJ.
Effect of noninvasive positive pressure ventilation on mortality in patients admitted
with acute respiratory failure: a metaanalysis. Crit Care Med 1997;25:1685-1692.
-
Celikel T, Sungur M, Ceyhan B, Karakurt S. Comparison of noninvasive positive
pressure ventilation with standard medical therapy in hypercapnic acute respiratory
failure. Chest 1998;114:1636-1642.
-
Keenan SP, Gregor J, Sibbald WJ, Cook DJ, Gafni A. Noninvasive positive
pressure ventilation in the setting of severe, acute exacerbations of chronic
obstructive pulmonary disease: more effective and less expensive. Crit Care Med
2000;28:2094-2102.
-
Plant PK, Owen JL, Elliott MW. Early use of non-invasive ventilation for acute
exacerbations of chronic obstructive pulmonary disease on general respiratory
wards: a multicentre randomised controlled trial. Lancet 2000;355:1931-1935.
-
Lightowler JV, Wedzicha JA, Elliott MW, Ram FS. Non-invasive positive pressure
ventilation to treat respiratory failure resulting from exacerbations of COPD:
Cochrane systematic review and metaanalysis. BMJ 2003;326:185.
-
Fernández J, López-Campos JL, Perea-Milla E, Pons J, Rivera R, Moreno LF.
Metaanálisis de la eficacia de la ventilación no invasiva en la exacerbación aguda de
la enfermedad pulmonar obstructiva crónica. Med Clin (Barc) 2003;120:281-286.
-
Evans TE. International Consensus Conference in Intensive Care Medicine. Non
invasive positive pressure ventilation in acute respiratory failure. Intensive Care
Med 2000; 27:166-178.
-
Jain S, Hanania NA, Guntupalli KK. Ventilation of patients with asthma and
obstructive lung disease. Crit Care Clin 1998;14:685-705.
-
Siafakas NM, Vermeire P, Pride NB y col. Optimal assessment and management
of chronic obstructive pulmonary disease (COPD). Eur Respir J 1995;8:1398-1420.
-
The COPD Guidelines Group of the Standards of Care Committee of the BTS.
BTS guidelines for the management of chronic obstructive pulmonary disease.
Thorax 1997;52:Suppl 5: S1-S28.
-
American Thoracic Society. Standards for the diagnosis and care of patients
with chronic obstructive pulmonary disease. Am J Respir Crit Care Med
1995;152:Suppl:S77-S121.
-
Pearlman RA. Variability in physician estimates of survival for acute respiratory
failure in chronic obstructive pulmonary disease. Chest 1987;91:515–521
-
Sethi JM, Siegel MD. Mechanical ventilation in chronic obstructive lung disease.
Clin Chest Med 2000;21:799-818.
-
Vanderbergh E, Van de Woestijne KP, Gyselin A. Conservative treatment of
acute respiratory failure in patients with chronic obstructive lung disease. Am Rev
Respir Dis 1968;98:60-69.
-
Sluiter HJ, Brokzyl EJ, Van Dijl W, Van Haeringen JR, Hilvering C, Steenhuis EJ.
Conservative and respirator treatment of acute respiratory insufficiency in patients
with chronic obstructive lung disease: a reappraisal. Am Rev Respir Dis
1972;105:932-942.
-
Burk RH, George RB. Acute respiratory failure in chronic obstructive pulmonary
disease: immediate and long-term prognosis. Arch Intern Med 1973; 132:865-868.
-
Kettel LH. The management of respiratory failure in chronic obstructive lung
disease. Med Clin North Am 1973;57:781-792.
-
Bone RC, Pierce AK, Johnson RL. Controlled oxygen administration in acute
respiratory failure in chronic obstructive pulmonary disease: a reappraisal. Am J
Med 1978; 65:896-902.
-
Petheram IS, Branthwaite MA. Mechanical ventilation for pulmonary disease.
Anaesthesia 1980;35:467-473.
-
Gillespie DJ, Marsh HM, Divertie MB, Meadows JA. Clinical outcome of
respiratory failure in patients requiring prolonged (> 24 hours) mechanical
ventilation. Chest 1986;9:364-369.
-
Spicher JE, White DP. Outcome and function following prolonged mechanical
ventilation. Arch Intern Med 1987;147:421-425.
-
Kaelin RM, Assimacopoulos A, Chevrolet JC. Failure to predict 6-month survival
of patients with COPD requiring mechanical ventilation by analysis of simple indices.
Chest 1987;92:971-978.
-
Menzies R, Gibbons W, Godlberg P. Determinants of weaning and survival
among patients with COPD who require mechanical ventilation for acute respiratory
failure. Chest 1989;95:398-405.
-
Shachor Y, Liberman D, Tamir A, Schlindler D, Weiler Z, Bruderman I. Long-
term survival of patients with chronic obstructive pulmonary disease following
mechanical ventilation. Isr J Med Sci 1989;25:617-619.
-
Ludwigs UG, Baehrendtz S, Wanecek M, Matell G. Mechanical ventilation in
medical and neurological diseases: 11 years of experience. J Intern Med 1991;
229:117-124.
-
Rieves RD, Bass D, Carter RR, Griffith JE, Norman JR. Severe COPD and acute
respiratory failure. Correlates for survival at the time of tracheal intubation. Chest
1993;104:854-860.
-
Nava S, Rubini F, Zanotti E, y col. Survival and prediction of succesful
ventilator weaning in COPD patients requiring mechanical ventilation for more than
21 days. Eur Respir J 1994;7:1645-1652.
-
Seneff MG, Wagner DP, Wagner RP, Zimmerman JE, Knaus WA. Hospital and 1-
year survival of patients admitted to intensive care units with acute exacerbation of
chronic obstructive pulmonary disease. JAMA 1995;274:1852-1857.
-
Moran JL, Green JV, Homan SD, Leeson RJ, Leppard PI. Acute exacerbations of
chronic obstructive pulmonary disease and mechanical ventilation. A reevaluation.
Crit Care Med 1998;26:71-78.
-
Añón JM, García de Lorenzo A, Zarazaga A, Gómez Tello V, Garrido G.
Mechanical ventilation of patients of long-term oxygen therapy with acute
exacerbations of chronic obstructive pulmonary disease: prognosis and cost-utility
analysis. Intensive Care Med 1999;25:452-457.
-
Nevins ML, Epstein SK. Predictors of outcome for patients with COPD requiring
invasive mechanical ventilation. Chest 2001;119:1840-1849.
-
Afessa B, Morales IJ, Scanlon PD, Peters SG. Prognostic factors, clinical course,
and hosital outcome of patients with chronic obstructive pulmonary disease
admitted to an intensive care unit for acute respiratory failure. Crit Care Med
2002;30:1610-1615.
-
Weiss SM, Hudson LD. Outcome from respiratory failure. Crit Care Clin 1994;
10:197-215.
-
Kettel LJ, Diener CF, Morse JO, Stein HF, Burrows B. Treatment of acute
respiratory acidosis in chronic obstructive lung disease. JAMA 1971; 217:1503-
1508.
-
Warren PM, Flenley DC, Millar JS, Avery A. Respiratory failure revisited: acute
exacerbations of chronic bronchitis between 1961-68 and 1970-76. Lancet 1980;
1:467-470.
-
Connors AF, Dawson NV, Thomas C, y col. For the SUPPORT investigators.
Outcomes following acute exacerbation of severe chronic obstructive lung disease.
Am J Respir Crit Care Med 1996;154:959-967.
-
Antonelli Incalzi R, Fuso L, De Rosa M, y col. Co-morbidity contributes to
predict mortality of patients with chronic obstructive pulmonary disease. Eur Respir
J 1997;10:2794-2800.
-
Portier F, Defouilloy C, Muir JF: Determinants of immediate survival among
chronic respiratory insufficiency patients admitted to an intensive care unit for
acute respiratory failure. A prospective multicenter study. The French Task Group
for Acute Respiratory Failure in Chronic Respiratory Insufficiency. Chest
1992;101:204–210.
-
Solsona JF, Miró G, Ferrer A, Cabré L, Torres A. Los criterios de ingreso en UCI
del paciente con EPOC. Documento de reflexión SEMICYUC-SEPAR. Med Intensiva
2001;25:107-112.
|


![]()



